dekstropropoksyfen
 | |
 | |
| Dane kliniczne | |
|---|---|
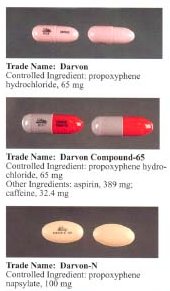
| Nazwy handlowe | Darvon |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a682325 |
| Dane licencyjne |
|
| Kategoria ciąży |
|
Drogi podania |
Doustnie , IV, doodbytniczo |
| Kod ATC | |
| Status prawny | |
| Status prawny |
|
| Dane farmakokinetyczne | |
| Biodostępność | 40% |
| Wiązanie białek | 78% |
| Metabolizm | Za pośrednictwem wątroby, za pośrednictwem CYP3A4 N-demetylacja (główna), hydroksylacja aromatyczna (mniejsza) i hydroliza estrów (mniejsza) |
| Okres półtrwania w fazie eliminacji | 6–12 godzin; 30–36 godzin (aktywny metabolit, nordekstropropoksyfen) |
| Wydalanie | Mocz (główny), mleko matki (mniejszy) |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| Bank Leków | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA | 100.006.747 |
| Dane chemiczne i fizyczne | |
| Formuła | C22H29NO2 _ _ _ _ _ _ |
| Masa cząsteczkowa | 339,479 g · mol -1 |
| Model 3D ( JSmol ) | |
| Temperatura topnienia | 75 ° C (167 ° F) |
| |
| |
|
| |
Dextropropoxyphene to środek przeciwbólowy z kategorii opioidów , opatentowany w 1955 roku i wyprodukowany przez firmę Eli Lilly and Company . Jest izomerem optycznym lewopropoksyfenu . Jest przeznaczony do leczenia łagodnego bólu, a także ma działanie przeciwkaszlowe (tłumiące kaszel) i miejscowo znieczulające . Lek został wycofany z rynku w Europie i Stanach Zjednoczonych z powodu obaw związanych ze śmiertelnym przedawkowaniem i zaburzeniami rytmu serca. Nadal jest dostępny w Australii, choć z ograniczeniami po złożeniu wniosku przez producenta o przegląd proponowanego zakazu. Mówi się, że początek działania przeciwbólowego (łagodzenia bólu) ma miejsce po 20–30 minutach, a szczytowe efekty obserwuje się po około 1,5–2,0 godzinach po podaniu doustnym.
Dextropropoxyphene jest czasami łączony z acetaminofenem . Nazwy handlowe obejmują Darvocet-N, Di-Gesic i Darvon z APAP (dla dekstropropoksyfenu i paracetamolu). Brytyjska zatwierdzona nazwa (tj. ogólna nazwa składnika aktywnego) preparatu paracetamol/dekstropropoksyfen to co-proxamol (sprzedawany pod różnymi nazwami handlowymi); jednak został wycofany od 2007 roku i nie jest już dostępny dla nowych pacjentów, z wyjątkami. Kombinacje paracetamolu są znane jako Capadex lub Di-Gesic w Australii , Lentogesic w Afryce Południowej i Di-Antalvic we Francji (w przeciwieństwie do co-proxamolu, który jest zatwierdzoną nazwą, wszystkie są markami).
Dextropropoxyphene jest znany pod kilkoma synonimami, w tym:
- propionian alfa-d-4-dimetyloamino-3-metylo-1,2-difenylo-2-butanolu
- [(2S , 3R ) -4-(dimetyloamino)-3-metylo-1,2-difenylobutan-2-ylo]propanian
- (+)-1,2-difenylo-2-propionoksy-3-metylo-4-di-metyloaminobutan
- dezoksypropiofen
Używa
Znieczulenie
Dekstropropoksyfen jest ogólnie uważany za słaby środek przeciwbólowy, a kilka badań wykazało, że jego skuteczność nie jest lepsza niż acetaminofen. Podobnie jak kodeina , jest słabym opioidem , jednak ma jedną trzecią do połowy swojej aktywności przeciwbólowej.
Syndrom niespokojnych nóg
Stwierdzono, że dekstropropoksyfen jest pomocny w łagodzeniu objawów zespołu niespokojnych nóg .
Przeciwwskazania
Dekstropropoksyfen jest przeciwwskazany u pacjentów uczulonych na paracetamol (acetaminofen) lub dekstropropoksyfen oraz u alkoholików . Nie jest przeznaczony do stosowania u pacjentów ze skłonnością do samobójstw, lęków, paniki lub uzależnień.
Skutki uboczne
Ciężka toksyczność może wystąpić przy niewielkich przyrostach powyżej dawki terapeutycznej, w tym kardiotoksyczność i śmiertelne przedawkowanie. Jest to szczególnie prawdziwe, gdy lek jest łączony z alkoholem. Inne działania niepożądane obejmują:
- Zaparcie
- Swędzący
- Senność
- Mdłości
- Głuchota odbiorcza
Farmakologia
Dekstropropoksyfen działa jako agonista receptora opioidowego mu . Działa również jako silny, niekompetycyjny antagonista neuronalnych nikotynowych receptorów acetylocholiny α 3 β 4 , jak również jako słaby inhibitor wychwytu zwrotnego serotoniny .
Toksyczność
Przedawkowanie dzieli się zwykle na dwie kategorie - toksyczne działanie na wątrobę (spowodowane zatruciem paracetamolem ) i przedawkowanie dekstropropoksyfenu.
Przedawkowanie dekstropropoksyfenu może prowadzić do różnych działań ogólnoustrojowych. Nadmierna stymulacja receptorów opioidowych jest odpowiedzialna za depresję ośrodkowego układu nerwowego , depresję oddechową , zachłystowe zapalenie płuc , zwężenie źrenic i skutki żołądkowo-jelitowe obserwowane w zatruciu propoksyfenem. Może to również odpowiadać za nastrój lub myślenie . W obecności amfetaminy przedawkowanie propoksyfenu zwiększa pobudzenie ośrodkowego układu nerwowego i może spowodować śmiertelne drgawki.
Ponadto zarówno propoksyfen, jak i jego metabolit norpropoksyfen mają miejscowe działanie znieczulające w stężeniach około 10 razy większych niż niezbędne do działania opioidów. Norpropoksyfen jest silniejszym środkiem znieczulającym miejscowo niż propoksyfen i oba są silniejsze niż lidokaina . Wydaje się, że miejscowe działanie znieczulające jest odpowiedzialne za arytmie i depresję sercowo-naczyniową obserwowane w zatruciu propoksyfenem.
Zarówno propoksyfen, jak i norpropoksyfen są silnymi blokerami kanałów sodowych błony sercowej i pod tym względem są silniejsze niż lidokaina, chinidyna i prokainamid . W rezultacie wydaje się, że propoksyfen i norpropoksyfen mają właściwości leków przeciwarytmicznych klasy Ic według Vaughna-Williamsa .
Te bezpośrednie skutki sercowe obejmują zmniejszenie częstości akcji serca (tj. depresję sercowo-naczyniową), zmniejszoną kurczliwość i zmniejszoną przewodność elektryczną (tj. wydłużenie odstępów PR, AH, HV i QRS). Wydaje się, że efekty te wynikają z ich miejscowego działania znieczulającego i nie są odwracane przez nalokson . Wydaje się, że poszerzenie zespołu QRS jest wynikiem działania propoksyfenu podobnego do chinidyny, a wodorowęglanem sodu wydaje się mieć pozytywny bezpośredni wpływ na zaburzenia rytmu QRS.
Napady padaczkowe mogą być wynikiem działania opioidów lub miejscowego środka znieczulającego. Obrzęk płuc może wynikać z bezpośredniej toksyczności płucnej , skutków neurogennych / beztlenowych lub depresji sercowo-naczyniowej.
zaburzenia równowagi , z ryzykiem upadków z wysokości stojącej.
Dostępne formularze
Propoksyfen został początkowo wprowadzony jako chlorowodorek propoksyfenu. Tuż przed wygaśnięciem patentu na propoksyfen wprowadzono na rynek postać napsylanu propoksyfenu. , że sól napsylanowa (sól kwasu naftalenosulfonowego ) jest mniej podatna na zastosowania niemedyczne, ponieważ jest prawie nierozpuszczalna w wodzie, więc nie można jej stosować do iniekcji. Napsylan daje również niższy szczytowy poziom we krwi. Ze względu na różną masę cząsteczkową, dawka 100 mg napsylanu propoksyfenu jest wymagana do dostarczenia ilości propoksyfenu równoważnej ilości obecnej w 65 mg chlorowodorku propoksyfenu.
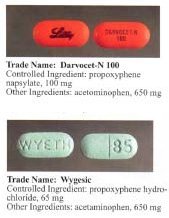
Przed wycofaniem przez FDA chlorowodorek dekstropropoksyfenu był dostępny w Stanach Zjednoczonych jako preparat na receptę zawierający paracetamol (acetaminofen) w stosunku od 30 mg/600 mg do 100 mg/650 mg (lub 100 mg/325 mg w przypadku Balacet ), odpowiednio. Są one zwykle nazywane Darvocet . Darvon to czysty preparat propoksyfenowy, który nie zawiera paracetamolu.
W Australii dekstropropoksyfen jest dostępny na receptę, zarówno jako produkt złożony (32,5 mg dekstropropoksyfenu na 325 mg paracetamolu pod marką Di-gesic, Capadex lub Paradex; jest również dostępny w czystej postaci (kapsułki 100 mg) znanej jako Doloxene, jednak jego użycie zostało ograniczone.
Testowanie narkotyków
Wykrywalne poziomy propoksyfenu/dekstropropoksyfenu mogą pozostawać w organizmie człowieka do 9 dni po ostatniej dawce i mogą być badane specjalnie w niestandardowej analizie moczu, ale mogą pozostawać w organizmie dłużej w niewielkich ilościach. Propoksyfen nie pojawia się w standardowych testach na opiaty/opioidy, ponieważ nie jest chemicznie spokrewniony z opiatami jako część paneli OPI lub OPI 2000, które wykrywają morfinę i związki pokrewne. Jest najbardziej spokrewniony z metadonem .
Historia
Dekstropropoksyfen został pomyślnie przetestowany w 1954 roku w ramach finansowanych przez US Navy i CIA badań nad nieuzależniającymi substytutami kodeiny .
Zastosowanie w syntezie organicznej
Bez grupy propionylowej na atomie tlenu, niezestryfikowany alkoholowy prekursor propoksyfenu (oba enancjomery, znane jako alkohol darvona i alkohol nowrada) został zastosowany jako stechiometryczne odczynniki chiralne w reakcjach asymetrycznej redukcji karbonylowej z udziałem odczynników wodorku glinu.
Kontrowersje i regulacje dotyczące użytkowania
Dekstropropoksyfen jest przedmiotem pewnych kontrowersji; podczas gdy wielu lekarzy przepisuje go w szerokim zakresie łagodnych do średnio bolesnych objawów, a także w leczeniu biegunki , wielu innych odmawia przepisywania go, powołując się na ograniczoną skuteczność. Ponadto indeks terapeutyczny dekstroproksyfenu jest stosunkowo wąski.
Należy zachować ostrożność podczas podawania dekstropropoksyfenu, zwłaszcza dzieciom i osobom w podeszłym wieku oraz pacjentkom, które mogą być w ciąży lub karmią piersią; inne zgłaszane problemy obejmują zaburzenia nerek, wątroby lub układu oddechowego oraz długotrwałe stosowanie. Należy zwrócić uwagę na jednoczesne stosowanie ze środkami uspokajającymi, przeciwdepresyjnymi lub nadmiernym spożyciem alkoholu.
Darvon, preparat dekstropropoksyfenu stworzony przez Eli Lilly , który był na rynku od 25 lat, znalazł się pod ciężkim ostrzałem w 1978 roku przez grupy konsumenckie, które twierdziły, że jest to związane z samobójstwem . Darvon nigdy nie został wycofany z rynku, aż do niedawna, ale Lilly przeprowadziła szeroko zakrojoną i w dużej mierze udaną kampanię [ potrzebne źródło ] wśród lekarzy, farmaceutów i użytkowników Darvon, aby bronić leku jako bezpiecznego, gdy jest stosowany we właściwych dawkach i nie zmieszany z alkoholem. Po ustaleniu, że ryzyko przewyższa korzyści, USFDA zażądała od lekarzy zaprzestania przepisywania leku. 19 listopada 2010 r. FDA ogłosiła, że firma Xanodyne Pharmaceuticals zgodziła się wycofać Darvon i Darvocet w Stanach Zjednoczonych, a następnie producenci dekstropropoksyfenu.
Australia
W Australii zarówno czyste kapsułki dekstropropoksyfenu (w postaci napsylanu, 100 mg), sprzedawane jako Doloxene, jak i tabletki złożone i kapsułki (z paracetamolem), wszystkie zawierające 32,5 mg chlorowodorku dekstropropoksyfenu z 325 mg paracetamolu, które są obecnie dostępne na receptę, miały zostać wycofane od 1 marca 2012 r., ale Aspen Pharma zwróciła się o rewizję do Administracyjnego Trybunału Apelacyjnego, który orzekł w 2013 r., że leki mogą być sprzedawane na ściśle określonych warunkach.
Kanada
W dniu 1 grudnia 2010 r. Health Canada i Paladin Labs Inc. ogłosiły dobrowolne wycofanie i wycofanie Darvon-N z rynku kanadyjskiego oraz zaprzestanie sprzedaży Darvon-N.
Unia Europejska
W listopadzie 2007 r. Komisja Europejska zwróciła się do Europejskiej Agencji Leków (EMA) o dokonanie przeglądu bezpieczeństwa i skuteczności leków zawierających dekstropropoksyfen, a 25 czerwca 2009 r. EMA zaleciła stopniowe wycofywanie leku w całej Unii Europejskiej . Wniosek EMA opierał się na dowodach, że leki zawierające dekstropropoksyfen są słabymi środkami przeciwbólowymi, połączenie dekstropropoksyfenu i paracetamolu nie było skuteczniejsze niż sam paracetamol, a różnica między dawką potrzebną do leczenia a dawką szkodliwą („wskaźnik terapeutyczny ") był za mały.
Nowa Zelandia
W lutym 2010 r. Firma Medsafe ogłosiła, że Paradex i Capadex (formy dekstropropoksyfenu) są wycofywane z rynku z powodu problemów zdrowotnych i wycofania w innych krajach.
Indie
W dniu 12 czerwca 2013 r. Rząd Indii zawiesił produkcję, sprzedaż i dystrybucję leku na mocy sekcji 26A ustawy o lekach i kosmetykach z 1940 r.
Szwecja
W Szwecji agencja produktów medycznych od dawna zniechęcała lekarzy do przepisywania dekstropropoksyfenu ze względu na ryzyko depresji oddechowej, a nawet śmierci w przypadku przyjmowania z alkoholem. Wcześniej zalecano lekarzom przepisywanie produktów zawierających wyłącznie dekstropropoksyfen, a nie pacjentom z zaburzeniami związanymi z używaniem substancji , depresją lub tendencjami samobójczymi w wywiadzie. Produkty z mieszanymi składnikami aktywnymi zostały wycofane z rynku i dopuszczono do sprzedaży tylko produkty z dekstropropoksyfenem. Dekstropoksyfen był de facto oznakowany jako narkotyk .
Od marca 2011 roku wszystkie produkty zawierające tę substancję są wycofywane ze względów bezpieczeństwa po decyzji Komisji Europejskiej .
W tamtym czasie mówiono, że osoby, które piły nadmierne ilości alkoholu i innych substancji i przyjmowały kombinację dekstropoksyfenu / acetaminofenu (paracetamolu), potrzebowały wielu tabletek złożonych, aby osiągnąć euforię , ponieważ ilość dekstropropoksyfenu w jednej tabletce jest stosunkowo niska (30–40 mg). Spożyty paracetamol – drugi składnik – może wówczas osiągnąć poziom toksyczny dla wątroby. W przypadku alkoholików, którzy często mają już uszkodzoną wątrobę, nawet stosunkowo niewielkie przedawkowanie paracetamolu może wywołać hepatotoksyczność , niewydolność wątroby i martwicę . Ta toksyczność w połączeniu z przedawkowanym dekstroproksyfenem (z jego ośrodkowym układem nerwowym / depresją oddechową / wymiotami z ryzykiem zachłystowego zapalenia płuc , a także kardiotoksycznością ) i uszkodzeniem wątroby wywołanym przez paracetamol może spowodować śmierć.
Zjednoczone Królestwo
W Wielkiej Brytanii preparaty zawierające tylko dekstropropoksyfen zostały wycofane w 2004 roku. W 2007 roku Agencja Regulacyjna ds. Leków i Produktów Opieki Zdrowotnej cofnęła licencję na ko-proksamol, zwany także dystalgezem. Od tego czasu w Wielkiej Brytanii ko-proksamol jest dostępny tylko dla imiennego pacjenta, w przypadku długotrwałego przewlekłego bólu i tylko dla tych, którym już przepisano ten lek. Jego wycofanie z rynku brytyjskiego wynika z obaw związanych z jego toksycznością przy przedawkowaniu (nawet niewielkie przedawkowanie może być śmiertelne) oraz niebezpieczną reakcją z alkoholem. Użytkowanie rekreacyjne w Wielkiej Brytanii jest rzadkością. Wielu pacjentom przepisano alternatywne kombinacje leków jako zamienniki.
Motywacją do wycofania ko-proksamolu było zmniejszenie liczby samobójstw, a kluczowa część uzasadnienia decyzji agencji opierała się na badaniach wykazujących, że ko-proksamol nie jest skuteczniejszy niż sam paracetamol w leczeniu bólu.
Dostępne w Wielkiej Brytanii preparaty ko-proksamolu zawierały subterapeutyczną dawkę paracetamolu, 325 mg na tabletkę. Pacjentów ostrzeżono, aby nie przyjmowali więcej niż ośmiu tabletek jednego dnia, co daje całkowitą dawkę 2600 mg paracetamolu na dobę. Pomimo tego obniżonego poziomu pacjenci nadal byli narażeni na wysokie ryzyko przedawkowania; koproksamol był drugim po trójpierścieniowych lekach przeciwdepresyjnych najczęstszym lekiem na receptę stosowanym w przypadku przedawkowania. Po ograniczeniu przepisywania leku w latach 2005-2007, przed jego całkowitym wycofaniem, liczba zgonów związanych z tym lekiem znacząco spadła. Ponadto pacjenci nie zastąpili innych leków jako metody przedawkowania.
Decyzja o odstawieniu ko-proksamolu spotkała się z pewnymi kontrowersjami; był dwukrotnie poruszany w Izbie Gmin, 13 lipca 2005 r. i 17 stycznia 2007 r. Pacjenci znaleźli alternatywy dla ko-proksamolu albo zbyt silne, zbyt słabe, albo z nie do zniesienia skutkami ubocznymi. [ potrzebne źródło ] Podczas debat w Izbie Gmin cytowano, że pierwotnie około 1 700 000 pacjentów w Wielkiej Brytanii przepisano ko-proksamol. Po stopniowym wycofywaniu liczba ta została ostatecznie zmniejszona do 70 000. Jednak najwyraźniej jest to pozostała pula pacjentów, którzy nie mogą znaleźć alternatywnego środka przeciwbólowego do ko-proksamolu. [ potrzebne źródło ]
Siatka bezpieczeństwa przepisywania ko-proksamolu po cofnięciu licencji od 31 grudnia 2007 r., na podstawie „imiennego pacjenta”, w przypadku gdy lekarze zgadzają się, że istnieje potrzeba kliniczna, została odrzucona przez większość lekarzy w Wielkiej Brytanii [potrzebne źródło], ponieważ sformułowanie, że „ odpowiedzialność spadnie na receptę” jest nie do przyjęcia dla większości lekarzy. Niektórzy pacjenci zamierzają skierować sprawę do Europejskiego Trybunału Praw Człowieka. Jednak Europejska Agencja Leków niedawno poparła decyzję agencji iw czerwcu 2009 roku zaleciła wycofanie preparatów propoksyfenu w całej Unii Europejskiej.
W dniu 28 marca 2017 r. Komisarze kliniczni NHS ogłosili, że ko-proksamol nie będzie już dostępny w ramach NHS England w ramach 400 milionów funtów cięć wydatków na recepty, które mają niewielką lub żadną wartość kliniczną.
Stany Zjednoczone
W styczniu 2009 roku komitet doradczy FDA głosował 14 do 12 przeciwko dalszemu wprowadzaniu do obrotu produktów propoksyfenu, opierając się na jego słabych właściwościach przeciwbólowych, właściwościach uzależniających, związku ze zgonami związanymi z narkotykami i możliwymi problemami z sercem, w tym arytmią . Późniejsza ponowna ocena zaowocowała zaleceniem z lipca 2009 r., Aby wzmocnić ostrzeżenie w ramce dotyczące propoksyfenu, aby odzwierciedlić ryzyko przedawkowania. Dextropropoxyphene następnie nosił ostrzeżenie o czarnej skrzynce w USA, stwierdzając:
Propoksyfen należy stosować z najwyższą ostrożnością, jeśli w ogóle, u pacjentów z nadużywaniem substancji/narkotyków/alkoholu w wywiadzie, depresją z tendencją samobójczą lub którzy już przyjmują leki powodujące senność (np. leki przeciwdepresyjne, zwiotczające mięśnie, przeciwbólowe, uspokajające, uspokajające). U takich pacjentów dochodziło do zgonów, gdy propoksyfen był niewłaściwie stosowany.
Ze względu na potencjalne działania niepożądane lek ten znajduje się na liście leków wysokiego ryzyka u osób starszych.
19 listopada 2010 r. FDA zażądała od producentów wycofania propoksyfenu z rynku amerykańskiego, powołując się na arytmię serca u pacjentów, którzy przyjmowali lek w typowych dawkach. Tramadol , który nie ma kardiotoksyczności, został zalecany zamiast propoksyfenu, ponieważ jest również wskazany w przypadku łagodnego do umiarkowanego bólu i jest mniej prawdopodobne, że będzie nadużywany lub powoduje uzależnienie niż inne opioidy.
Używany przez społeczeństwa, które mają prawo do śmierci
Wysoka toksyczność i stosunkowo łatwa dostępność sprawiły, że propoksyfen stał się lekiem z wyboru dla społeczeństw, które mają prawo do śmierci. Jest ona wymieniona w podręczniku The Peaceful Pill Handbook dr Philipa Nitschke oraz w Guide to a Humane Self-Chosen Death autorstwa dr Pietera Admiraala . „Wraz z wycofaniem zawierających barbiturany z listy leków do przepisywania, propoksyfen stał się najczęściej przepisywanym przez lekarzy lekiem stosowanym przez ciężko chorych ludzi w celu zakończenia życia”.