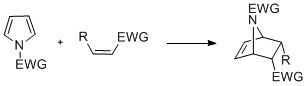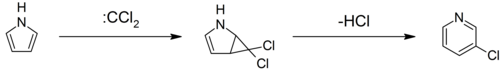Pirol
|
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
1H - pirol |
|||
Inne nazwy
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 1159 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.003.387 | ||
| Numer WE |
|
||
| 1705 | |||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
| UNII | |||
| Numer ONZ | 1992, 1993 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C4H5N _ _ _ _ | |||
| Masa cząsteczkowa | 67,091 g · mol -1 | ||
| Gęstość | 0,967 g cm -3 | ||
| Temperatura topnienia | -23 ° C (-9 ° F; 250 K) | ||
| Temperatura wrzenia | 129 do 131 ° C (264 do 268 ° F; 402 do 404 K) | ||
| Ciśnienie pary | 7 mmHg przy 23°C | ||
| Kwasowość ( p Ka ) | 16,5 (dla protonu N-H) | ||
| Zasadowość (p K b ) | 13,6 (p Ka 0,4 dla CA ) | ||
| −47,6 × 10 −6 cm 3 mol −1 | |||
| Lepkość | 0,001225 Pa·s | ||
| Termochemia | |||
|
Pojemność cieplna ( C )
|
1,903 JK -1 mol -1 | ||
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
108,2 kJ mol -1 (gaz) | ||
|
Standardowa entalpia spalania (Δ c H ⦵ 298 ) |
2242 kJ mol -1 | ||
| Zagrożenia | |||
| NFPA 704 (ognisty diament) | |||
| Punkt zapłonu | 33,33 ° C (91,99 ° F; 306,48 K) | ||
| 550 ° C (1022 ° F; 823 K) | |||
| Wybuchowe granice | 3,1–14,8% | ||
| Karta charakterystyki (SDS) | Dane bezpieczeństwa chemicznego | ||
| Związki pokrewne | |||
|
Związki pokrewne
|
Fosfor , arsole , bismole , stibole | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Pirol jest heterocyklicznym , aromatycznym związkiem organicznym , pięcioczłonowym pierścieniem o wzorze C 4 H 4 NH . Jest to bezbarwna lotna ciecz, która łatwo ciemnieje pod wpływem powietrza. Podstawione pochodne są C4H4NCH3 . . N również nazywane pirolami, np - metylopirol , Porfobilinogen , trójpodstawiony pirol, jest biosyntetycznym prekursorem wielu produktów naturalnych, takich jak hem .
są składnikami bardziej złożonych makrocykli, w tym porfirynogenów i ich produktów pochodnych, w tym porfiryn hemu , chloryn , bakteriochloryn i chlorofili .
Nieruchomości
Pirol jest bezbarwną lotną cieczą, która łatwo ciemnieje pod wpływem powietrza i jest zwykle oczyszczana przez destylację bezpośrednio przed użyciem. Pyrrol ma orzechowy zapach. Pirol jest 5-członowym aromatycznym heterocyklem, takim jak furan i tiofen . W przeciwieństwie do furanu i tiofenu ma dipol, w którym dodatni koniec leży po stronie heteroatomu, a moment dipolowy wynosi 1,58 D . W CDCI 3 , ma przesunięcia chemiczne przy 6,68 (H2, H5) i 6,22 (H3, H4). Pirol jest wyjątkowo słabą zasadą dla aminy, ze sprzężonym kwasem p Ka równym -3,8. Najbardziej stabilny termodynamicznie kation pirolu (C 4 H 6 N + ) powstaje w wyniku protonowania w pozycji 2. Zastąpienie pirolu podstawnikami alkilowymi zapewnia bardziej zasadową cząsteczkę - na przykład tetrametylopirol ma sprzężony kwas p Ka o wartości +3,7. Pirol jest również słabo kwaśny w pozycji N – H, z ap Ka z 16,5. Jako kwas Lewisa z wiązaniami wodorowymi jest klasyfikowany jako kwas twardy , a model ECW podaje jego parametry kwasowe jako EA = 1,38 i CA = 0,68 .
Historia
Pirol został po raz pierwszy wykryty przez FF Runge w 1834 r. Jako składnik smoły węglowej . W 1857 roku został wyizolowany z pirolizy kości. Jego nazwa pochodzi od greckiego pyrrhos ( πυρρός , „czerwonawy, ognisty”), od reakcji użytej do jego wykrycia — czerwonego koloru, jaki nadaje drewnu zwilżonemu kwasem solnym .
Występowanie w przyrodzie
Sam pirol nie występuje naturalnie [ potrzebne źródło ] , ale wiele jego pochodnych znajduje się w różnych kofaktorach i produktach naturalnych . Częste naturalnie wytwarzane cząsteczki zawierające pirole obejmują witaminę B 12 , barwniki żółciowe takie jak bilirubina i biliwerdyna oraz porfiryny hemu , chlorofil , chloryny , bakteriochloryny i porfirynogeny. Inne metabolity wtórne zawierające pirol obejmują PQQ, makaluwaminę M, ryanodynę, rhazinilam, lamellarin, prodigiosin, myrmicarin i sceptrin. Synteza heminy zawierającej pirol, zsyntetyzowana przez Hansa Fischera, została nagrodzona Nagrodą Nobla.
Pirol jest składnikiem dymu tytoniowego i może przyczyniać się do jego działania toksycznego.
Synteza
Al2O3 jak jest wytwarzany SiO2 przemysłowo przez traktowanie furanu amoniakiem w obecności stałych katalizatorów kwasowych , takich i .
Pirol można również wytworzyć przez katalityczne odwodornienie pirolidyny.
Trasy laboratoryjne
Opisano kilka syntez pierścienia pirolu.
Synteza pirolu Hantzscha
Synteza pirolu Hantzscha polega na reakcji β-ketoestrów ( 1 ) z amoniakiem (lub pierwszorzędowymi aminami) i α-haloketonami ( 2 ) z wytworzeniem podstawionych piroli ( 3 ).
Synteza pirolu Knorra
Synteza pirolu metodą Knorra obejmuje reakcję α-aminoketonu lub α-amino-β-ketoestru z aktywowanym związkiem metylenowym. Metoda polega na reakcji α- aminoketonu ( 1 ) i związku zawierającego grupę metylenową α w (połączoną z następnym atomem węgla) grupę karbonylową ( 2 ).
Synteza pirolu Paala-Knorra
W syntezie pirolu Paala – Knorra związek 1,4-dikarbonylowy reaguje z amoniakiem lub aminą pierwszorzędową, tworząc podstawiony pirol.
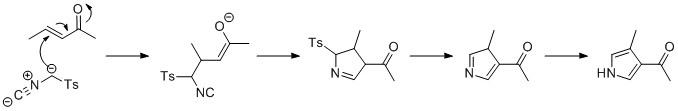
Reakcja Van Leusena
Reakcję Van Leusena można wykorzystać do wytworzenia piroli w reakcji izocyjanku tosylometylu (TosMIC) z enonem w obecności zasady, z dodatkiem Michaela . Cyklizacja 5- endo tworzy następnie 5-członowy pierścień, który reaguje w celu wyeliminowania grupy tosylowej. Ostatnim etapem jest tautomeryzacja do pirolu. [ potrzebne źródło ]
Synteza Bartona-Zarda
Synteza Bartona-Zarda przebiega w sposób podobny do syntezy Van Leusena. Izocyjanooctan reaguje z nitroalkenem w addycji 1,4, po której następuje cyklizacja 5- endo - dig , eliminacja grupy nitrowej i tautomeryzacja .
Synteza pirolu Piloty'ego-Robinsona
Materiały wyjściowe w syntezie pirolu Piloty-Robinsona, nazwane na cześć Gertrudy i Roberta Robinsona oraz Oskara Piloty'ego , to dwa odpowiedniki aldehydu i hydrazyny . Produkt jest pirolem z podstawnikami w pozycjach 3 i 4. Aldehyd reaguje z diaminą do pośredniej diiminy ( R−C=N−N=C−R). W drugim etapie pomiędzy zachodzi przegrupowanie [3,3]-sigmatropowe . Dodatek kwasu solnego prowadzi do zamknięcia pierścienia i utraty amoniaku do utworzenia pirolu. Mechanizm został opracowany przez Robinsonów .
W jednej modyfikacji aldehyd propionowy jest traktowany najpierw hydrazyną , a następnie chlorkiem benzoilu w wysokich temperaturach i wspomagany promieniowaniem mikrofalowym :
Trasy oparte na Cycloaddition
Pirole z wieloma podstawnikami otrzymuje się w reakcji münchnonów i alkinów . Mechanizm reakcji obejmuje 1,3-dipolarną cykloaddycję , po której następuje utrata dwutlenku węgla w procesie retro- Dielsa-Aldera . Podobne reakcje można przeprowadzić stosując azalaktony.
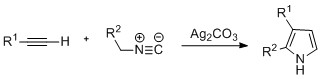
Pirole można wytworzyć przez katalizowaną srebrem cyklizację alkinów z izonitrylami , gdzie R2 oznacza grupę elektronoakceptorową, a R1 oznacza alkan, grupę arylową lub ester. Zaobserwowano również, że przykłady dipodstawionych alkinów tworzą pożądany pirol ze znaczną wydajnością. Proponuje się, aby reakcja przebiegała przez acetylenkowy srebra . Ta metoda jest analogiczna do chemii kliknięć azydkowo-alkinowych stosowanej do tworzenia azoli.
Inne metody
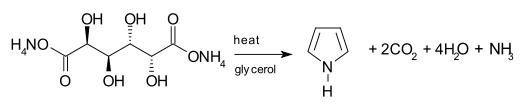
Jedna syntetyczna droga do pirolu obejmuje dekarboksylację śluzanu amonu , soli amonowej kwasu śluzowego . Sól jest zazwyczaj podgrzewana w do destylacji z gliceryną jako rozpuszczalnikiem .
Biosynteza piroli
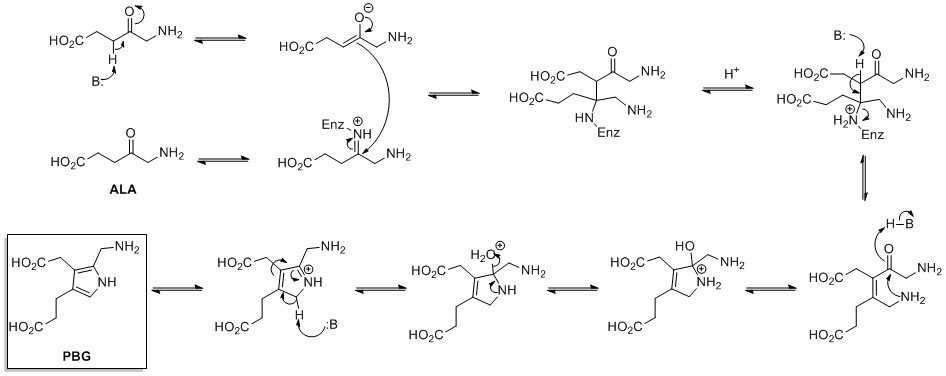
Biosynteza de novo pierścieni pirolu rozpoczyna się od kwasu aminolewulinowego (ALA), który jest syntetyzowany z glicyny i sukcynylo-CoA . Dehydrataza ALA katalizuje kondensację dwóch cząsteczek ALA poprzez typu Knorra , tworząc porfobilinogen (PBG). To później reaguje, tworząc na przykład makrocykle, hem i chlorofil .
.
Prolina jest biosyntetycznie otrzymywana z aminokwasu L - glutaminianu . Glutaminian-5-semialdehyd jest najpierw tworzony przez kinazę glutaminianu 5 (zależną od ATP) i dehydrogenazę glutaminian-5-semialdehydu (która wymaga NADH lub NADPH). Może to następnie albo spontanicznie cyklizować, tworząc kwas 1-pirolino-5-karboksylowy , który jest redukowany do proliny przez reduktazę pirolino-5-karboksylanową (przy użyciu NADH lub NADPH) lub przekształcany w ornitynę przez aminotransferazę ornityny , a następnie cyklizacja przez cyklodeaminazę ornityny z wytworzeniem proliny.

Prolina może być stosowana jako prekursor aromatycznych piroli w wtórnych produktach naturalnych, takich jak prodigiozyny.
Biosynteza prodigiozyny obejmuje konwergentne sprzęganie trzech pierścieni pirolowych (oznaczonych jako A, B i C na rycinie 1) z L -proliny, L -seryny, L -metioniny, pirogronianu i 2-oktenalu.
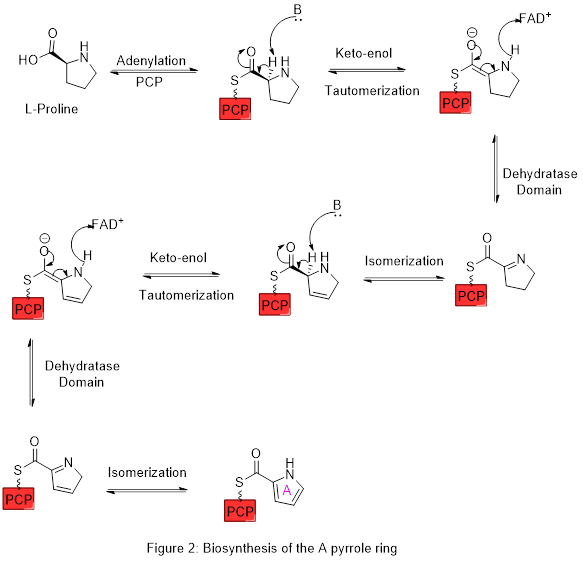
Pierścień A jest syntetyzowany z L -proliny poprzez szlak nierybosomalnej syntazy peptydowej (NRPS) (ryc. 2), w którym pierścień pirolidynowy proliny jest dwukrotnie utleniany przez FAD + , dając pierścień pirolowy A.
Pierścień A jest następnie rozszerzany przez szlak syntazy poliketydowej w celu włączenia L -seryny do pierścienia B (figura 3). Fragment pierścienia A jest przenoszony z peptydylowego białka nośnikowego (PCP) do acylowego białka nośnego (ACP) przez domenę KS, a następnie przenoszony do malonylo-ACP poprzez dekarboksylacyjną kondensację Claisena. L - seryny za pośrednictwem PLP , który cyklizuje w reakcji odwodnienia, dając drugi pierścień pirolu. Ten związek pośredni jest następnie modyfikowany przez metylację (która zawiera grupę metylową z L -metionina na alkohol w pozycji 6) i utlenienie alkoholu pierwszorzędowego do aldehydu w celu uzyskania rdzeniowych struktur pierścieniowych A – B.
Reakcje i reaktywność
Ze względu na swój aromatyczny charakter pirol jest trudny do uwodornienia , nie reaguje łatwo jako dien w reakcjach Dielsa-Aldera i nie podlega zwykłym reakcjom olefinowym . Jego reaktywność jest podobna do reaktywności benzenu i aniliny , ponieważ łatwo jest alkilować i acylować. W warunkach kwaśnych pirole polimeryzują , a zatem wiele z nich jest elektrofilowych odczynniki stosowane w chemii benzenu nie mają zastosowania do piroli. W przeciwieństwie do tego, podstawione pirole (w tym zabezpieczone ) stosowano w szerokim zakresie przekształceń.
Reakcja pirolu z elektrofilami
Pirole na ogół reagują z elektrofilami w pozycji α (C2 lub C5), ze względu na najwyższy stopień stabilności protonowanego związku pośredniego.
Pirole łatwo reagują z nitrowaniem (np. HNO 3 / Ac 2 O ), sulfonowaniem ( Py·SO 3 ) i halogenowaniem (np . NCS , NBS , Br 2 , SO 2 Cl 2 i KI / H 2 O 2 ) agentów. Halogenowanie ogólnie zapewnia polihalogenowane pirole, ale można przeprowadzić monohalogenację. Jak to jest typowe dla elektrofilowych addycji do piroli, halogenowanie zwykle zachodzi w pozycji 2, ale może również zachodzić w pozycji 3 przez silowanie azotu. Jest to użyteczna metoda dalszej funkcjonalizacji generalnie mniej reaktywnej pozycji 3. [ potrzebne źródło ]
acylowanie
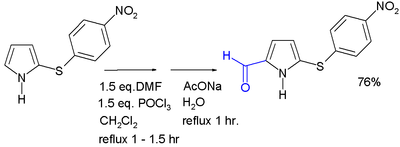
Acylowanie na ogół zachodzi w pozycji 2, przy użyciu różnych metod. Acylowanie bezwodnikami kwasowymi i chlorkami kwasowymi może zachodzić bez katalizatora; alternatywnie można zastosować kwas Lewisa . 2-acylopirole są również otrzymywane w reakcji z nitrylami w reakcji Houbena – Hoescha . Aldehydy pirolowe mogą powstawać w reakcji Vilsmeiera-Haacka . N -acylowanie prostego pirolu nie zachodzi. [ potrzebne źródło ]
alkilowanie
Elektrofilowe alkilowanie prostego pirolu jest rzadkie. Zaobserwowano alkilowanie z utworzeniem enonów w C2. [ potrzebne źródło ]
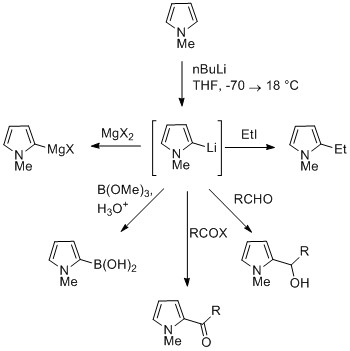
Reakcja deprotonowanego pirolu
Proton NH w pirolach jest umiarkowanie kwaśny, a p Ka wynosi 16,5. Pirol można odprotonować mocnymi zasadami, takimi jak butylolit i wodorek sodu . Powstały pirolid alkaliczny jest nukleofilowy . Traktowanie tej sprzężonej zasady elektrofilem, takim jak jodometan, daje N -metylopirol. N -Metalowany pirol może reagować z elektrofilami w pozycjach N lub C, w zależności od metalu koordynującego. Więcej jonowych wiązań azot-metal (takich jak lit, sód i potas) oraz więcej rozpuszczalników solwatujących prowadzi do N -alkilowanie. Metale nitrofilowe, takie jak MgX, prowadzą do alkilowania przy C (głównie C2), ze względu na wyższy stopień koordynacji z atomem azotu. W przypadku N -podstawionych piroli metalowanie węgli jest łatwiejsze. Grupy alkilowe można wprowadzać jako elektrofile lub w reakcjach krzyżowego sprzęgania. [ potrzebne źródło ]
Podstawienie przy C3 można osiągnąć przez zastosowanie N -podstawionego 3-bromopirolu, który można zsyntetyzować przez bromowanie N -sililopirolu za pomocą NBS . [ potrzebne źródło ]
Redukcje
Pirole mogą ulegać redukcjom do pirolidyn i pirolin . Na przykład redukcja estrów pirolowych i amidów w wyniku brzozy dała piroliny, których regioselektywność zależy od pozycji grupy elektronoakceptorowej. [ potrzebne źródło ]
Reakcje cyklizacji
Pirole z N -podstawieniem mogą ulegać reakcjom cykloaddycji , takim jak [4+2]-, [2+2]- i [2+1]-cyklizacje. Cyklizacje Dielsa-Aldera mogą zachodzić, gdy pirol działa jak dien, zwłaszcza w obecności grupy odciągającej elektrony na azocie. Winylopirole mogą również działać jako dieny. [ potrzebne źródło ]
Pirole mogą reagować z karbenami , takimi jak dichlorokarben , w [2+1]-cykloaddycji. W przypadku dichlorokarbenu powstaje półprodukt dichlorocyklopropanu, który rozkłada się, tworząc 3-chloropirydynę (przegrupowanie Ciamiciana-Dennstedta).
Zastosowania komercyjne
Polipirol ma pewną wartość handlową. N -metylopirol jest prekursorem kwasu N -metylopirolokarboksylowego, budulca w chemii farmaceutycznej. Pirole znajdują się również w kilku lekach, w tym w atorwastatynie , ketorolaku i sunitynibie . Pirole są używane jako światłotrwałe pigmenty czerwone, szkarłatne i karminowe.
Analogi i pochodne
Strukturalne analogi pirolu obejmują:
- Pirolina , częściowo nasycony analog z jednym podwójnym wiązaniem
- Pirolidyna , nasycony uwodorniony analog
Pochodne pirolu obejmują indol , pochodną ze skondensowanym pierścieniem benzenowym .
Zobacz też
Dalsza lektura
- Jones, R. Jones, wyd. (1990). Pirole. Część I. Synteza oraz fizyczne i chemiczne aspekty pierścienia pirolowego . Recueil des Travaux Chimiques des Pays-Bas . Chemia związków heterocyklicznych . Tom. 48. Chichester: John Wiley & Sons. P. 351. doi : 10.1002/recl.19911100712 . ISBN 978-0-471-62753-1 .
- Jolicoeur, Benoit; Chapman, Erin E.; Thompson, Alison; Lubell, William D. (2006). „Ochrona pirolu”. czworościan . 62 (50): 11531–11563. doi : 10.1016/j.tet.2006.08.071 .
Linki zewnętrzne
- Synteza piroli (przegląd najnowszych metod)
- Mechanizmy reakcji substytucji związków heteroaromatycznych zawierających azot










![Piloty–Robinson reaction[22]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/bd/Piloty-Robinson_reaction.png/400px-Piloty-Robinson_reaction.png)