Prosty pierścień aromatyczny
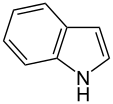
Proste pierścienie aromatyczne , znane również jako proste areny lub proste związki aromatyczne , to aromatyczne związki organiczne , które składają się tylko ze sprzężonego płaskiego układu pierścieni. Wiele prostych pierścieni aromatycznych ma trywialne nazwy. Zwykle występują jako podstruktury bardziej złożonych cząsteczek („ podstawione związki aromatyczne”). Typowe proste związki aromatyczne to benzen , indol i pirydyna .
Proste pierścienie aromatyczne mogą być heterocykliczne , jeśli zawierają pierścieniowe atomy inne niż węgiel , na przykład tlenu , azotu lub siarki . Mogą być monocykliczne jak w benzenie, bicykliczne jak w naftalenie lub policykliczne jak w antracenie . Proste monocykliczne pierścienie aromatyczne to zwykle pierścienie pięcioczłonowe, takie jak pirol lub pierścienie sześcioczłonowe, takie jak pirydyna . Skondensowane/skondensowane pierścienie aromatyczne składają się z pierścieni monocyklicznych, które mają wspólne wiązania łączące.
Heterocykliczne pierścienie aromatyczne
|
|||||||||||||||||||||||||||||||||||||||||||||||||
Pierścienie aromatyczne zawierające azot (N) można rozdzielić na zasadowe pierścienie aromatyczne , które łatwo ulegają protonowaniu i tworzą aromatyczne kationy i sole (np. pirydyniowe ) oraz niezasadowe pierścienie aromatyczne.
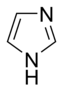
- W podstawowych pierścieniach aromatycznych samotna para elektronów nie jest częścią układu aromatycznego i rozciąga się w płaszczyźnie pierścienia. Ta samotna para odpowiada za zasadowość tych zasad azotowych , podobnie jak atom azotu w aminach . W tych związkach atom azotu nie jest połączony z atomem wodoru. Przykładami zasadowych pierścieni aromatycznych są pirydyna lub chinolina . Kilka pierścieni zawiera zarówno zasadowe, jak i niezasadowe atomy azotu, np. imidazol i puryna .
- W pierścieniach niezasadowych samotna para elektronów atomu azotu jest zdelokalizowana i uczestniczy w aromatycznym układzie pi-elektronów. W tych związkach atom azotu jest połączony z atomem wodoru. Przykładami niezasadowych pierścieni aromatycznych zawierających azot są pirol i indol .
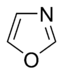
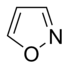
W pierścieniach aromatycznych zawierających tlen i siarkę jedna z par elektronów heteroatomów tworzy układ aromatyczny (podobnie jak pierścienie zawierające niezasadowy azot), podczas gdy druga samotna para rozciąga się w płaszczyźnie pierścienia ( podobne do pierwszorzędowych pierścieni zawierających azot).
Kryteria aromatyczności
- Cząsteczka musi być cykliczna.
- Każdy atom w pierścieniu musi mieć zajęty orbital p , który pokrywa się z orbitalami p po obu stronach (całkowicie sprzężony ).
- Cząsteczka musi być planarna.
- Musi zawierać nieparzystą liczbę par elektronów pi; musi spełniać regułę Hückla : (4n+2) pi elektronów, gdzie n jest liczbą całkowitą zaczynającą się od zera.
Natomiast cząsteczki z elektronami 4n pi są antyaromatyczne .