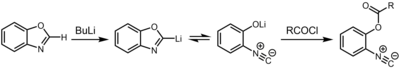izocyjanek
Izocyjanek (zwany także izonitrylem lub karbyloaminą ) jest związkiem organicznym o grupie funkcyjnej – N + ≡C − . Jest to izomer pokrewnego nitrylu (–C≡N), stąd przedrostek to izocyjano . Fragment organiczny jest połączony z grupą izocyjankową przez azotu , a nie przez węgiel . Wykorzystywane są jako budulec do syntezy innych związków.
Nieruchomości
Struktura i wiązanie
Odległość CN w izocyjankach wynosi 115,8 pm w izocyjanku metylu . Kąty CNC są bliskie 180°.
Podobnie jak tlenek węgla , izocyjanki są opisane przez dwie struktury rezonansowe , jedną z potrójnym wiązaniem między azotem a węglem, a drugą z podwójnym wiązaniem między nimi. Samotna para azotu π stabilizuje strukturę i odpowiada za liniowość izocyjanków, chociaż reaktywność izocyjanków odzwierciedla pewien charakter karbenu, przynajmniej w sensie formalnym. Zatem obie struktury rezonansowe są użytecznymi reprezentacjami. Są podatne na polimeryzację .
Spektroskopia
Izocyjanki wykazują silną absorpcję w swoich widmach IR w zakresie 2165–2110 cm -1 .
Symetria elektronowa wokół jądra izocyjanku 14 N powoduje powolną relaksację kwadrupolową, tak że można zaobserwować sprzężenie spinów jądrowych 13 C - 14 N ze stałymi sprzężenia ok. 5 Hz dla jądra izocyjanku 13 C i 5–14 Hz dla jądra 13 C, do którego przyłączona jest grupa izocyjankowa.
Zapach
Ich nieprzyjemny zapach jest legendarny. Cytując Lieke, „ Es besitzt einen penetranten, höchst unangenehmen Geruch; das Oeffnen eines Gefässes mit Cyanallyl reicht hin, die Luft eines Zimmers mehrere Tage lang zu verpesten,…” (Ma przenikliwy, wyjątkowo nieprzyjemny zapach; początek buteleczki [izo]cyjanku allilu wystarczy, aby przez kilka dni zanieczyszczać powietrze w pomieszczeniu). Należy zauważyć, że w czasach Lieke różnica między izocyjankiem a nitrylem nie była w pełni doceniana.
Ivar Karl Ugi stwierdza, że „ Rozwój chemii izocyjanków prawdopodobnie uległ niewielkiemu opóźnieniu z powodu charakterystycznego zapachu lotnych izonitryli, który został opisany przez Hofmanna i Gautiera jako„ wysoce specyficzny, prawie przytłaczający ”,„ okropny ”i„ jest niezwykle niepokojący”. To prawda, że zapach zniechęcił wielu potencjalnych pracowników w tej dziedzinie, ale przeważa fakt, że izonitryle można wykryć nawet w śladowych ilościach oraz że większość dróg prowadzących do powstawania izonitryle odkryto dzięki zapachowi tych związków”. Izocyjanki zostały zbadane jako potencjalna nieśmiercionośna broń .
Niektóre izocyjanki przenoszą mniej nieprzyjemne zapachy, takie jak słód, kauczuk naturalny, kreozot, wiśnia lub stare drewno. Nielotne pochodne, takie jak izocyjanek tosylometylu, nie mają zapachu.
Toksyczność
Podczas gdy niektóre izocyjanki ( np. izocyjanek cykloheksylu) są toksyczne, inne „nie wykazują zauważalnej toksyczności dla ssaków”. Odnosząc się do izocyjanku etylu, badania toksykologiczne przeprowadzone w latach 60. XX wieku w firmie Bayer wykazały, że „myszy mogą tolerować doustne i podskórne dawki 500-5000 mg/kg”.
Synteza
Opracowano wiele dróg prowadzących do izocyjanków.
Z formamidów
Powszechnie izocyjanki są syntetyzowane przez odwodnienie formamidów . Formamid można odwodnić chlorkiem toluenosulfonylu , tlenochlorkiem fosforu , fosgenem , difosgenem lub odczynnikiem Burgessa w obecności zasady, takiej jak pirydyna lub trietyloamina.
- RNHC(O)H + ArSO 2 Cl + 2 C 5 H 5 N → RNC + [C 5 H 5 NH] + [ArSO 3 ] − + [C 5 H 5 NH] + Cl −
Prekursory formamidu są z kolei otrzymywane z amin przez formylowanie kwasem mrówkowym lub bezwodnikiem formyloacetylowym lub w reakcji Rittera alkenów (i innych źródeł karbokationów) i cyjanowodoru.
Z dichlorokarbenu
W reakcji karbyloaminy (znanej również jako synteza izocyjanku Hofmanna) zasada alkaliczna reaguje z chloroformem , tworząc dichlorokarben . Karben przekształca następnie pierwszorzędowe aminy w izocyjaniany. Ilustracją jest synteza tert -butylu z tert -butyloaminy w obecności katalitycznej ilości katalizatora przeniesienia fazowego, chlorku benzylotrietyloamoniowego.
- Me 3 CNH 2 + CHCl 3 + 3 NaOH → Me 3 CNC + 3 NaCl + 3 H 2 O
Ponieważ jest skuteczna tylko w przypadku amin pierwszorzędowych, reakcja ta może być wykorzystana jako test chemiczny na ich obecność.
Szlak cyjanku srebra
Interesujący historycznie, ale niezbyt praktyczny, pierwszy izocyjanek, izocyjanek allilu , otrzymano w reakcji jodku allilu i cyjanku srebra .
- RI + AgCN → RNC + AgI
Inne metody
Inna droga do izocyjanków obejmuje deprotonowanie oksazoli i benzoksazoli w pozycji 2. Powstały związek litoorganiczny istnieje w równowadze chemicznej z 2-izocyjanofenolanem , który może być wychwytywany przez elektrofil , taki jak chlorek kwasowy .
Reakcje
Izocyjanki mają zróżnicowaną reaktywność.
Izocyjanki są stabilne wobec mocnych zasad (często są wytwarzane w silnie zasadowych warunkach), ale są wrażliwe na działanie kwasów. W obecności wodnego kwasu izocyjanki hydrolizują do odpowiednich formamidów :
- RNC + H2O → RC(O) NH2
Ta reakcja służy do niszczenia śmierdzących mieszanin izocyjanków. Niektóre izocyjanki mogą polimeryzować w obecności kwasów Lewisa i Bronsteda.
Izocyjanki biorą udział w wielu wieloskładnikowych reakcjach interesujących syntezę organiczną , z których dwie to: reakcja Ugi i reakcja Passeriniego .
Izocyjanki biorą również udział w reakcjach cykloaddycji , takich jak cykloaddycja [4+1] z tetrazynami. W zależności od stopnia podstawienia izocyjanku reakcja ta przekształca izocyjanki w karbonylki lub daje stabilne cykloaddukty. Przechodzą również insercję w wiązania C – Cl chlorków acylu w reakcji izocyjanku Nef , procesu, który uważa się za uzgodniony i ilustruje ich karbenowy charakter.
Wykazano również, że izocyjaniany są użytecznym odczynnikiem w reakcjach katalizowanych palladem, w których przy użyciu tej metody powstaje wiele różnych związków.
Pozycja α izocyjanków ma znaczną kwasowość. Na przykład izocyjanek benzylu ma ap Ka 27,4 . Dla porównania, cyjanek benzylu ma ap Ka równy 21,9. W fazie gazowej CH3NC jest o kwaśny 1,8 kcal/mol niż CH3CN mniej .
Chlorowanie izocyjanków daje dichlorki izocyjanków .
Ligandy w chemii koordynacyjnej

Izocyjanki tworzą kompleksy koordynacyjne z większością metali przejściowych. Zachowują się jak bogate w elektrony analogi tlenku węgla. Na przykład izocyjanek tert-butylu tworzy Fe 2 (tBuNC) 9 , co jest analogiczne do Fe 2 (CO) 9 . Chociaż strukturalnie podobne, analogiczne karbonylki różnią się na kilka sposobów, głównie dlatego, że t -BuNC jest lepszym ligandem donorowym niż CO. Zatem Fe (tBuNC) 5 łatwo ulega protonowaniu, podczas gdy jego odpowiednik Fe (CO) 5 nie jest.
Naturalnie występujące izocyjanki
Tylko nieliczne naturalnie występujące związki wykazują funkcjonalność izocyjanku. Pierwszy został odkryty w 1957 roku w ekstrakcie z pleśni Penicillium notatum . Związek ksantocyliny był później używany jako antybiotyk . Od tego czasu wyizolowano wiele innych izocyjanków. Większość izocyjanków morskich to terpenoidy, podczas gdy niektóre izocyjanki lądowe pochodzą z α-aminokwasów.
 Xanthocillin jest rzadkim produktem naturalnym , który zawiera grupę izocyjankową (w rzeczywistości dwie).
Xanthocillin jest rzadkim produktem naturalnym , który zawiera grupę izocyjankową (w rzeczywistości dwie).
Nomenklatura
IUPAC używa przedrostka „izocyjano” do systematycznego nazewnictwa izocyjanków: izocyjanometanu , izocyjanoetanu, izocyjanopropanu itp.
Czasami używany stary termin „karbyloamina” jest sprzeczny z systematyczną nomenklaturą. Amina ma zawsze trzy wiązania pojedyncze, podczas gdy izocyjanek ma tylko jedno wiązanie pojedyncze i jedno wiązanie wielokrotne .
Grupa funkcyjna izocyjanamidowa składa się z grupy aminowej przyłączonej do ugrupowania izocyjano. w nomenklaturze stosuje się sufiks izonitrylu lub przedrostek izocyjano w zależności od tabeli priorytetów.
![{\displaystyle \left[{\ce {R}}-{\overset {\oplus }{\ce {N}}}{\ce {#}}{\overset {\ominus }{\ce {C}}}{\ce {:\,<->R-{\ddot {N}}=C{:}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31596ad44ed69b7ad7230333e4059f48ef0d3b65)