N -bromosukcynoimid
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
1-Bromopirolidyno-2,5-dion |
|||
| Inne nazwy
N -bromosukcynoimid; NBS
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 113916 | |||
| CHEBI | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.004.435 | ||
| Numer WE |
|
||
| 26634 | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 4 H 4 Br N O 2 | |||
| Masa cząsteczkowa | 177,985 g · mol -1 | ||
| Wygląd | Białe ciało stałe | ||
| Gęstość | 2,098 g/cm 3 (ciało stałe) | ||
| Temperatura topnienia | 175 do 178 ° C (347 do 352 ° F; 448 do 451 K) | ||
| Temperatura wrzenia | 339 ° C (642 ° F; 612 K) | ||
| 14,7 g/l (25°C) | |||
| Rozpuszczalność w CCl 4 | Nierozpuszczalny (25 °C) | ||
| Zagrożenia | |||
| Bezpieczeństwo i higiena pracy (BHP): | |||
|
Główne zagrożenia
|
Drażniący | ||
| Karta charakterystyki (SDS) | [1] | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
N -bromosukcynoimid lub NBS jest odczynnikiem chemicznym stosowanym w reakcjach podstawienia rodnikowego , addycji elektrofilowej i podstawienia elektrofilowego w chemii organicznej . NBS może być dogodnym źródłem Br • , rodnika bromu .
Przygotowanie
NBS jest dostępny w handlu. Można go również zsyntetyzować w laboratorium. W tym celu do lodowatego wodnego roztworu sukcynoimidu dodaje się wodorotlenek sodu i brom . Produkt NBS wytrąca się i można go odsączyć.
Surowy NBS daje lepszą wydajność w reakcji Wohla-Zieglera . W innych przypadkach zanieczyszczony NBS (lekko żółty kolor) może dawać niewiarygodne wyniki. Można go oczyścić przez rekrystalizację z wody o temperaturze 90 do 95°C (10 g NBS na 100 ml wody).
Reakcje
Dodatek do alkenów
NBS będzie reagował z alkenami 1 w wodnych rozpuszczalnikach dając bromohydryny 2 . Korzystne warunki to dodawanie porcjami NBS do roztworu alkenu w 50% wodnym roztworze DMSO , DME , THF lub tert -butanolu w temperaturze 0°C. Tworzenie jonu bromoniowego i natychmiastowy atak wody daje silną addycję Markownikowa i antystereochemiczną selektywność.
Reakcje uboczne obejmują tworzenie α-bromoketonów i związków dibromowych. Można je zminimalizować, stosując świeżo rekrystalizowany NBS.
Z dodatkiem nukleofili zamiast wody można zsyntetyzować różne dwufunkcyjne alkany.
Bromowanie allilowe i benzylowe
CCl4 Standardowe warunki stosowania NBS w bromowaniu allilowym i/lub benzylowym obejmują ogrzewanie pod chłodnicą zwrotną roztworu NBS w bezwodnym z inicjatorem rodnikowym — zwykle azobisizobutyronitrylem ( AIBN ) lub nadtlenkiem benzoilu , napromieniowaniem lub obydwoma w celu wywołania inicjacji rodnikowej . Pośrednie rodniki allilowe i benzylowe utworzone podczas tej reakcji są bardziej stabilne niż inne rodniki węglowe, a głównymi produktami są bromki allilowe i benzylowe. Nazywa się to również reakcją Wohla-Zieglera .
Czterochlorek węgla musi być utrzymywany w stanie bezwodnym podczas całej reakcji, ponieważ obecność wody może prawdopodobnie zhydrolizować pożądany produkt. Węglan baru jest często dodawany w celu utrzymania warunków bezwodnych i bezkwasowych.
W powyższej reakcji, chociaż możliwa jest mieszanina izomerycznych produktów bromku allilu, powstaje tylko jeden ze względu na większą stabilność rodnika w pozycji 4 w stosunku do rodnika z centrum metylu.
Bromowanie pochodnych karbonylowych
NBS może α-bromować pochodne karbonylowe na drodze rodnikowej (jak powyżej) lub poprzez katalizę kwasową. Na przykład chlorek heksanoilu 1 można bromować w pozycji alfa za pomocą NBS przy użyciu katalizy kwasowej.
Reakcja enolanów , eterów enolowych lub octanów enolu z NBS jest preferowaną metodą α-bromowania, ponieważ jest wysokowydajna i zawiera niewiele produktów ubocznych.
Bromowanie pochodnych aromatycznych
Bogate w elektrony związki aromatyczne , takie jak fenole , aniliny i różne aromatyczne związki heterocykliczne , można bromować za pomocą NBS. Stosowanie DMF jako rozpuszczalnika zapewnia wysoki poziom paraselektywności.
przegrupowanie Hofmanna
NBS, w obecności mocnej zasady, takiej jak DBU , reaguje z pierwszorzędowymi amidami , tworząc karbaminian poprzez przegrupowanie Hofmanna .
Selektywne utlenianie alkoholi
Jest to rzadkie, ale możliwe, że NBS utlenia alkohole. EJ Corey i in. stwierdzili, że można selektywnie utleniać alkohole drugorzędowe w obecności alkoholi pierwszorzędowych przy użyciu NBS w wodnym dimetoksyetanie (DME).
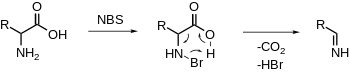
Oksydacyjna dekarboksylacja α-aminokwasów
NBS elektrofilowo bromuje aminę, po czym następuje dekarboksylacja i uwolnienie iminy. Dalsza hydroliza da aldehyd i amoniak. (por. nieutleniająca dekarboksylacja zależna od PLP)
Środki ostrożności
Chociaż NBS jest łatwiejszy i bezpieczniejszy w użyciu niż brom, należy podjąć środki ostrożności, aby uniknąć wdychania. NBS należy przechowywać w lodówce. NBS rozkłada się z czasem wydzielając brom. Czysty NBS jest biały, ale często okazuje się, że jest białawy lub brązowy, zabarwiony bromem.
Ogólnie reakcje z udziałem NBS są egzotermiczne. Dlatego podczas stosowania na dużą skalę należy zachować dodatkowe środki ostrożności.
Zobacz też
Linki zewnętrzne
- Wykorzystanie N -bromosukcynoimidu w syntezie organicznej
- Reakcje z NBS