Migotanie komór
 | |
| Migotanie komór | |
|---|---|
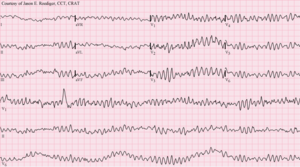
| 12-odprowadzeniowe EKG wykazujące migotanie komór | |
| Specjalność | Kardiologia |
| Objawy | Zatrzymanie krążenia z utratą przytomności i brakiem tętna |
| Powoduje | Choroba niedokrwienna serca (w tym zawał mięśnia sercowego ), wada zastawek serca , kardiomiopatia , zespół Brugadów , porażenie prądem , zespół wydłużonego odstępu QT , krwotok śródczaszkowy |
| Metoda diagnostyczna | Elektrokardiogram |
| Diagnostyka różnicowa | Torsades de pointes |
| Leczenie | Resuscytacja krążeniowo-oddechowa (CPR) z defibrylacją |
| Rokowanie | Wskaźnik przeżycia 17% (poza szpitalem), 46% (w szpitalu) |
| Częstotliwość | ~10% osób z zatrzymaniem krążenia |
Migotanie komór ( V-fib lub VF ) to nieprawidłowy rytm serca , w którym komory serca drżą . Wynika to z niezorganizowanej aktywności elektrycznej . Migotanie komór powoduje zatrzymanie akcji serca z utratą przytomności i brakiem tętna . Po tym następuje nagła śmierć sercowa w przypadku braku leczenia. Migotanie komór występuje początkowo u około 10% osób z zatrzymaniem krążenia.
Migotanie komór może wystąpić z powodu choroby niedokrwiennej serca , wady zastawek serca , kardiomiopatii , zespołu Brugadów , zespołu wydłużonego odstępu QT , porażenia prądem lub krwotoku śródczaszkowego . Diagnozę stawia się na podstawie elektrokardiogramu (EKG) wykazującego nieregularne, nieuformowane zespoły QRS bez wyraźnych załamków P. Ważną diagnostyką różnicową jest torsades de pointes .
Leczenie obejmuje resuscytację krążeniowo-oddechową (CPR) i defibrylację . Defibrylacja dwufazowa może być lepsza niż defibrylacja jednofazowa. Leki epinefryny lub amiodaronu można podać, jeśli początkowe leczenie nie jest skuteczne. Wskaźniki przeżycia wśród osób, które są poza szpitalem, gdy wykryto arytmię, wynoszą około 17%, podczas gdy w szpitalu około 46%.
Symptomy i objawy
Migotanie komór jest przyczyną zatrzymania krążenia . Mięsień komorowy drga losowo, zamiast kurczyć się w sposób skoordynowany (od wierzchołka serca do odpływu z komór), przez co komory nie pompują krwi w organizmie – z tego powodu jest to rytmu zatrzymania krążenia , a pacjentów z migotaniem V należy leczyć resuscytacją krążeniowo-oddechową (CPR) i natychmiastową defibrylacją . Nieleczone migotanie komór szybko prowadzi do śmierci, ponieważ najważniejsze narządy ciała, w tym serce, są pozbawione tlenu, w wyniku czego pacjenci z tym rytmem nie będą przytomni ani nie będą reagowali na bodźce. Przed zatrzymaniem krążenia pacjenci mogą skarżyć się na różne objawy w zależności od przyczyny . Pacjenci mogą wykazywać oznaki oddychania agonalnego , które dla laika może wyglądać na normalne oddychanie spontaniczne, ale jest oznaką hipoperfuzji pnia mózgu . [ potrzebne źródło ]
elektrokardiografii ma wygląd nieregularnej aktywności elektrycznej bez dostrzegalnego wzorca. Można go opisać jako „gruby” lub „drobny” w zależności od jego amplitudy lub jako postępujący od grubego do drobnego V-fib. Grube migotanie V może lepiej reagować na defibrylację, podczas gdy delikatne migotanie V może naśladować pojawienie się asystolii na defibrylatorze lub kardiomonitorze ustawionym na niskie wzmocnienie . Niektórzy klinicyści mogą podejmować próby defibrylacji drobnego migotania V w nadziei, że uda się przywrócić rytm serca zgodne z życiem, podczas gdy inne będą prowadzić resuscytację krążeniowo-oddechową , a czasami leki , jak opisano w protokołach zaawansowanych zabiegów resuscytacyjnych, próbując zwiększyć jej amplitudę i szanse na pomyślną defibrylację. [ potrzebne źródło ]
Powoduje
Migotanie komór zostało opisane jako „chaotyczna asynchroniczna frakcjonowana aktywność serca” (Moe i wsp. 1964). Bardziej kompletna definicja mówi, że migotanie komór jest „burzliwą, zdezorganizowaną aktywnością elektryczną serca w taki sposób, że zarejestrowane odchylenia elektrokardiograficzne stale zmieniają kształt, wielkość i kierunek”.
Migotanie komór występuje najczęściej w obrębie chorych serc iw ogromnej większości przypadków jest przejawem choroby niedokrwiennej serca. Migotanie komór obserwuje się również u osób z kardiomiopatią , zapaleniem mięśnia sercowego i innymi patologiami serca. Ponadto obserwuje się go przy zaburzeniach równowagi elektrolitowej , przedawkowaniu leków kardiotoksycznych oraz po utonięciu lub poważnym urazie . Warto również zauważyć, że migotanie komór występuje tam, gdzie nie ma zauważalnej patologii serca lub innej ewidentnej przyczyny, tak zwanego idiopatycznego migotania komór. [ potrzebne źródło ]
Idiopatyczne migotanie komór występuje z rzekomą częstością około 1% wszystkich przypadków zatrzymania krążenia poza szpitalem, a także 3–9% przypadków migotania komór niezwiązanych z zawałem mięśnia sercowego i 14% wszystkich resuscytacji z powodu migotania komór w pacjentów w wieku poniżej 40 lat. Wynika z tego, że z faktu, że samo migotanie komór jest powszechne, samoistne migotanie komór odpowiada za znaczną śmiertelność. Ostatnio opisane zespoły, takie jak zespół Brugadów może dać wskazówki dotyczące mechanizmu leżącego u podstaw komorowych zaburzeń rytmu. W zespole Brugadów można stwierdzić zmiany w spoczynkowym EKG z objawami bloku prawej odnogi pęczka Hisa (RBBB) i uniesieniem odcinka ST w odprowadzeniach V1-V3 klatki piersiowej, z podstawową skłonnością do nagłej śmierci sercowej.
Istotne jest to, że teorie leżące u podstaw patofizjologii i elektrofizjologii muszą uwzględniać występowanie migotania w pozornie „zdrowym” sercu. Jest oczywiste, że działają mechanizmy, których nie do końca doceniamy i rozumiemy. Badacze badają nowe techniki wykrywania i zrozumienia mechanizmów leżących u podstaw nagłej śmierci sercowej u tych pacjentów bez patologicznych dowodów choroby serca.
Warunki rodzinne, które predysponują jednostki do rozwoju migotania komór i nagłej śmierci sercowej, są często wynikiem mutacji genów, które wpływają na komórkowe transbłonowe kanały jonowe. Na przykład w zespole Brugadów zaburzone są kanały sodowe. W niektórych postaciach zespołu wydłużonego odstępu QT wpływa to na wewnętrzny kanał prostownika potasowego. [ potrzebne źródło ]
W 1899 roku stwierdzono również, że migotanie komór było zazwyczaj ostateczną przyczyną śmierci, gdy używano krzesła elektrycznego .
Patofizjologia
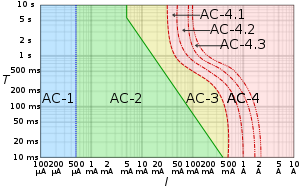
Wykres log-log wpływu prądu przemiennego I o czasie trwania T przechodzącego z lewej ręki na stopy, jak określono w publikacji IEC 60479–1. AC-1: niedostrzegalny AC-2: wyczuwalny, ale brak reakcji mięśniowej AC-3: skurcz mięśni z odwracalnymi skutkami AC-4: możliwe nieodwracalne skutki AC-4.1: do 5% prawdopodobieństwo migotania komór AC-4.2: 5-50% prawdopodobieństwo migotania AC-4.3: ponad 50% prawdopodobieństwo migotania
Nienormalna automatyczność
Automatyczność jest miarą skłonności włókna do spontanicznego zainicjowania impulsu. Produktem niedotlenionego mięśnia sercowego mogą być nadpobudliwe komórki mięśnia sercowego. Mogą one następnie działać jako rozruszniki serca. Komory są wówczas stymulowane przez więcej niż jeden stymulator . Blizna i obumierająca tkanka są niewzbudzone, ale wokół tych obszarów zwykle znajduje się półcień niedotlenionej tkanki, która jest pobudliwa. Pobudliwość komorowa może generować nawrotowe zaburzenia rytmu komorowego . [ potrzebne źródło ]
Większość komórek mięśnia sercowego z towarzyszącą zwiększoną skłonnością do rozwoju arytmii wiąże się z utratą potencjału błonowego . Oznacza to, że maksymalny potencjał rozkurczowy jest mniej ujemny i dlatego istnieje bliżej potencjału progowego . Depolaryzacja komórkowa może być spowodowana podwyższonym zewnętrznym stężeniem potasu K + , zmniejszonym wewnątrzkomórkowym stężeniem jonów sodu Na + , zwiększoną przepuszczalnością dla Na + lub zmniejszoną przepuszczalnością dla K + . Podstawowy automat jonowy to zysk netto dodatniego ładunku wewnątrzkomórkowego podczas rozkurczu w obecności zależnego od napięcia kanału aktywowanego przez potencjały ujemne do –50 do –60 mV. [ potrzebne źródło ]
Komórki mięśnia sercowego są narażone na różne środowiska. Normalne komórki mogą być narażone na hiperkaliemię; nieprawidłowe komórki mogą być perfundowane przez normalne środowisko. Na przykład, przy wyleczonym zawale mięśnia sercowego, nieprawidłowe komórki mogą być wystawione na działanie nieprawidłowego środowiska, takiego jak zawał mięśnia sercowego z niedokrwieniem mięśnia sercowego. W stanach takich jak niedokrwienie mięśnia sercowego możliwy mechanizm generowania arytmii obejmuje wynikające z tego zmniejszenie wewnętrznego stężenia K + , zwiększenie zewnętrznego stężenia K + stężenie, uwalnianie noradrenaliny i kwasica. Kiedy komórka mięśnia sercowego jest narażona na hiperkaliemię, maksymalny potencjał rozkurczowy ulega depolaryzacji w wyniku zmiany prądu potasowego Ik1, którego intensywność i kierunek są ściśle zależne od wewnątrz- i zewnątrzkomórkowych stężeń potasu. Przy stłumieniu Ik1 efekt hiperpolaryzacji zostaje utracony, a zatem może dojść do aktywacji prądu śmiesznego nawet w komórkach mięśnia sercowego (który normalnie jest tłumiony przez hiperpolaryzujący efekt współistniejących prądów potasowych). Może to prowadzić do instauracji automatyzmu w niedokrwionej tkance. [ potrzebne źródło ]
Ponowne wejście
Rola ruchu powrotnego lub ruchu cyrkowego została osobno zademonstrowana przez GR Mines i WE Garrey . Miny stworzyły pierścień tkanki pobudliwej, wycinając przedsionki płaszczki . Garrey wyciął podobny pierścień z żółwia . Obaj byli w stanie wykazać, że jeśli pierścień pobudliwej tkanki zostanie pobudzony w jednym punkcie, kolejne fale depolaryzacji przejdą wokół pierścienia. Fale ostatecznie spotykają się i znoszą, ale jeśli wystąpiłby obszar przejściowej blokady z okresem refrakcji , który zablokował jedno czoło fali, a następnie pozwolił drugiemu przejść wstecz po drugiej ścieżce, wówczas nastąpiłoby samopodtrzymujące się zjawisko ruchu cyrkowego . Aby tak się stało, konieczne jest jednak, aby istniała jakaś forma niejednorodności. W praktyce może to być obszar tzw niedokrwienny lub zawał mięśnia sercowego lub leżąca pod nim blizna . [ potrzebne źródło ]
Nadchodzącą falę depolaryzacji można sobie wyobrazić jako dipol z głową i ogonem. Długość okresu refrakcji i czas potrzebny dipolowi na pokonanie określonej odległości - prędkość propagacji - zadecyduje, czy taka okoliczność zajdzie, aby nastąpiło ponowne wejście. Czynniki sprzyjające ponownemu wejściu obejmowałyby powolną prędkość propagacji, krótki okres refrakcji z wystarczającym rozmiarem pierścienia tkanki przewodzącej. Umożliwiłoby to dipolowi dotarcie do obszaru, który był ogniotrwały, a teraz można go zdepolaryzować wraz z kontynuacją czoła fali . [ potrzebne źródło ]
Zatem w praktyce klinicznej czynniki, które prowadziłyby do odpowiednich warunków sprzyjających takim mechanizmom ponownego wejścia, obejmują zwiększenie rozmiaru serca poprzez przerost lub rozszerzenie, leki zmieniające długość okresu refrakcji i obszary choroby serca. Dlatego podłożem migotania komór jest przemijający lub trwały blok przewodzenia. Blokada z powodu obszarów uszkodzonej lub opornej tkanki prowadzi do obszarów mięśnia sercowego do inicjacji i utrwalenia migotania poprzez zjawisko ponownego wejścia. [ potrzebne źródło ]
Aktywność wyzwalana
Wyzwalana aktywność może wystąpić z powodu obecności późniejszych depolaryzacji . Są to depolaryzujące oscylacje napięcia membranowego indukowane przez poprzedzające je potencjały czynnościowe. Mogą one wystąpić przed lub po pełnej repolaryzacji włókna i jako takie są określane jako wczesne (EAD) lub opóźnione następcze depolaryzacje (DAD). Wszystkie następcze depolaryzacje mogą nie osiągnąć potencjału progowego, ale jeśli tak się stanie, mogą wywołać kolejną następczą depolaryzację, a tym samym utrwalić się. [ potrzebne źródło ]
Widmo mocy
Rozkład częstotliwości i mocy przebiegu można wyrazić jako widmo mocy, w którym mierzony jest udział różnych częstotliwości przebiegu w analizowanym przebiegu. Można to wyrazić jako częstotliwość dominującą lub szczytową, tj. częstotliwość o największej mocy lub częstotliwość środkową, która dzieli widmo na dwie połowy. [ potrzebne źródło ]
Analiza częstotliwościowa ma wiele innych zastosowań w medycynie i kardiologii, w tym w analizie zmienności rytmu serca i ocenie funkcji serca, a także w obrazowaniu i akustyce.
Histopatologia

Rozpad włókien mięśniowych, w skrócie MFB, jest związany z migotaniem komór prowadzącym do śmierci. Histomorfologicznie MFB charakteryzuje się złamaniami włókien mięśniowych serca prostopadle do ich długiej osi, z kwadraturą jąder włókien mięśniowych . [ potrzebne źródło ]
Leczenie
Defibrylacja jest ostatecznym leczeniem migotania komór, polegającym na doprowadzaniu prądu elektrycznego do masy komorowej bezpośrednio lub z zewnątrz za pomocą elektrod lub łyżek w celu depolaryzacji mięśnia sercowego w stopniu wystarczającym do ponownego wystąpienia skoordynowanych skurczów. Stosowanie tego jest często podyktowane na całym świecie Advanced Cardiac Life Support lub Advanced Life Support , których uczy się lekarzy, w tym lekarzy, pielęgniarki i ratowników medycznych, a także zaleca się stosowanie leków, głównie epinefryny , po co drugiej nieudanej próbie defibrylacji, a także resuscytacji krążeniowo-oddechowej (RKO) pomiędzy próbami defibrylacji. Chociaż algorytmy ALS/ACLS zachęcają do stosowania leków, to przede wszystkim stwierdzają, że defibrylacji nie należy opóźniać do żadnej innej interwencji oraz że należy prowadzić odpowiednią resuscytację krążeniowo-oddechową z minimalnymi przerwami. [ potrzebne źródło ]
Uderzenie przedsercowe jest manewrem promowanym jako mechaniczna alternatywa dla defibrylacji. Niektóre zaawansowane algorytmy podtrzymujące życie zalecają jego użycie raz i tylko w przypadku obserwowanego i monitorowanego zatrzymania migotania przedsionków, ponieważ prawdopodobieństwo pomyślnego wykonania kardiowersji u pacjenta jest niewielkie i szybko maleje w pierwszej minucie wystąpienia. [ potrzebne źródło ]
Osoby, które przeżyją „zatrzymanie migotania przedsionków” i dobrze wyzdrowieją, są często brane pod uwagę przy wszczepianiu kardiowertera-defibrylatora , który może szybko wykonać tę samą ratującą życie defibrylację w przypadku wystąpienia kolejnego epizodu migotania komór poza środowiskiem szpitalnym. [ potrzebne źródło ]
Epidemiologia
Nagłe zatrzymanie krążenia jest główną przyczyną śmierci w uprzemysłowionym świecie. Powoduje znaczną śmiertelność z około 70 000 do 90 000 nagłych zgonów sercowych każdego roku w Wielkiej Brytanii, a wskaźniki przeżywalności wynoszą tylko 2%. Większość tych zgonów jest spowodowana migotaniem komór wtórnym do zawału mięśnia sercowego lub „atakiem serca”. Podczas migotania komór pojemność minutowa serca spada do zera i jeśli nie zostanie szybko podjęta pomoc, śmierć zwykle następuje w ciągu kilku minut. [ potrzebne źródło ]
Historia
Lyman Brewer sugeruje, że pierwsze zapisane wzmianki o migotaniu komór pochodzą już z 1500 roku pne i można je znaleźć w papirusie Ebersa ze starożytnego Egiptu . Wyciąg, nagrany 3500 lat temu, stwierdza: „Gdy serce jest chore, jego praca nie jest wykonywana perfekcyjnie: naczynia wychodzące z serca stają się nieaktywne, tak że nie można ich wyczuć… jeśli serce drży, ma małą moc i tonie, choroba jest zaawansowana, a śmierć jest blisko”. Książka autorstwa Jo Miles sugeruje, że może sięgać nawet dalej. Testy przeprowadzone na zamrożonych szczątkach znalezionych w Himalajach wydawały się dość rozstrzygające, że pierwszy znany przypadek migotania komór datuje się na co najmniej 2500 pne.
Dyskusyjne jest, czy jest to opis migotania komór. Następny zarejestrowany opis pojawia się 3000 lat później i został zarejestrowany przez Vesaliusa , który opisał pojawienie się „robaczych” ruchów serca u zwierząt przed śmiercią. [ potrzebne źródło ]
Znaczenie i znaczenie kliniczne tych obserwacji i opisów prawdopodobnie migotania komór nie zostało rozpoznane, dopóki John Erichsen w 1842 nie opisał migotania komór po podwiązaniu tętnicy wieńcowej ( Erichsen JE 1842). Następnie w 1850 r. Ludwig i Hoffa opisali migotanie komór, kiedy zademonstrowali prowokację migotania komór u zwierzęcia przez zastosowanie prądu „ faradowego ” (elektrycznego) do serca.
W 1874 roku Edmé Félix Alfred Vulpian ukuł termin migotanie komór i przedsionków. John A. MacWilliam, fizjolog, który kształcił się pod kierunkiem Ludwiga, a następnie został profesorem fizjologii na Uniwersytecie w Aberdeen , podał dokładny opis arytmii w 1887 roku. Definicja ta obowiązuje do dziś i jest interesujący fakt, że jego badania i opis poprzedzają użycie elektrokardiografii . Jego opis jest następujący: „Mięsień komorowy zostaje wprowadzony w stan nieregularnego, arytmicznego skurczu, podczas gdy ciśnienie krwi w tętnicach gwałtownie spada, komory rozszerzają się krwią, ponieważ szybki drżący ruch ich ścian jest niewystarczający do wypchnięcia ich zawartość; działanie mięśni ma charakter szybkich, nieskoordynowanych skurczów tkanki mięśniowej… Pompa serca zostaje wyrzucona z biegu, a ostatnia jej energia życiowa jest rozpraszana w gwałtownym i długotrwałym zamieszaniu bezowocnej aktywności w ściany komór”. MacWilliam spędził wiele lat pracując nad migotaniem komór i jako jeden z pierwszych wykazał, że migotanie komór można przerwać serią wyładowań indukcyjnych w sercu.
Pierwszego zapisu elektrokardiogramu migotania komór dokonał August Hoffman w artykule opublikowanym w 1912 r. W tym czasie dwóch innych badaczy, George Ralph Mines i Garrey, pracując osobno, stworzyło pracę demonstrującą zjawisko ruchu cyrkowego i ponownego wejścia jako możliwe substraty do powstawania arytmii. Tej pracy towarzyszył także Lewis, który wykonał dalsze wybitne prace nad koncepcją „ruchu cyrkowego”. [ potrzebne źródło ]
Późniejsze kamienie milowe obejmują pracę WJ Kerra i WL Bendera z 1922 roku, którzy stworzyli elektrokardiogram przedstawiający częstoskurcz komorowy przechodzący w migotanie komór. Mechanizm ponownego wejścia był również zalecany przez DeBoera, który wykazał, że migotanie komór można wywołać w późnym skurczu za pomocą pojedynczego wstrząsu serca żaby. Koncepcję „R on T ectopics” rozwinął dalej Katz w 1928 r. Wiggers i Wegria nazwali to „okresem wrażliwości” w 1940 r., Którzy zwrócili uwagę na koncepcję niebezpieczeństwa przedwczesnych uderzeń komorowych występujących na T fala . [ potrzebne źródło ]
Inną definicję migotania komór przedstawił Wiggers w 1940 r. Opisał migotanie komór jako „nieskoordynowany typ skurczu, który pomimo wysokiego tempa metabolizmu mięśnia sercowego nie wytwarza użytecznych uderzeń. W rezultacie ciśnienie tętnicze gwałtownie spada do bardzo niskiego poziomu. poziomy, a śmierć następuje w ciągu sześciu do ośmiu minut od niedokrwistości [niedokrwienia] mózgu i rdzenia kręgowego ”.
Spontaniczna konwersja migotania komór do łagodniejszego rytmu jest rzadka u wszystkich zwierząt z wyjątkiem małych. [ potrzebne źródło ] Defibrylacja to proces, który przekształca migotanie komór w łagodniejszy rytm. Zwykle odbywa się to poprzez zastosowanie elektrowstrząsu mięśnia sercowego i jest szczegółowo omówione w odpowiednim artykule.
Zobacz też
Linki zewnętrzne
- Interaktywne modele i informacje o migotaniu komór i innych arytmiach
