Komórka macierzysta
| Komórka macierzysta | |
|---|---|

Transmisyjna mikrografia elektronowa mezenchymalnej komórki macierzystej wykazującej typowe cechy ultrastrukturalne
| |
| Szczegóły | |
| Identyfikatory | |
| łacina | Cellula praecursoria |
| Siatka | D013234 |
| TH | H1.00.01.0.00028, H2.00.01.0.00001 |
| FMA | 63368 |
| Terminologia anatomiczna | |
W organizmach wielokomórkowych komórki macierzyste są komórkami niezróżnicowanymi lub częściowo zróżnicowanymi , które mogą różnicować się w różne typy komórek i proliferować w nieskończoność, aby wytworzyć więcej tej samej komórki macierzystej. Są najwcześniejszym typem komórek w linii komórkowej . Występują zarówno w embrionalnych , jak i dorosłych, ale w każdym z nich mają nieco inne właściwości. Zwykle odróżnia się je od komórek progenitorowych , które nie mogą dzielić się w nieskończoność i prekursorowe lub blastyczne, które zwykle są zaangażowane w różnicowanie się w jeden typ komórek.
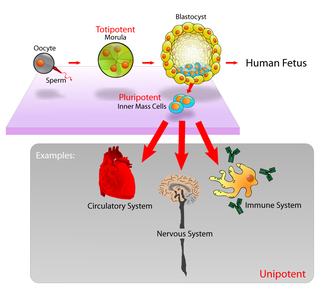
U ssaków około 50–150 komórek tworzy wewnętrzną masę komórkową podczas stadium rozwoju embrionalnego blastocysty , około 5–14 dni. Mają zdolność komórek macierzystych. In vivo ostatecznie różnicują się we wszystkie typy komórek organizmu (co czyni je pluripotencjalnymi ). Proces ten rozpoczyna się od różnicowania na trzy listki zarodkowe – ektodermę , mezodermę i endodermę – w gastrulacji scena. Jednakże, gdy są izolowane i hodowane in vitro , mogą być trzymane w stadium komórek macierzystych i są znane jako embrionalne komórki macierzyste (ESC).
Dorosłe komórki macierzyste znajdują się w kilku wybranych miejscach ciała, zwanych niszami , na przykład w szpiku kostnym lub gonadach . Istnieją, aby uzupełniać szybko utracone typy komórek i są multipotentne lub unipotentne, co oznacza, że różnicują się tylko w kilka typów komórek lub jeden typ komórek. U ssaków są to m.in. hematopoetyczne komórki macierzyste , które uzupełniają krew i komórki odpornościowe, komórki podstawne , które utrzymują nabłonek skóry , oraz mezenchymalne komórki macierzyste , które utrzymują kości, chrząstki , mięśnie i komórki tłuszczowe. Dorosłe komórki macierzyste stanowią niewielką mniejszość komórek; są znacznie liczniejsze niż komórki progenitorowe i komórki ostatecznie zróżnicowane, w które się różnicują.
Badania nad komórkami macierzystymi wyrosły z odkryć kanadyjskich biologów Ernesta McCullocha , Jamesa Tilla i Andrew J. Beckera z University of Toronto i Ontario Cancer Institute w latach 60. XX wieku. Od 2016 roku jedyną ustaloną terapią medyczną z wykorzystaniem komórek macierzystych jest przeszczep hematopoetycznych komórek macierzystych , po raz pierwszy przeprowadzony w 1958 roku przez francuskiego onkologa Georgesa Mathé . Jednak od 1998 roku możliwe jest hodowanie i różnicowanie ludzkich embrionalnych komórek macierzystych (w liniach komórek macierzystych). ). Proces izolowania tych komórek był kontrowersyjny , ponieważ zwykle prowadzi do zniszczenia zarodka. Źródła izolowania ESC zostały ograniczone w niektórych krajach europejskich i Kanadzie, ale inne, takie jak Wielka Brytania i Chiny, promowały badania. Transfer jądra komórki somatycznej to metoda klonowania , którą można wykorzystać do stworzenia sklonowanego zarodka w celu wykorzystania jego embrionalnych komórek macierzystych w terapii komórkami macierzystymi. W 2006 roku japoński zespół kierowany przez Shinya Yamanaka odkrył metodę przekształcania dojrzałych komórek ciała z powrotem w komórki macierzyste. Nazwano je indukowanymi pluripotencjalnymi komórkami macierzystymi (iPSC).
Historia
Termin komórka macierzysta został ukuty przez Theodora Boveriego i Valentina Haeckera pod koniec XIX wieku. Pionierskie prace w teorii komórek macierzystych krwi prowadzili na początku XX wieku Artur Pappenheim , Alexander Maximow , Franz Ernst Christian Neumann .
Kluczowe właściwości komórki macierzystej zostały po raz pierwszy zdefiniowane przez Ernesta McCullocha i Jamesa Tilla na Uniwersytecie w Toronto iw Ontario Cancer Institute na początku lat 60. Odkryli krwiotwórczą komórkę macierzystą, hematopoetyczną komórkę macierzystą (HSC), poprzez swoją pionierską pracę na myszach. McCulloch i Till rozpoczęli serię eksperymentów, w których komórki szpiku kostnego wstrzykiwano napromieniowanym myszom. Zaobserwowali grudki w śledzionach myszy, które były liniowo proporcjonalne do liczby wstrzykniętych komórek szpiku kostnego. Postawili hipotezę, że każda bryła (kolonia) była klonem powstałym z pojedynczej komórki szpiku (komórki macierzystej). W kolejnej pracy McCulloch i Till, dołączyli do nich doktorant Andrew John Becker i starszy naukowiec Louis Siminovitch potwierdził, że każda bryła rzeczywiście powstała z pojedynczej komórki. Ich wyniki zostały opublikowane w Nature w 1963 roku. W tym samym roku Siminovitch był głównym badaczem w badaniach, które wykazały, że komórki tworzące kolonie są zdolne do samoodnawiania, co jest kluczową właściwością definiującą komórki macierzyste, o której teoretyzowali Till i McCulloch.
Pierwszą terapią z wykorzystaniem komórek macierzystych był przeszczep szpiku kostnego przeprowadzony przez francuskiego onkologa Georgesa Mathé w 1958 roku u pięciu pracowników Instytutu Jądrowego Vinča w Jugosławii , którzy ucierpieli w krytycznym wypadku . Wszyscy robotnicy przeżyli.
Martin Evans i Matthew Kaufman po raz pierwszy wyizolowali embrionalne komórki macierzyste (ES) i pomyślnie je wyhodowali przy użyciu mysich blastocyst . Pozwoliło to na utworzenie mysich modeli genetycznych, systemu, w którym geny myszy są usuwane lub zmieniane w celu zbadania ich funkcji w patologii. Do 1998 roku embrionalne komórki macierzyste zostały po raz pierwszy wyizolowane przez amerykańskiego biologa Jamesa Thomsona , co umożliwiło opracowanie nowych metod transplantacji lub różnych typów komórek do testowania nowych metod leczenia. W 2006 roku Shinya Yamanaka w Kioto w Japonii przekształcił fibroblasty w pluripotencjalne komórki macierzyste, modyfikując ekspresję tylko czterech genów. Wyczyn reprezentuje pochodzenie indukowanych pluripotencjalnych komórek macierzystych, znanych jako komórki iPS.
W 2011 r. samica wilka grzywiastego przejechana przez ciężarówkę została poddana leczeniu komórkami macierzystymi w Zoo Brasília, co było pierwszym odnotowanym przypadkiem zastosowania komórek macierzystych do leczenia ran u dzikiego zwierzęcia.
Nieruchomości
Klasyczna definicja komórki macierzystej wymaga, aby posiadała ona dwie właściwości:
- Samoodnawianie: zdolność do przechodzenia przez liczne cykle wzrostu i podziału komórek , znane jako proliferacja komórek , przy zachowaniu stanu niezróżnicowania.
- Potencja : zdolność do różnicowania się w wyspecjalizowane typy komórek. W ścisłym tego słowa znaczeniu wymaga to, aby komórki macierzyste były albo totipotencjalne , albo pluripotencjalne — aby mogły dać początek dowolnemu dojrzałemu typowi komórek, chociaż multipotentne lub unipotentne komórki progenitorowe są czasami określane jako komórki macierzyste. Poza tym mówi się, że funkcja komórek macierzystych jest regulowana w mechanizmie sprzężenia zwrotnego.
Samoodnawianie
Dwa mechanizmy zapewniają utrzymanie populacji komórek macierzystych (nie zmniejszają się):
1. Asymetryczny podział komórek : komórka macierzysta dzieli się na jedną komórkę macierzystą, która jest identyczna z pierwotną komórką macierzystą, i drugą komórkę potomną, która jest zróżnicowana.
Kiedy komórka macierzysta odnawia się samoistnie, dzieli się i nie zakłóca stanu niezróżnicowania. Ta samoodnowa wymaga kontroli cyklu komórkowego, jak również utrzymania multipotencji lub pluripotencji, które wszystko zależy od komórki macierzystej.
2. Różnicowanie stochastyczne: kiedy jedna komórka macierzysta rośnie i dzieli się na dwie zróżnicowane komórki potomne, inna komórka macierzysta przechodzi mitozę i wytwarza dwie komórki macierzyste identyczne z oryginałem.
Komórki macierzyste wykorzystują telomerazę , białko, które odtwarza telomery , aby chronić swoje DNA i wydłużyć limit podziałów komórkowych ( limit Hayflicka ).
Znaczenie siły

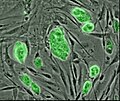
Ludzkie embrionalne komórki macierzyste A: Kolonie komórek macierzystych, które nie są jeszcze zróżnicowane. B: Komórki nerwowe , przykład typu komórki po zróżnicowaniu.
Siła działania określa potencjał różnicowania (potencjał do różnicowania się w różne typy komórek) komórki macierzystej.
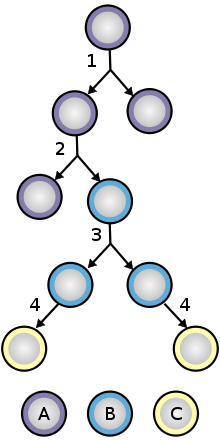
- Totipotencjalne (znane również jako wszechpotężne) komórki macierzyste mogą różnicować się w typy komórek embrionalnych i pozazarodkowych. Takie komórki mogą zbudować kompletny, zdolny do życia organizm. Komórki te powstają z połączenia komórki jajowej i plemnika. Komórki wytworzone przez kilka pierwszych podziałów zapłodnionego jaja są również totipotencjalne.
- Pluripotencjalne komórki macierzyste są potomkami komórek totipotencjalnych i mogą różnicować się w prawie wszystkie komórki, tj. komórki pochodzące z dowolnego z trzech listków zarodkowych .
- Multipotentne komórki macierzyste mogą różnicować się w wiele rodzajów komórek, ale tylko te z blisko spokrewnionej rodziny komórek.
- Oligopotencjalne komórki macierzyste mogą różnicować się tylko w kilka typów komórek, takich jak limfoidalne lub szpikowe komórki macierzyste.
- unipotentne mogą wytwarzać tylko jeden typ komórek, własny, ale mają właściwość samoodnawiania, co odróżnia je od komórek innych niż macierzyste
Identyfikacja
W praktyce komórki macierzyste identyfikuje się po tym, czy potrafią regenerować tkankę. Na przykład testem definiującym szpik kostny lub hematopoetyczne komórki macierzyste (HSC) jest zdolność do przeszczepu komórek i uratowania osobnika bez HSC. Pokazuje to, że komórki mogą wytwarzać nowe krwinki przez długi czas. Powinno być również możliwe wyizolowanie komórek macierzystych od przeszczepionej osoby, które same mogą zostać przeszczepione innemu osobnikowi bez HSC, co dowodzi, że komórka macierzysta była zdolna do samoodnawiania.
Właściwości komórek macierzystych można zilustrować in vitro , stosując takie metody, jak testy klonogenne , w których ocenia się pojedyncze komórki pod kątem ich zdolności do różnicowania i samoodnawiania. Komórki macierzyste można również izolować dzięki posiadaniu charakterystycznego zestawu markerów powierzchniowych komórek. Jednak in vitro mogą zmienić zachowanie komórek, przez co nie jest jasne, czy komórki będą zachowywać się w podobny sposób in vivo . Toczy się poważna debata na temat tego, czy niektóre proponowane populacje dorosłych komórek są naprawdę komórkami macierzystymi.
Embrionalny
Embrionalne komórki macierzyste (ESC) to komórki wewnętrznej masy komórkowej blastocysty , utworzone przed zagnieżdżeniem się w macicy. W rozwoju embrionalnym człowieka stadium blastocysty osiągane jest 4–5 dni po zapłodnieniu iw tym czasie składa się z 50–150 komórek. ESC są pluripotencjalne i w trakcie rozwoju dają początek wszystkim pochodnym trzech listków zarodkowych : ektodermy , endodermy i mezodermy . Innymi słowy, mogą rozwinąć się w każdy z ponad 200 rodzajów komórek dorosłego organizmu, jeśli otrzymają wystarczającą i niezbędną stymulację dla określonego typu komórek. Nie biorą udziału w błonach pozazarodkowych ani w łożysku .
Podczas rozwoju embrionalnego komórki wewnętrznej masy komórkowej nieustannie dzielą się i stają się bardziej wyspecjalizowane. Na przykład część ektodermy w grzbietowej części zarodka specjalizuje się jako „ neurektoderma ”, która stanie się przyszłym ośrodkowym układem nerwowym . Później w rozwoju neurulacja powoduje, że neurektoderma tworzy cewę nerwową . Na etapie cewy nerwowej przednia część ulega encefalizacji wygenerować lub „wzorować” podstawową formę mózgu. Na tym etapie rozwoju za główny typ komórek OUN uważa się nerwową komórkę macierzystą .
Nerwowe komórki macierzyste samoodnawiają się iw pewnym momencie przechodzą w komórki progenitorowe gleju radialnego (RGP). Wcześnie utworzone RGP samoodnawiają się przez symetryczny podział, tworząc rezerwuarową grupę komórek progenitorowych . Komórki te przechodzą w neurogenny i zaczynają dzielić się asymetrycznie , tworząc dużą różnorodność wielu różnych typów neuronów, z których każdy ma unikalną ekspresję genów, cechy morfologiczne i funkcjonalne. Proces generowania neuronów z radialnych komórek glejowych nazywa się neurogenezą . Komórka glejowa promieniowa ma charakterystyczną morfologię dwubiegunową z silnie wydłużonymi wyrostkami rozciągającymi się na grubość ściany cewy nerwowej. Ma pewne wspólne glejowe , w szczególności ekspresję glejowego fibrylarnego kwaśnego białka (GFAP). Komórka glejowa promieniowa jest podstawową nerwową komórką macierzystą rozwijającego się kręgowców , a jej ciało komórkowe znajduje się w strefie komorowej , w sąsiedztwie rozwijającego się układu komorowego . Nerwowe komórki macierzyste są zaangażowane w linie neuronalne ( neurony , astrocyty i oligodendrocyty ), a tym samym ich siła działania jest ograniczona.
Niemal we wszystkich dotychczasowych badaniach wykorzystywano embrionalne komórki macierzyste myszy (mES) lub ludzkie embrionalne komórki macierzyste (hES) pochodzące z wczesnej masy komórek wewnętrznych. Oba mają podstawowe cechy komórek macierzystych, ale wymagają bardzo różnych środowisk, aby utrzymać niezróżnicowany stan. Komórki ES myszy hoduje się na warstwie żelatyny jako macierzy pozakomórkowej (dla wsparcia) i wymaga obecności czynnika hamującego białaczkę (LIF) w pożywce z surowicą. Koktajl leków zawierający inhibitory GSK3B i MAPK/ERK , zwany 2i, wykazano również, że utrzymuje pluripotencję w hodowli komórek macierzystych. Ludzkie ESC są hodowane na warstwie odżywczej fibroblastów embrionalnych myszy i wymagają obecności podstawowego czynnika wzrostu fibroblastów (bFGF lub FGF-2). Bez optymalnych warunków hodowli lub manipulacji genetycznych embrionalne komórki macierzyste będą się szybko różnicować.
Ludzka embrionalna komórka macierzysta jest również definiowana przez ekspresję kilku czynników transkrypcyjnych i białek powierzchniowych komórki. Czynniki transkrypcyjne Oct-4 , Nanog i Sox2 tworzą podstawową sieć regulacyjną, która zapewnia tłumienie genów prowadzących do różnicowania i utrzymania pluripotencji. Antygeny powierzchniowe komórek najczęściej stosowane do identyfikacji komórek hES to glikolipidy specyficzne dla stadium embrionalnego antygenu 3 i 4 oraz antygeny siarczanu keratanu Tra-1-60 i Tra-1-81. Molekularna definicja komórki macierzystej obejmuje znacznie więcej białek i nadal jest przedmiotem badań.
Używając ludzkich embrionalnych komórek macierzystych do produkcji wyspecjalizowanych komórek, takich jak komórki nerwowe lub komórki serca w laboratorium, naukowcy mogą uzyskać dostęp do dorosłych ludzkich komórek bez pobierania tkanek od pacjentów. Następnie mogą szczegółowo zbadać te wyspecjalizowane dorosłe komórki, aby spróbować dostrzec powikłania chorób lub zbadać reakcje komórek na proponowane nowe leki.
Ze względu na ich połączone zdolności nieograniczonej ekspansji i pluripotencji embrionalne komórki macierzyste pozostają teoretycznie potencjalnym źródłem medycyny regeneracyjnej i wymiany tkanek po urazie lub chorobie. Jednak obecnie nie ma zatwierdzonych metod leczenia z wykorzystaniem komórek ES. Pierwsza próba na ludziach została zatwierdzona przez Amerykańską Agencję ds. Żywności i Leków w styczniu 2009 r. Jednak próba na ludziach została rozpoczęta dopiero 13 października 2010 r. W Atlancie w celu zbadania uszkodzenia rdzenia kręgowego . W dniu 14 listopada 2011 roku firma prowadząca rozprawę ( Geron Corporation ) ogłosiła, że zaprzestanie dalszego rozwoju swoich programów dotyczących komórek macierzystych. Różnicowanie komórek ES w komórki nadające się do użytku przy jednoczesnym unikaniu odrzucenia przeszczepu to tylko niektóre z przeszkód, przed którymi wciąż stoją badacze embrionalnych komórek macierzystych. Embrionalne komórki macierzyste, jako pluripotencjalne, wymagają specyficznych sygnałów do prawidłowego różnicowania – jeśli zostaną wstrzyknięte bezpośrednio do innego organizmu, komórki ES będą różnicować się w wiele różnych typów komórek, powodując potworniaka . Względy etyczne dotyczące wykorzystania nienarodzonych tkanek ludzkich są kolejnym powodem braku zatwierdzonych metod leczenia z wykorzystaniem embrionalnych komórek macierzystych. Wiele krajów ma obecnie moratoria lub ograniczenia badań nad ludzkimi komórkami ES lub produkcji nowych linii ludzkich komórek ES.
Mysie embrionalne komórki macierzyste ze znacznikiem fluorescencyjnym
Mezenchymalne komórki macierzyste
Wiadomo, że mezenchymalne komórki macierzyste (MSC) lub mezenchymalne komórki zrębowe, znane również jako medyczne komórki sygnałowe, są multipotentne i można je znaleźć w dorosłych tkankach, na przykład w mięśniach, wątrobie, szpiku kostnym i tkance tłuszczowej. Mezenchymalne komórki macierzyste zwykle działają jako wsparcie strukturalne w różnych narządach, jak wspomniano powyżej, i kontrolują ruch substancji. MSC może różnicować się w wiele kategorii komórek, co jest ilustracją adipocytów, osteocytów i chondrocytów, pochodzących z warstwy mezodermalnej. Gdzie warstwa mezodermy zapewnia wzrost elementów szkieletu ciała, takich jak chrząstka lub kość. Termin „mezo” oznacza środek, infuzja pochodzi z języka greckiego i oznacza, że komórki mezenchymalne są zdolne do przemieszczania się i przemieszczania we wczesnym okresie wzrostu embrionalnego między warstwami ektodermy i endodermy. Mechanizm ten pomaga w wypełnianiu przestrzeni, co jest kluczem do naprawy ran w organizmach dorosłych, które mają związek z komórkami mezenchymalnymi w skórze właściwej (skórze), kościach lub mięśniach.
Wiadomo, że mezenchymalne komórki macierzyste są niezbędne w medycynie regeneracyjnej. Są szeroko badane w badaniach klinicznych . Ponieważ są łatwe do wyizolowania i uzyskują wysoką wydajność, wysoką plastyczność, co umożliwia ułatwianie stanu zapalnego i pobudzanie wzrostu komórek, różnicowania komórek i przywracania tkanki pochodzącej z immunomodulacji i immunosupresji. MSC pochodzi ze szpiku kostnego, co wymaga agresywnej procedury, jeśli chodzi o izolację ilości i jakości izolowanej komórki, i różni się w zależności od wieku dawcy. Porównując wskaźniki MSC w aspiratach szpiku kostnego i zrębie szpiku kostnego, aspiraty mają zwykle niższe wskaźniki MSC niż zrąb. Wiadomo, że MSC są heterogeniczne i wyrażają wysoki poziom pluripotencjalnych markerów w porównaniu z innymi typami komórek macierzystych, takimi jak embrionalne komórki macierzyste. Wstrzyknięcie MSC prowadzi do gojenia się ran przede wszystkim poprzez stymulację angiogenezy.
Kontrola cyklu komórkowego
Embrionalne komórki macierzyste (ESC) mają zdolność do nieskończonych podziałów przy zachowaniu pluripotencji , co jest możliwe dzięki wyspecjalizowanym mechanizmom kontroli cyklu komórkowego . W porównaniu z proliferującymi komórkami somatycznymi , ESC mają unikalne cechy cyklu komórkowego – takie jak szybki podział komórkowy spowodowany skróconą fazą G1 , brakiem fazy G0 i modyfikacjami w punktach kontrolnych cyklu komórkowego – co pozostawia komórki głównie w fazie S w dowolnym momencie. O szybkim podziale ESC świadczy ich krótki czas podwojenia, który wynosi od 8 do 10 godzin, podczas gdy komórki somatyczne mają czas podwojenia wynoszący około 20 godzin lub dłużej. W miarę różnicowania się komórek zmieniają się te właściwości: fazy G1 i G2 wydłużają się, co prowadzi do dłuższych cykli podziałów komórkowych. Sugeruje to, że specyficzna struktura cyklu komórkowego może przyczynić się do powstania pluripotencji.
Szczególnie dlatego, że faza G1 jest fazą, w której komórki mają zwiększoną wrażliwość na różnicowanie, skrócenie G1 jest jedną z kluczowych cech ESC i odgrywa ważną rolę w utrzymaniu niezróżnicowanego fenotypu . Chociaż dokładny mechanizm molekularny pozostaje tylko częściowo poznany, kilka badań wykazało wgląd w to, jak ESC przechodzą przez G1 - i potencjalnie inne fazy - tak szybko.
Cykl komórkowy jest regulowany przez złożoną sieć cyklin , kinazy cyklinozależne (Cdk), inhibitory kinaz cyklinozależnych (Cdkn), białka kieszonkowe z rodziny siatkówczaka (Rb) i inne czynniki pomocnicze. Podstawowy wgląd w charakterystyczną regulację cyklu komórkowego ESC uzyskano dzięki badaniom na mysich ESC (mESC). mESC wykazały cykl komórkowy z bardzo skróconą fazą G1, co umożliwiło komórkom szybkie przełączanie się między fazą M a fazą S. W somatycznym cyklu komórkowym aktywność oscylacyjna kompleksów Cyclin-Cdk obserwuje się w działaniu sekwencyjnym, które steruje kluczowymi regulatorami cyklu komórkowego w celu wywołania jednokierunkowych przejść między fazami: Cyklina D i Cdk4/6 są aktywne w fazie G1, podczas gdy cyklina E i Cdk2 są aktywne w późnej fazie G1 i fazie S; a cyklina A i Cdk2 są aktywne w fazie S i G2, podczas gdy cyklina B i Cdk1 są aktywne w fazie G2 i M. Jednak w mESC ta typowo uporządkowana i oscylacyjna aktywność kompleksów Cyclin-Cdk jest nieobecna. Przeciwnie, kompleks Cyklina E/Cdk2 jest konstytutywnie aktywny przez cały cykl, utrzymując hiperfosforylację białka siatkówczaka (pRb) a więc nieaktywny. Pozwala to na bezpośrednie przejście z fazy M do późnej fazy G1, co prowadzi do braku cyklin typu D, a tym samym do skrócenia fazy G1. Aktywność Cdk2 ma kluczowe znaczenie zarówno dla regulacji cyklu komórkowego, jak i decyzji dotyczących losu komórek w mESC; regulacja w dół aktywności Cdk2 przedłuża progresję fazy G1, ustanawia somatyczny cykl komórkowy podobny do komórki i indukuje ekspresję markerów różnicowania.
W ludzkich ESC (hESC) czas trwania G1 jest dramatycznie skrócony. Przypisuje się to wysokim poziomom mRNA genów cyklin D2 i Cdk4 związanych z G1 oraz niskim poziomom białek regulujących cykl komórkowy, które hamują progresję cyklu komórkowego w G1, takich jak p21 CipP1 , p27 Kip1 i p57 Kip2 . Ponadto regulatory aktywności Cdk4 i Cdk6, takie jak członkowie rodziny inhibitorów Ink (p15, p16, p18 i p19), ulegają ekspresji na niskim poziomie lub wcale. Zatem, podobnie jak mESC, hESC wykazują wysoką aktywność Cdk, przy czym Cdk2 wykazuje najwyższą aktywność kinazy. Podobnie jak mESC, hESC wykazują znaczenie Cdk2 w regulacji fazy G1, pokazując, że przejście z G1 do S jest opóźnione, gdy aktywność Cdk2 jest hamowana, a G1 zostaje zatrzymany, gdy Cdk2 jest powalony. Jednak w przeciwieństwie do mESC, hESC mają funkcjonalną fazę G1. hESC pokazują, że aktywność kompleksów cykliny E / Cdk2 i cykliny A / Cdk2 jest zależna od cyklu komórkowego, a punkt kontrolny Rb w G1 jest funkcjonalny.
ESC charakteryzują się również niefunkcjonalnością punktu kontrolnego G1, mimo że punkt kontrolny G1 ma kluczowe znaczenie dla utrzymania stabilności genomu. W odpowiedzi na uszkodzenie DNA , ESC nie zatrzymują się w G1, aby naprawić uszkodzenia DNA, ale zamiast tego polegają na punktach kontrolnych S i G2/M lub przechodzą apoptozę. Brak punktu kontrolnego G1 w ESC pozwala na usunięcie komórek z uszkodzonym DNA, unikając w ten sposób potencjalnych mutacji wynikających z niedokładnej naprawy DNA. Zgodnie z tą ideą, ESC są nadwrażliwe na uszkodzenia DNA, aby zminimalizować mutacje przekazywane następnemu pokoleniu.
Płodowy
Pierwotne komórki macierzyste znajdujące się w narządach płodu nazywane są płodowymi komórkami macierzystymi.
Istnieją dwa rodzaje płodowych komórek macierzystych:
- Właściwe komórki macierzyste płodu pochodzą z tkanki właściwej płodu i zazwyczaj są uzyskiwane po aborcji . Te komórki macierzyste nie są nieśmiertelne, ale mają wysoki poziom podziału i są multipotentne.
- Pozazarodkowe komórki macierzyste płodu pochodzą z błon pozazarodkowych i generalnie nie różnią się od dorosłych komórek macierzystych. Te komórki macierzyste są nabywane po urodzeniu, nie są nieśmiertelne, ale mają wysoki poziom podziału komórek i są pluripotencjalne.
Dorosły
Dorosłe komórki macierzyste, zwane także komórkami macierzystymi somatycznymi (z greckiego σωματικóς, „ciała”), są komórkami macierzystymi, które utrzymują i naprawiają tkankę, w której się znajdują. Można je znaleźć zarówno u dzieci, jak iu dorosłych.
Istnieją trzy znane dostępne źródła autologicznych dorosłych komórek macierzystych u ludzi:
- Szpik kostny , który wymaga ekstrakcji poprzez pobranie , zwykle z kości miednicy drogą chirurgiczną.
- Tkanka tłuszczowa (komórki tłuszczowe), która wymaga ekstrakcji metodą liposukcji.
- Krew, która wymaga ekstrakcji poprzez aferezę , w której krew jest pobierana od dawcy (podobnie jak w przypadku oddawania krwi) i przepuszczana przez maszynę, która pobiera komórki macierzyste i zwraca inne części krwi dawcy.
Komórki macierzyste można również pobrać z krwi pępowinowej tuż po urodzeniu. Ze wszystkich typów komórek macierzystych autologiczne pobieranie wiąże się z najmniejszym ryzykiem. Z definicji komórki autologiczne uzyskuje się z własnego ciała, tak jak można przechowywać własną krew na potrzeby planowych zabiegów chirurgicznych. [ potrzebne źródło ]
Pluripotencjalne dorosłe komórki macierzyste są rzadkie i na ogół nieliczne, ale można je znaleźć we krwi pępowinowej i innych tkankach. Szpik kostny jest bogatym źródłem dorosłych komórek macierzystych, które były stosowane w leczeniu wielu schorzeń, w tym marskości wątroby, przewlekłego niedokrwienia kończyn i schyłkowej niewydolności serca. Ilość komórek macierzystych szpiku kostnego zmniejsza się wraz z wiekiem i jest większa u mężczyzn niż u kobiet w okresie rozrodczym. Wiele dotychczasowych badań nad dorosłymi komórkami macierzystymi miało na celu scharakteryzowanie ich mocy i zdolności do samoodnawiania. Uszkodzenia DNA gromadzą się wraz z wiekiem zarówno w komórkach macierzystych, jak iw komórkach tworzących środowisko komórek macierzystych. Uważa się, że ta akumulacja jest odpowiedzialna, przynajmniej częściowo, za zwiększenie dysfunkcji komórek macierzystych wraz z wiekiem (patrz Teoria starzenia się uszkodzeń DNA ).
Większość dorosłych komórek macierzystych jest ograniczona genetycznie ( multipotentne ) i ogólnie określa się je na podstawie ich pochodzenia tkankowego ( mezenchymalna komórka macierzysta , komórka macierzysta pochodząca z tkanki tłuszczowej, komórka macierzysta śródbłonka , komórka macierzysta miazgi zęba itp.). Komórki muzowe (wieloliniowe różnicujące komórki odporne na stres) to niedawno odkryty typ pluripotencjalnych komórek macierzystych występujący w wielu dorosłych tkankach, w tym w tkance tłuszczowej, fibroblastach skóry i szpiku kostnym. Chociaż komórki muse są rzadkie, można je zidentyfikować na podstawie ekspresji SSEA-3 , markera dla niezróżnicowanych komórek macierzystych, oraz ogólnych markerów mezenchymalnych komórek macierzystych, takich jak CD90, CD105 . Po poddaniu hodowli w zawiesinie pojedynczych komórek, komórki będą generować skupiska, które są podobne do ciał embrionalnych pod względem morfologii, jak również ekspresji genów, w tym kanonicznych markerów pluripotencji Oct4 , Sox2 i Nanog .
Leczenie dorosłych komórek macierzystych jest z powodzeniem stosowane od wielu lat w leczeniu białaczki i pokrewnych nowotworów kości/krwi poprzez przeszczepy szpiku kostnego. Dorosłe komórki macierzyste są również wykorzystywane w weterynarii do leczenia urazów ścięgien i więzadeł u koni.
Wykorzystanie dorosłych komórek macierzystych w badaniach i terapii nie jest tak kontrowersyjne jak wykorzystanie embrionalnych komórek macierzystych , ponieważ produkcja dorosłych komórek macierzystych nie wymaga zniszczenia zarodka . Dodatkowo, w przypadkach, gdy dorosłe komórki macierzyste są pozyskiwane od zamierzonego biorcy (autoprzeszczep ) , ryzyko odrzucenia zasadniczo nie istnieje. W rezultacie na badania nad dorosłymi komórkami macierzystymi przeznacza się więcej funduszy rządowych USA.
Wraz z rosnącym zapotrzebowaniem na ludzkie dorosłe komórki macierzyste, zarówno do celów badawczych, jak i klinicznych (zwykle potrzeba 1–5 milionów komórek na kg masy ciała na leczenie), niezwykle ważne staje się wypełnienie luki między potrzebą namnażania komórek in vitro oraz zdolność wykorzystania czynników leżących u podstaw starzenia replikacyjnego. Wiadomo, że dorosłe komórki macierzyste mają ograniczoną żywotność in vitro i wchodzą w proces starzenia replikacyjnego prawie niewykrywalnie po rozpoczęciu hodowli in vitro.
owodniowy
Te multipotentne komórki macierzyste, zwane także perinatalnymi komórkami macierzystymi, znajdują się w płynie owodniowym i krwi pępowinowej. Te komórki macierzyste są bardzo aktywne, rozszerzają się w znacznym stopniu bez substancji odżywczych i nie są rakotwórcze. Komórki macierzyste owodni są multipotentne i mogą różnicować się w komórki linii adipogennej, osteogennej, miogennej, śródbłonka, wątrobowej, a także neuronalnej. Komórki macierzyste owodni są przedmiotem aktywnych badań.
Wykorzystanie komórek macierzystych z płynu owodniowego przezwycięża obiekcje etyczne wobec wykorzystywania ludzkich embrionów jako źródła komórek. Nauczanie rzymskokatolickie zabrania wykorzystywania embrionalnych komórek macierzystych w eksperymentach; odpowiednio watykańska gazeta „ Osservatore Romano ” nazwała owodniowe komórki macierzyste „przyszłością medycyny”.
Możliwe jest pobranie owodniowych komórek macierzystych dla dawców lub do użytku autologicznego: pierwszy amerykański bank owodniowych komórek macierzystych został otwarty w 2009 roku w Medford, MA, przez Biocell Center Corporation i współpracuje z różnymi szpitalami i uniwersytetami na całym świecie .
Indukowany pluripotencjalny
Dorosłe komórki macierzyste mają ograniczenia co do ich mocy; w przeciwieństwie do embrionalnych komórek macierzystych (ESC) nie są w stanie różnicować się w komórki ze wszystkich trzech listków zarodkowych . Jako takie są uważane za multipotentne .
Jednak przeprogramowanie pozwala na tworzenie pluripotencjalnych komórek, indukowanych pluripotencjalnych komórek macierzystych (iPSC), z dorosłych komórek. Nie są to dorosłe komórki macierzyste, ale komórki somatyczne (np. nabłonkowe) przeprogramowane tak, by dawały początek komórkom o zdolnościach pluripotencjalnych. Wykorzystując przeprogramowanie genetyczne za pomocą białkowych czynników transkrypcyjnych , uzyskano pluripotencjalne komórki macierzyste o zdolnościach podobnych do ESC. Pierwszą demonstrację indukowanych pluripotencjalnych komórek macierzystych przeprowadził Shinya Yamanaka i jego koledzy z Uniwersytetu w Kioto . Użyli czynników transkrypcyjnych Oct3/4 , Sox2 , c-Myc i Klf4 do przeprogramowania mysich komórek fibroblastów w komórki pluripotencjalne. W późniejszych pracach wykorzystano te czynniki do indukowania pluripotencji w ludzkich komórkach fibroblastów. Junying Yu , James Thomson i ich koledzy z University of Wisconsin-Madison wykorzystali inny zestaw czynników, Oct4, Sox2, Nanog i Lin28, i przeprowadzili swoje eksperymenty z użyciem komórek z ludzkiego napletka . Jednak byli w stanie odtworzyć Yamanakę odkrycie, że indukowanie pluripotencji w ludzkich komórkach było możliwe.
Indukowane pluripotencjalne komórki macierzyste różnią się od embrionalnych komórek macierzystych. Mają wiele podobnych właściwości, takich jak pluripotencja i potencjał różnicowania, ekspresja genów pluripotencji , wzorce epigenetyczne , tworzenie embrionów i potworniaków oraz tworzenie żywotnych chimer , ale istnieje wiele różnic w obrębie tych właściwości. Chromatyna iPSC wydaje się być bardziej „zamknięta” lub metylowana niż chromatyna ESC. Podobnie wzór ekspresji genów między ESC a iPSC, a nawet iPSC pochodzącymi z różnych źródeł. Pojawiają się zatem pytania o „kompletność” art przeprogramowanie i pamięć somatyczna indukowanych pluripotencjalnych komórek macierzystych. Mimo to indukowanie pluripotencjalnych komórek somatycznych wydaje się wykonalne.
W wyniku sukcesu tych eksperymentów, Ian Wilmut , który pomógł stworzyć pierwsze sklonowane zwierzę Dolly the Sheep , ogłosił, że porzuci transfer jądra komórki somatycznej jako kierunek badań.
IPSC znacznie pomogły medycynie, znajdując liczne sposoby leczenia chorób. Ponieważ ludzki IPSCc dał przewagę w tworzeniu in vitro do badania toksyn i patogenezy.
Ponadto indukowane pluripotencjalne komórki macierzyste zapewniają szereg korzyści terapeutycznych. Podobnie jak ESC, są pluripotencjalne . Mają zatem duży potencjał różnicowania; teoretycznie mogą wyprodukować dowolną komórkę w ludzkim ciele (jeśli przeprogramują do pluripotencji było „kompletne”). Co więcej, w przeciwieństwie do ESC, potencjalnie mogłyby umożliwić lekarzom stworzenie linii pluripotencjalnych komórek macierzystych dla każdego indywidualnego pacjenta. Zamrożone próbki krwi mogą być wykorzystane jako cenne źródło indukowanych pluripotencjalnych komórek macierzystych. Specyficzne dla pacjenta komórki macierzyste pozwalają na badanie przesiewowe pod kątem działań niepożądanych przed leczeniem farmakologicznym, a także na zmniejszenie ryzyka odrzucenia przeszczepu. Pomimo ich obecnego ograniczonego zastosowania terapeutycznego, iPSC mają ogromny potencjał do przyszłego wykorzystania w leczeniu i badaniach.
Kontrola cyklu komórkowego
Kluczowe czynniki kontrolujące cykl komórkowy regulują również pluripotencję . Zatem manipulacja odpowiednimi genami może utrzymać pluripotencję i przeprogramować komórki somatyczne do indukowanego stanu pluripotencjalnego. Jednak przeprogramowanie komórek somatycznych jest często mało wydajne i uważane za stochastyczne .
Przy założeniu, że szybszy cykl komórkowy jest kluczowym elementem pluripotencji, można poprawić wydajność przeprogramowania. Metody poprawy pluripotencji poprzez manipulację regulatorami cyklu komórkowego obejmują: nadekspresję cykliny D/Cdk4, fosforylację Sox2 w S39 i S253, nadekspresję cykliny A i cykliny E, knockdown Rb i knockdown członków rodziny Cip /Kip lub rodzina Inków. Ponadto efektywność przeprogramowania jest skorelowana z liczbą podziałów komórkowych zachodzących podczas fazy stochastycznej, na co wskazuje rosnąca nieefektywność przeprogramowania starszych lub wolno nurkujących komórek.
Rodowód
Lineage jest ważną procedurą do analizy rozwijających się zarodków. Ponieważ linie komórkowe pokazują związek między komórkami w każdym podziale. Pomaga to w analizie linii komórek macierzystych po drodze, co pomaga rozpoznać skuteczność komórek macierzystych, długość życia i inne czynniki. Dzięki technice linii komórkowych zmutowane geny można analizować w klonach komórek macierzystych, co może pomóc w szlakach genetycznych. Szlaki te mogą regulować działanie komórek macierzystych.
Aby zapewnić samoodnawianie, komórki macierzyste przechodzą dwa rodzaje podziałów komórkowych (patrz Diagram podziału i różnicowania komórek macierzystych ). Podział symetryczny daje początek dwóm identycznym komórkom potomnym, które mają właściwości komórek macierzystych. Z drugiej strony podział asymetryczny wytwarza tylko jedną komórkę macierzystą i komórkę progenitorową o ograniczonym potencjale samoodnawiania. Przodkowie mogą przejść kilka rund podziału komórki, zanim ostatecznie zróżnicują się w dojrzałą komórkę. Możliwe, że molekularne rozróżnienie między podziałami symetrycznymi i asymetrycznymi polega na zróżnicowanej segregacji białek błony komórkowej (takich jak np. receptory ) pomiędzy komórkami potomnymi.
Alternatywna teoria głosi, że komórki macierzyste pozostają niezróżnicowane z powodu bodźców środowiskowych w ich konkretnej niszy . Komórki macierzyste różnicują się, gdy opuszczają tę niszę lub nie otrzymują już tych sygnałów. Badania przeprowadzone na Drosophila germarium pozwoliły zidentyfikować sygnały połączeń dekapentaplegicznych i przylegających, które zapobiegają różnicowaniu się komórek macierzystych germarium.
Terapie
Terapia komórkami macierzystymi to wykorzystanie komórek macierzystych do leczenia lub zapobiegania chorobie lub stanowi. Przeszczep szpiku kostnego jest formą terapii komórkami macierzystymi stosowaną od wielu lat, ponieważ udowodniono jej skuteczność w badaniach klinicznych.
Implantacja komórek macierzystych może pomóc we wzmocnieniu lewej komory serca, a także w zachowaniu tkanki serca u pacjentów, którzy w przeszłości cierpieli na zawał serca.
Zalety
Leczenie komórkami macierzystymi może złagodzić objawy leczonej choroby lub stanu. Obniżenie objawów może pozwolić pacjentom na zmniejszenie przyjmowania leku w chorobie lub stanie. Leczenie komórkami macierzystymi może również zapewnić społeczeństwu wiedzę umożliwiającą dalsze zrozumienie komórek macierzystych i przyszłe metody leczenia. Wiarą lekarzy byłoby nie wyrządzać szkód, a komórki macierzyste sprawiają, że jest to prostsze niż kiedykolwiek wcześniej. Procesy chirurgiczne ze swej natury są szkodliwe. Tkanka musi zostać upuszczona, aby osiągnąć pomyślny wynik. Można zapobiec niebezpieczeństwu interwencji chirurgicznych z wykorzystaniem komórek macierzystych. Dodatkowo istnieje możliwość choroby, a jeśli procedura się nie powiedzie, może być wymagana dalsza operacja. Zagrożenia związane ze znieczuleniem można również wyeliminować za pomocą komórek macierzystych. Co więcej, komórki macierzyste zostały pobrane z ciała pacjenta i przeniesione tam, gdzie są potrzebne. Ponieważ pochodzą one z własnego ciała pacjenta, nazywa się to leczeniem autologicznym. Uważa się, że leki autologiczne są najbezpieczniejsze, ponieważ prawdopodobieństwo odrzucenia substancji dawcy jest zerowe.
Niedogodności
Leczenie komórkami macierzystymi może wymagać immunosupresji ze względu na konieczność naświetlania przed przeszczepem w celu usunięcia poprzednich komórek danej osoby lub ponieważ układ odpornościowy pacjenta może atakować komórki macierzyste. Jednym ze sposobów uniknięcia drugiej możliwości jest wykorzystanie komórek macierzystych pochodzących od tego samego leczonego pacjenta.
Pluripotencja w niektórych komórkach macierzystych może również utrudniać uzyskanie określonego typu komórek. Trudno jest również uzyskać dokładnie wymagany typ komórek, ponieważ nie wszystkie komórki w populacji różnicują się równomiernie. Niezróżnicowane komórki mogą tworzyć tkanki innego typu niż pożądane.
Niektóre komórki macierzyste po przeszczepie tworzą guzy; pluripotencja jest związana z tworzeniem się guza, zwłaszcza w embrionalnych komórkach macierzystych, właściwych komórkach macierzystych płodu, indukowanych pluripotencjalnych komórkach macierzystych. Właściwe komórki macierzyste płodu tworzą guzy pomimo multipotencji.
Podnoszone są również obawy etyczne dotyczące praktyki wykorzystywania lub badania embrionalnych komórek macierzystych. Pobranie komórek z blastocysty powoduje śmierć blastocysty. Problem polega na tym, czy blastocysta powinna być uważana za ludzkie życie. Debata na ten temat ma głównie charakter filozoficzny, a nie naukowy.
Turystyka komórek macierzystych
Turystyka komórkowa to część branży turystyki medycznej , w której pacjenci podróżują w celu uzyskania procedur z użyciem komórek macierzystych.
Stany Zjednoczone przeżyły eksplozję „klinik komórek macierzystych”. Zabiegi z użyciem komórek macierzystych są wysoce opłacalne dla klinik. Reklama brzmi autorytatywnie, ale skuteczność i bezpieczeństwo procedur nie zostało udowodnione. Pacjenci czasami doświadczają powikłań, takich jak guzy kręgosłupa i śmierć. Wysoki wydatek może również prowadzić do problemów finansowych. Zdaniem naukowców istnieje potrzeba edukowania społeczeństwa, pacjentów i lekarzy na ten temat.
Według Międzynarodowego Towarzystwa Badań nad Komórkami Macierzystymi , największej organizacji akademickiej, która opowiada się za badaniami nad komórkami macierzystymi, terapie komórkami macierzystymi są w fazie rozwoju i nie można jeszcze powiedzieć, że zostały udowodnione. Lekarze powinni informować pacjentów, że badania kliniczne nadal badają, czy te terapie są bezpieczne i skuteczne, ale nieetyczne kliniki przedstawiają je jako udowodnione.
Badania
Niektóre z podstawowych patentów obejmujących ludzkie embrionalne komórki macierzyste są własnością Wisconsin Alumni Research Foundation (WARF) – są to patenty 5 843 780, 6 200 806 i 7 029 913 wynalezione przez Jamesa A. Thomsona . WARF nie egzekwuje tych patentów w stosunku do naukowców akademickich, ale egzekwuje je w stosunku do firm.
Public Patent Foundation złożyła wniosek do Urzędu Patentów i Znaków Towarowych Stanów Zjednoczonych (USPTO) o ponowne zbadanie trzech patentów w imieniu swojego klienta, organizacji non-profit zajmującej się ochroną patentów Consumer Watchdog (wcześniej Foundation for Prawa podatnika i konsumenta). W procesie ponownej oceny, który obejmuje kilka rund dyskusji między USPTO a stronami, USPTO początkowo zgodził się z Consumer Watchdog i odrzucił wszystkie zastrzeżenia we wszystkich trzech patentach, jednak w odpowiedzi WARF zmienił zastrzeżenia we wszystkich trzech patentach, aby uczynić je zawężonymi, aw 2008 roku USPTO uznało, że zmienione zastrzeżenia we wszystkich trzech patentach mają zdolność patentową. Od decyzji w sprawie jednego z patentów (7 029 913) przysługuje odwołanie, od decyzji w sprawie pozostałych dwóch nie. Consumer Watchdog odwołał się od przyznania patentu '913 do Rady ds. Odwołań i Ingerencji Patentowych USPTO (BPAI), która uwzględniła odwołanie, aw 2010 roku BPAI zdecydowało, że zmienione zastrzeżenia patentu '913 nie mają zdolności patentowej. Jednak WARF był w stanie ponownie wszcząć postępowanie w tej sprawie i zrobił to, ponownie zmieniając zastrzeżenia patentu '913, aby je zawęzić, aw styczniu 2013 r. Zmienione roszczenia zostały uwzględnione.
W lipcu 2013 r. Consumer Watchdog ogłosił, że odwoła się od decyzji o uwzględnieniu roszczeń dotyczących patentu 913 do Sądu Apelacyjnego Stanów Zjednoczonych dla Okręgu Federalnego (CAFC), federalnego sądu apelacyjnego, który rozpatruje sprawy patentowe. Na rozprawie w grudniu 2013 r. CAFC podniósł kwestię, czy Consumer Watchdog ma zdolność prawną do odwołania; sprawa nie mogła być kontynuowana, dopóki ten problem nie zostanie rozwiązany.
dochodzenia
Choroby i stany, w których badane jest leczenie komórkami macierzystymi, obejmują:
- Cukrzyca
- Łysienie androgenowe i wypadanie włosów
- Reumatoidalne zapalenie stawów
- Choroba Parkinsona
- choroba Alzheimera
- Zapalenie kości i stawów
- Naprawa udaru i urazowego uszkodzenia mózgu
- Trudności w uczeniu się spowodowane wadami wrodzonymi
- Naprawa urazu rdzenia kręgowego
- Zawał serca
- Kuracje przeciwnowotworowe _
- Odwrócenie łysienia
- Uzupełnij brakujące zęby
- Napraw słuch
- Przywróć wzrok i napraw uszkodzenia rogówki
- Stwardnienie zanikowe boczne
- choroba Crohna
- Gojenie się ran
- Niepłodność męska spowodowana brakiem plemnikowych komórek macierzystych. W ostatnich badaniach naukowcy znaleźli sposób na rozwiązanie tego problemu poprzez przeprogramowanie komórki i przekształcenie jej w plemnik. Inne badania dowiodły przywrócenia spermatogenezy poprzez wprowadzenie ludzkich komórek iPSC do jąder myszy. To może oznaczać koniec azoospermii .
- Niepłodność kobiet : oocyty wykonane z embrionalnych komórek macierzystych. Naukowcy odkryli komórki macierzyste jajnika, rzadki rodzaj komórek (0,014%) występujących w jajniku. Mogłyby być stosowane nie tylko w leczeniu niepłodności, ale także przedwczesnej niewydolności jajników.
- Krytyczne niedokrwienie kończyny
Trwają badania mające na celu opracowanie różnych źródeł komórek macierzystych i zastosowanie terapii komórkami macierzystymi w chorobach i stanach neurodegeneracyjnych , cukrzycy , chorobach serca i innych schorzeniach. Trwają również badania nad wytwarzaniem organoidów przy użyciu komórek macierzystych, co pozwoliłoby na dalsze zrozumienie rozwoju człowieka, organogenezy i modelowania chorób człowieka.
W ostatnich latach, wraz ze zdolnością naukowców do izolowania i hodowli embrionalnych komórek macierzystych oraz rosnącą zdolnością naukowców do tworzenia komórek macierzystych przy użyciu transferu jądra komórki somatycznej i technik tworzenia indukowanych pluripotencjalnych komórek macierzystych , wkradły się kontrowersje, zarówno związane z polityki aborcyjnej i klonowania ludzi . [ potrzebne źródło ]
Hepatotoksyczność i polekowe uszkodzenie wątroby odpowiadają za znaczną liczbę niepowodzeń opracowywania i wycofywania nowych leków z rynku, co podkreśla potrzebę testów przesiewowych, takich jak komórki hepatocytopodobne pochodzące z komórek macierzystych, które są w stanie wykryć toksyczność na wczesnym etapie leku proces rozwoju .
Godne uwagi badania
W sierpniu 2021 roku naukowcy z Princess Margaret Cancer Center w University Health Network opublikowali swoje odkrycie mechanizmu uśpienia w kluczowych komórkach macierzystych, które mogą pomóc w opracowaniu metod leczenia raka w przyszłości.
Zobacz też
Dalsza lektura
- Manzo, Carlo; Torreno-Pina, Juan A.; Massignan, Pietro; Lapeyre, Gerald J.; Lewenstein, Maciej; Garcia Parajo, Maria F. (25 lutego 2015). „Łamanie słabej ergodyczności ruchu receptora w żywych komórkach wynikające z losowej dyfuzyjności”. Przegląd fizyczny X. 5 (1): 011021. arXiv : 1407.2552 . Bibcode : 2015PhRvX...5a1021M . doi : 10.1103/PhysRevX.5.011021 . S2CID 73582473 .
Linki zewnętrzne
|
Zasoby biblioteczne dotyczące komórek macierzystych |