Punkt kontrolny cyklu komórkowego
Punkty kontrolne cyklu komórkowego to mechanizmy kontrolne w cyklu komórkowym eukariota , które zapewniają jego prawidłowy przebieg. Każdy punkt kontrolny służy jako potencjalny punkt końcowy cyklu komórkowego , podczas którego oceniane są warunki komórki, przy czym przejście przez różne fazy cyklu komórkowego następuje tylko wtedy, gdy spełnione są sprzyjające warunki. Istnieje wiele punktów kontrolnych w cyklu komórkowym, ale trzy główne to: punkt kontrolny G1, znany również jako punkt kontrolny początkowy lub restrykcyjny lub główny punkt kontrolny; punkt kontrolny G2/M ; oraz przejście z metafazy do anafazy, znane również jako punkt kontrolny wrzeciona . Postęp przez te punkty kontrolne jest w dużej mierze determinowany przez aktywację kinaz zależnych od cyklin przez regulacyjne podjednostki białkowe zwane cyklinami , których różne formy są wytwarzane na każdym etapie cyklu komórkowego w celu kontrolowania określonych zdarzeń, które w nim występują.
Tło
Wszystkie żywe organizmy są produktami powtarzających się rund wzrostu i podziału komórek. Podczas tego procesu, zwanego cyklem komórkowym , komórka duplikuje swoją zawartość, a następnie dzieli się na dwie części. Celem cyklu komórkowego jest dokładne zduplikowanie DNA każdego organizmu, a następnie równomierny podział komórki i jej zawartości między dwie powstałe komórki. U eukariontów cykl komórkowy składa się z czterech głównych etapów: G 1 , podczas którego komórka jest metabolicznie aktywna i stale rośnie; faza S , podczas której zachodzi replikacja DNA; G2 ; , podczas którego trwa wzrost komórki i komórka syntetyzuje różne białka przygotowując się do podziału oraz faza M ( mitozy ), podczas której zduplikowane chromosomy (znane jako chromatydy siostrzane ) rozdzielają się na dwa jądra potomne, a komórka dzieli się na dwie komórki potomne, z których każda ma pełną kopię DNA. W porównaniu z cyklem komórki eukariotycznej, prokariotycznej (znany jako rozszczepienie binarne ) jest stosunkowo prosty i szybki: chromosom replikuje się z początku replikacji, tworzona jest nowa błona, a ściana komórkowa tworzy przegrodę, która dzieli komórkę na dwa.
Ponieważ cykl komórkowy eukariota jest złożonym procesem, eukarionty wyewoluowały sieć białek regulatorowych, znaną jako system kontroli cyklu komórkowego , który monitoruje i dyktuje postęp komórki w cyklu komórkowym. System ten działa jak timer lub zegar, który ustawia stałą ilość czasu, jaką komórka musi spędzić w każdej fazie cyklu komórkowego, jednocześnie reagując na informacje otrzymane z kontrolowanych przez siebie procesów. Punkty kontrolne cyklu komórkowego odgrywają ważną rolę w systemie kontroli, wykrywając defekty występujące podczas podstawowych procesów, takich jak replikacja DNA lub segregacja chromosomów , i indukując zatrzymanie cyklu komórkowego w odpowiedzi do czasu naprawy defektów. Główny mechanizm działania punktów kontrolnych cyklu komórkowego polega na regulacji aktywności rodziny kinaz białkowych zwanych kinazami cyklinozależnymi ( CDK), które wiążą się z różnymi klasami białek regulatorowych zwanych cyklinami , ze specyficznymi Kompleksy CDK powstają i są aktywowane w różnych fazach cyklu komórkowego. Te kompleksy z kolei aktywują różne dalsze cele, aby promować lub zapobiegać progresji cyklu komórkowego.
Punkt kontrolny G1 (ograniczenie).
Punkt kontrolny G1, znany również jako punkt restrykcyjny w komórkach ssaków i punkt startowy w drożdżach, to punkt, w którym komórka zostaje zobowiązana do wejścia w cykl komórkowy. Gdy komórka przechodzi przez G1, w zależności od warunków wewnętrznych i zewnętrznych, może opóźnić G1, wejść w stan spoczynku znany jako G0 lub przejść poza punkt restrykcyjny. Uszkodzenie DNA jest głównym wskazaniem, że komórka „ogranicza się” i nie wchodzi w cykl komórkowy. Decyzja o zaangażowaniu się w nową rundę podziału komórki następuje, gdy komórka aktywuje transkrypcję zależną od cykliny-CDK, która promuje wejście w fazę S. Ten punkt kontrolny zapewnia dalszy proces.
We wczesnym G1 istnieją trzy represory transkrypcji, znane jako białka kieszonkowe, które wiążą się z czynnikami transkrypcyjnymi E2F . Rodzina genów E2F to grupa czynników transkrypcyjnych ukierunkowanych na wiele genów ważnych dla kontroli cyklu komórkowego, w tym cykliny , CDK, regulatory punktów kontrolnych i białka naprawy DNA. Niewłaściwa regulacja rodziny E2F często występuje w przypadkach raka, dostarczając dowodów na to, że rodzina E2F jest niezbędna do ścisłej regulacji replikacji i podziału DNA. Trzy białka kieszonkowe to Retinoblastoma (Rb), p107 i p130, które wiążą się z czynnikami transkrypcyjnymi E2F, aby zapobiec postępowi poza punkt kontrolny G1.
Rodzina genów E2F zawiera niektóre białka z mechanizmami aktywatorowymi i niektóre białka z mechanizmami represyjnymi. P107 i p130 działają jako korepresory dla E2F 4 i E2F 5, które hamują transkrypcję czynników promujących G1-do-S. Trzecie białko kieszonkowe, Rb, wiąże się i hamuje E2F 1, E2F 2 i E2F 3, które są białkami E2F o zdolnościach aktywujących.
Pozytywne sprzężenie zwrotne odgrywa zasadniczą rolę w regulacji przejścia z fazy G1 do fazy S, w szczególności obejmującej fosforylację Rb przez kompleks białkowy Cyklina/CDK. Rb bez fosforanu lub niefosforylowana Rb reguluje wyjście i różnicowanie cyklu komórkowego G0. Na początku fazy G1 czynniki wzrostu i uszkodzenia DNA sygnalizują wzrost poziomu cykliny D, która następnie wiąże się z Cdk4 i Cdk6, tworząc kompleks CyclinD:Cdk4/6. Wiadomo, że ten kompleks inaktywuje Rb przez fosforylację. Jednak szczegóły fosforylacji Rb są dość złożone i specyficzne w porównaniu z wcześniejszą wiedzą na temat punktu kontrolnego G1. CyclinD:Cdk4/6 umieszcza tylko jeden fosforan lub monofosforylany Rb w jednym z czternastu dostępnych i unikalnych miejsc fosforylacji. Każda z czternastu specyficznych mono-fosforylowanych izoform ma zróżnicowaną preferencję wiązania z członkami rodziny E2F, co prawdopodobnie zwiększa różnorodność procesów komórkowych w ciele ssaka.
E2F 4 i E2F 5 są zależne od p107 i p130, aby utrzymać swoją lokalizację jądrową. Jednak cyklina D:Cdk 4/6 fosforyluje również p107 i p130, proces, który uwalnia ich wiązanie z E2F 4 i 5 (które następnie uciekają do cytoplazmy) i pozwala E2F 1-3 związać się z DNA i zainicjować transkrypcję cykliny E. Białka Rb utrzymują swój stan monofosforylowany podczas wczesnej fazy G1, podczas gdy cyklina E gromadzi się i wiąże się z Cdk2.
CyclinE:Cdk2 odgrywa dodatkową ważną rolę fosforylacji w przejściu G1-do-S. W szczególności CyclinE:Cdk2 promuje pętlę pozytywnego sprzężenia zwrotnego, która tworzy przełącznik „wszystko albo nic”. W wielu sieciach kontroli genetycznej dodatnie sprzężenie zwrotne zapewnia, że komórki nie przesuwają się tam iz powrotem między fazami cyklu komórkowego Cyklina E:Cdk2 przechodzi do fosforylacji Rb we wszystkich swoich miejscach fosforylacji, określanych również jako „hiperfosforylan”, co zapewnia całkowitą inaktywację Rb . Hiperfosforylacja Rb jest uważana za późny punkt restrykcyjny G1, po którym komórka nie może cofnąć się w cyklu komórkowym. W tym momencie białka E2F 1-3 wiążą się z DNA i transkrybują cyklinę A i Cdc 6.
Cyklinozależny inhibitor kinazy 1B (CDKN1B), znany również jako p27, wiąże się i zapobiega aktywacji CyclinE:Cdk2 poprzez hamowanie. Jednakże, gdy cyklina A gromadzi się i wiąże się z Cdk2, tworzą kompleks i hamują p27. Kinaza zależna od cyklin fazy G1 działa razem z kinazą zależną od cyklin fazy S, ukierunkowaną na degradację p27. To z kolei pozwala na pełną aktywację Cykliny A:Cdk2, kompleksu, który fosforyluje E2F 1-3 inicjując ich odłączenie od miejsc promotorowych DNA. Pozwala to E2F 6-8 na wiązanie się z DNA i hamowanie transkrypcji. Pętla ujemnego sprzężenia zwrotnego stosowana do skutecznego hamowania inhibitora, p27, jest kolejnym niezbędnym procesem wykorzystywanym przez komórki w celu zapewnienia ruchu jednokierunkowego i braku cofania się w cyklu komórkowym.
Kiedy dochodzi do uszkodzenia DNA lub gdy komórka wykryje jakiekolwiek defekty, które wymagają od niej opóźnienia lub zatrzymania cyklu komórkowego w G1, zatrzymanie następuje poprzez kilka mechanizmów. Szybka reakcja obejmuje zdarzenia fosforylacji, które inicjowane są przez kinazę ATM ( zmutowana ataksja teleangiektazja ) lub ATR ( pokrewna ataksja telangiektazja i Rad3 ), które działają jako czujniki, w zależności od rodzaju uszkodzenia. Kinazy te fosforylują i aktywują odpowiednio kinazy efektorowe Chk2 i Chk1, które z kolei fosforylują fosfatazę Cdc25A, oznaczając ją w ten sposób do ubikwitynacji i degradacji. Ponieważ Cdc25A aktywuje wspomniany wcześniej kompleks cykliny E-CDK2 poprzez usuwanie hamujących fosforanów z CDK2, pod nieobecność Cdc25A cyklina E-CDK2 pozostaje nieaktywna, a komórka pozostaje w G1.
Aby utrzymać zatrzymanie, inicjowana jest inna odpowiedź, dzięki której Chk2 lub Chk1 fosforylują p53, supresor guza, co stabilizuje p53, uniemożliwiając mu wiązanie Mdm2, ligazy ubikwitynowej, która hamuje p53, kierując go do degradacji. Stabilny p53 działa następnie jako aktywator transkrypcji kilku docelowych genów, w tym p21, inhibitor kompleksu cykliny E-CDK2 promującego G1-do-S. Ponadto innym mechanizmem aktywacji p21 jest akumulacja p16 w odpowiedzi na uszkodzenie DNA. p16 rozrywa kompleksy cykliny D-CDK4, powodując w ten sposób uwalnianie p21 z kompleksów, co prowadzi do defosforylacji i aktywacji Rb, co umożliwia Rb wiązanie i hamowanie E2F 1-3, zapobiegając w ten sposób przejściu komórki do fazy S. Ostatnio niektóre aspekty tego modelu zostały zakwestionowane.
Punkt kontrolny G2
Po replikacji DNA w fazie S komórka przechodzi fazę wzrostu znaną jako G2. W tym czasie produkowane są niezbędne białka mitotyczne, a komórka ponownie podlega mechanizmom regulacyjnym, aby zapewnić odpowiedni stan do wejścia w proliferacyjną fazę mitotyczną (M). W tym przejściu z G2 do M bierze udział wiele mechanistycznych punktów kontrolnych, ze wspólnym czynnikiem łączącym aktywność cykliny-Cdk.
Chociaż wśród organizmów istnieją różnice w wymaganych kompleksach cyklina-Cdk, konieczność aktywności kinazy jest zachowana i zazwyczaj koncentruje się na pojedynczym parowaniu. W drożdżach rozszczepialnych istnieją trzy różne formy cyklin mitotycznych, a sześć w drożdżach pączkujących, jednak główną wykorzystywaną cykliną jest cyklina B. Cyklina B posłuży jako odniesienie do dyskusji na temat przejścia punktu kontrolnego G2/M.
Podobnie jak w fazie S, G2 doświadcza punktu kontrolnego uszkodzenia DNA. Komórka jest ponownie badana pod kątem miejsc uszkodzenia DNA lub niepełnej replikacji, a kinazy ATR i ATM są rekrutowane do miejsc uszkodzeń. Następuje również aktywacja Chk1 i Chk2, jak również aktywacja p53, w celu wywołania zatrzymania cyklu komórkowego i zatrzymania progresji do mitozy. Dodatkowy składnik fazy S, kompleks przedreplikacyjny, musi zostać zdezaktywowany poprzez fosforylację cykliny B-Cdk1.
Gdy ocenia się te poprzednie punkty kontrolne, akumulacja białka G2 służy do aktywacji aktywności cykliny B-Cdk1 poprzez wiele mechanizmów. CyclinA-Cdk2 aktywuje Cdc25, aktywator cykliny B-Cdk1, który następnie dezaktywuje inhibitor cykliny B-Cdk1, Wee1. Powoduje to dodatnie sprzężenie zwrotne, znacznie zwiększając ekspresję cykliny B i aktywację Cdk1. Gdy komórka przechodzi przez G2 i osiąga przejście G2/M, kinaza Plk1 fosforyluje Wee1, która celuje w Wee1 w celu degradacji przez kompleks ligazy ubikwitynowej SCF. Dodatkową funkcją Plk1 jest aktywacja Cdc25 poprzez fosforylację. Złożonym efektem degradacji Wee1 i aktywacji Cdc25 jest całkowite usunięcie hamującej fosforylacji z cdc2, która aktywuje cdc2. Plk1 jest aktywowany w przejściu G2/M przez Aurora A i Bora, które gromadzą się podczas G2 i tworzą kompleks aktywacyjny. Kompleks Plk1-Cdc2-cdc25 następnie inicjuje pętlę dodatniego sprzężenia zwrotnego, która służy do dalszej aktywacji Cdc2, aw połączeniu ze wzrostem poziomów cykliny B podczas G2, powstałe kompleksy cdc2-cyklina B następnie aktywują dalsze cele, które promują wejście w mitozę. Wynikająca z tego aktywność Cdk1 aktywuje również ekspresję Mem1-Fkh, genu przejściowego G2/M. Gwałtowny wzrost aktywności cykliny B-Cdk1 jest konieczny, ponieważ inicjacja fazy M jest zdarzeniem typu „wszystko albo nic” angażującym się w histerezę. Histereza aktywności Cdk1 poprzez cyklinę B napędza wejście fazy M poprzez ustalenie minimalnego progu stężenia cykliny B. Istnieje na poziomie wyższym niż minimum potrzebne do kontynuacji fazy M po wejściu, działając w celu zabezpieczenia zdarzenia „wszystko albo nic”. To stężenie wejściowe jest dalej zwiększane w przypadku niepełnej replikacji DNA, dodając kolejny mechanizm regulacyjny w punkcie przejścia G2/M. Obecność histerezy pozwala na silną regulację wejścia fazy M w funkcji aktywności cykliny B-Cdk1.
Mechanizmy, dzięki którym zapobiega się wejściu mitozy w odpowiedzi na uszkodzenie DNA, są podobne do tych w punkcie kontrolnym G1 / S. Uszkodzenie DNA wyzwala aktywację wspomnianego szlaku ATM/ATR, w którym ATM/ATR fosforyluje i aktywuje kinazy punktu kontrolnego Chk1/Chk2. Chk1/2 fosforyluje cdc25, który oprócz tego, że jest hamowany, jest również sekwestrowany w cytoplazmie przez białka 14-3-3. 14-3-3 są regulowane w górę przez p53, który, jak wspomniano wcześniej, jest aktywowany przez Chk1 i ATM/ATR. p53 również transaktywuje p21, a zarówno p21, jak i 14-3-3 z kolei hamują kompleksy cykliny B-cdc2 poprzez fosforylację i cytoplazmatyczne sekwestrowanie cdc2. Ponadto inaktywacja cdc25 powoduje jego niezdolność do defosforylacji i aktywacji cdc2. Wreszcie, innym mechanizmem odpowiedzi na uszkodzenie jest negatywna regulacja Plk1 przez ATM/ATR, co z kolei skutkuje stabilizacją Wee1 i Myt1, które mogą następnie fosforylować i hamować cdc2, utrzymując w ten sposób komórkę zatrzymaną w G2 do czasu uszkodzenia naprawił.
Przejście G2 – M w oocytach Xenopus
Pod koniec G2 komórka przechodzi w mitozę, w której dzieli się jądro. Przejście z G2 do M jest dramatyczne; istnieje efekt „wszystko albo nic”, a przejście jest nieodwracalne. Jest to korzystne dla komórki, ponieważ wejście w mitozę jest krytycznym etapem w cyklu życiowym komórki. Jeśli nie zostanie w pełni zatwierdzona, komórka napotka wiele problemów z częściowym podziałem, co ostatecznie prawdopodobnie doprowadzi do śmierci komórki.
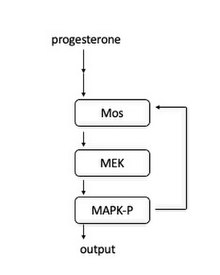
W oocytach żaby kaskada sygnału jest indukowana, gdy progesteron wiąże się z receptorem związanym z błoną. W dole rzeki Mos jest aktywowany. Mos następnie fosforyluje MEK1, który fosforyluje MAPK. MAPK pełni dwie role: aktywację kompleksu Cyklina B-Cdk1 w celu zainicjowania wejścia w mitozę i aktywację Mos. Aktywacja Mos prowadzi do pętli dodatniego sprzężenia zwrotnego i dlatego działa jak „przełącznik”, aby stworzyć wejście do mitozy typu „wszystko albo nic”.
Ta pętla sprzężenia zwrotnego została po raz pierwszy odkryta przez wykazanie, że stężenia MAPK-P (fosforylowanej MAPK) wzrosły w odpowiedzi na wzrastające poziomy progesteronu. Na poziomie pojedynczej komórki każda komórka albo miała całkowicie ufosforylowaną MAPK, albo nie miała ufosforylowanej MAPK, co potwierdza, że działa ona jak mechanizm podobny do przełącznika w każdej komórce. Wykazano dodatkowo, że blokowanie syntezy białka Mos sprawia, że odpowiedzi MAPK-P są bardziej stopniowane, co pokazuje, że synteza białka Mos jest niezbędna do aktywacji MAPK typu „wszystko albo nic”.
Bistabilność
Ten proces można zrozumieć za pomocą niestabilności. Korzystając z wykresu pokazanego po prawej stronie, szybkość syntezy Mos zmienia się w miarę dodawania większej ilości progesteronu. Z każdą krzywą istnieją stabilne punkty stałe i niestabilne punkty stałe. W niestabilnych punktach stałych system będzie naciskał w kierunku jednego ze stabilnych punktów stałych. Tak więc system może być w stanie „włączony” lub „wyłączony”, a nie pomiędzy. Kiedy poziom progesteronu jest wystarczająco wysoki, krzywa Mos przesuwa się wyżej i ostatecznie przecina linię degradacji tylko w jednym punkcie, więc jest tylko jeden stabilny stan „on”, wskazujący na wejście w mitozę.
Nieodwracalność, którą widzimy w punkcie przejścia mitozy, wynika z posiadania wystarczająco wysokiego poziomu progesteronu w komórce. Przy wystarczająco wysokich poziomach progesteronu system jest monostabilny w wyniku dodatniego sprzężenia zwrotnego między Mapk i Mos. Punkt, w którym system przełącza się z bistabilnego na monostabilny, nazywany jest bifurkacją węzła siodłowego.
Tak więc możemy zrozumieć nieodwracalną reakcję przejścia mitotycznego typu „wszystko albo nic” za pomocą matematycznego modelu regulatorów molekularnych jako systemu bistabilnego, który zależy od istnienia dodatniego sprzężenia zwrotnego. „Stan wyłączenia” jest unicestwiany przez wystarczająco wysoki poziom progesteronu, a gdy komórka zostanie wypchnięta poza stan wyłączenia, utknie w stanie włączenia.
Histereza i model Novaka-Tysona
Wychodząc z tego bistabilnego modelu, możemy zrozumieć przejście mitotyczne jako poleganie na histerezie, która go napędza. Histereza jest definiowana jako zależność stanu systemu od jego historii. Model Novaka-Tysona to matematyczny model progresji cyklu komórkowego, który przewiduje, że nieodwracalne przejścia wchodzące i wychodzące z mitozy są napędzane przez histerezę. Model ma trzy podstawowe przewidywania, które powinny być prawdziwe w cyklicznych ekstraktach oocytów, których progresja cyklu komórkowego zależy od histerezy:
- Stężenie cykliny B niezbędne do wejścia w mitozę jest wyższe niż stężenie potrzebne do utrzymania ekstraktu mitotycznego w mitozie.
- Niereplikowany DNA podnosi poziom cykliny niezbędny do aktywacji Cdc2, a tym samym do wejścia w mitozę.
- Występuje spadek szybkości aktywacji Cdc2 przy stężeniach cykliny B tuż powyżej progu aktywacji.
Sha i wsp. przeprowadzili eksperymenty na ekstraktach z jaja Xenopus laevis w 2003 r., aby zademonstrować ten histeryczny charakter. Korzystając z ekstraktów cyklicznych, zaobserwowali, że próg aktywacji Δcykliny B wynosi od 32 do 42 nM, podczas gdy próg inaktywacji wynosi od 16 do 24 nM Δcykliny B. Dlatego te eksperymenty potwierdziły bistabilność tego układu i znaczenie histerezy w tej komórce przejście cyklu. Przy pośrednich stężeniach cykliny B możliwy jest albo interfaza, albo stan mitotyczny komórki.
Reakcja na stres replikacyjny
Ponieważ wejście w mitozę jest dużym i kosztownym zobowiązaniem dla komórki, logiczne jest, że istniałyby systemy zapobiegające przedwczesnemu wejściu w ten etap. Wykazano, że błędy w poprzednich krokach, takie jak posiadanie niezreplikowanych odcinków DNA, blokują progresję w cyklu komórkowym. Model Novaka – Tysona przewiduje, że dzieje się to poprzez podniesienie poziomu cykliny B niezbędnej do wejścia w mitozę.
Sha i in. zbadali, czy jest to prawdą w Xenopus . Użyli afidikoliny (APH) do hamowania polimerazy DNA i zapobiegania replikacji DNA. Po potraktowaniu cykliną B w interfazie próg aktywacji wzrósł do między 80 a 100 nM, zgodnie z przewidywaniami modelu Novak-Tyson. Tak więc te eksperymenty potwierdzają, że stres niezreplikowanego DNA w komórce wpływa na pętlę histerezy i skutkuje znacznie wyższym progiem cykliny B, aby wejść w mitozę.
Punkt kontrolny metafazy
Punkt kontrolny wrzeciona mitotycznego występuje w punkcie metafazy , w którym wszystkie chromosomy powinny/były wyrównane na płytce mitotycznej i znajdować się pod napięciem dwubiegunowym. Wyczuwane jest napięcie stworzone przez to dwubiegunowe przywiązanie, które inicjuje wejście anafazy. Aby to zrobić, mechanizm wykrywania zapewnia, że kompleks promujący anafazę (APC/C) nie jest już hamowany, który może teraz swobodnie rozkładać cyklinę B , która zawiera D-box (pudełko zniszczenia) i rozkładać sekurynę . To ostatnie jest białkiem, którego funkcją jest hamowanie separazy , która z kolei tnie kohezyny , białkowy kompozyt odpowiedzialny za spójność chromatyd siostrzanych. Gdy to białko hamujące zostanie zdegradowane przez ubikwitynację i późniejszą proteolizę, separaza powoduje następnie rozdział chromatyd siostrzanych. Po podziale komórki na dwie komórki potomne, komórka wchodzi do G1 .
Rak
naprawy DNA i punkty kontrolne cyklu komórkowego są ściśle powiązane z rakiem ze względu na ich funkcje regulujące odpowiednio stabilność genomu i progresję komórek. Dokładne mechanizmy molekularne, które łączą dysfunkcje w tych szlakach z wystąpieniem poszczególnych nowotworów, w większości przypadków nie są dobrze poznane. Wykazano, że utrata ATM poprzedza rozwój chłoniaka, prawdopodobnie z powodu nadmiernej rekombinacji homologicznej, co prowadzi do wysokiej niestabilności genomu. Zakłócenie Chk1 u myszy doprowadziło do znacznej błędnej regulacji punktów kontrolnych cyklu komórkowego, nagromadzenia uszkodzeń DNA i zwiększonej częstości powstawania nowotworów. Dziedziczenie pojedynczego mutanta BRCA1 lub BRCA2 predysponuje kobiety do raka piersi i jajnika. Wiadomo, że BRCA1 jest wymagany do przejść S i G2/M i bierze udział w odpowiedzi komórkowej na uszkodzenie DNA. Uważa się, że BRCA2 bierze udział w rekombinacji homologicznej i regulacji punktu kontrolnego fazy S, a mutacje niedoborów w BRCA2 są silnie związane z powstawaniem nowotworów.
Zobacz też
- Przełączniki biochemiczne w cyklu komórkowym
- Analiza cyklu komórkowego
- Punkt kontrolny uszkodzenia DNA G2-M
- Punkt kontrolny po replikacji
- Punkt kontrolny rekombinacji mejotycznej