Punkt kontrolny uszkodzenia DNA G2-M
Punkt kontrolny uszkodzeń DNA G2 - M jest ważnym punktem kontrolnym cyklu komórkowego w organizmach eukariotycznych , który zapewnia, że komórki nie zainicjują mitozy , dopóki uszkodzone lub niecałkowicie zreplikowane DNA nie zostanie wystarczająco naprawione. Komórki z wadliwym punktem kontrolnym G2 - M ulegną apoptozie lub śmierci po podziale komórki, jeśli wejdą w fazę M przed naprawą swojego DNA. Cechą biochemiczną definiującą ten punkt kontrolny jest aktywacja kompleksów cyklina-CDK fazy M , które fosforylują białka promujące składanie wrzeciona i doprowadzające komórkę do metafazy .
Aktywność cykliny B-CDK 1
Cykl komórkowy jest napędzany przez białka zwane kinazami zależnymi od cyklin , które łączą się z białkami regulatorowymi cyklin w różnych punktach kontrolnych cyklu komórkowego. Różne fazy cyklu komórkowego doświadczają aktywacji i/lub dezaktywacji określonych kompleksów cyklina-CDK.
Aktywność CyclinB-CDK1 jest specyficzna dla punktu kontrolnego G2/M. Akumulacja cykliny B zwiększa aktywność kinazy cyklinozależnej Cdk1, ludzkiego homologu Cdc2 , gdy komórki przygotowują się do wejścia w mitozę. Aktywność Cdc2 jest dalej regulowana przez fosforylację / defosforylację odpowiednich aktywatorów i inhibitorów. Poprzez dodatniego sprzężenia zwrotnego , CyclinB-Cdc2 aktywuje fosfatazę Cdc25 , która z kolei dezaktywuje inhibitory CyclinB-Cdc2, Wee1 i Myt1. Cdc25 aktywuje kompleks poprzez usunięcie fosforanów z miejsca aktywnego, podczas gdy Wee1 inaktywuje kompleks poprzez fosforylację reszt tyrozyny, w szczególności tyrozyny-15.
Ta pętla jest dodatkowo wzmacniana pośrednio poprzez skoordynowaną interakcję kinazy Aurora A i kofaktora Bora. Podczas fazy G2 Bora gromadzi się i tworzy kompleks aktywacyjny z Aurorą A. Kompleks ten następnie reguluje aktywację kinazy podobnej do Polo 1 (Plk1). Plk1 fosforyluje Wee1, kierując go do degradacji przez kompleks ligazy ubikwityny SCF ( kompleks SCF ) i aktywuje Cdc25 poprzez fosforylację z połączonym działaniem aktywującym Cdc2. Połączona aktywność i kompleks Cdc2, Cdc25 i Plk1 z akumulacją cykliny B aktywuje kompleks CyclinB-Cdc2, promując wejście w mitozę.
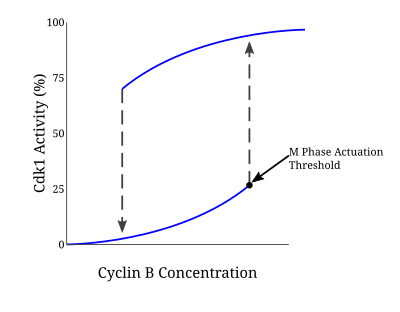
Wiele białek zaangażowanych w tę pętlę dodatniego sprzężenia zwrotnego napędza aktywację kompleksu CyclinB-Cdc2, ponieważ wejście w mitozę wymaga odpowiedzi „wszystko albo nic”. Model Novaka -Tysona jest modelem matematycznym używanym do wyjaśnienia takiej pętli regulacyjnej, która przewidywała nieodwracalne przejście do mitozy napędzanej histerezą. Poprzez eksperymenty na bezkomórkowych ekstraktach jaja Xenopus laevis potwierdzono, że taki model jest podstawą wejścia w mitozę. Gdy stężenie cykliny osiągnie pewien minimalny próg aktywacji, Cdc2 jest szybko aktywowany. Pozostaje w tym stanie, dopóki aktywność nie spadnie poniżej oddzielnego progu inaktywacji, przy którym jest nagle inaktywowana przez fosforylację tyrozyny przez Wee1 i Myt1. W przypadku niereplikowanego DNA próg stężenia cykliny dla aktywacji Cdc2 jest dalej zwiększany. Dzięki temu mechanizmowi istnieją dwa oddzielne stany ustalone, oddzielone niestabilnym stanem ustalonym. Bistabilny i histeretyczny charakter CyclinB-Cdc2 zapewnia wysoce regulowany charakter punktu kontrolnego G2/M.
Odpowiedź szlaku na uszkodzenie DNA
Białka, które lokalizują się w miejscach uszkodzenia DNA w fazie G2, inicjują kaskadę sygnalizacyjną, która reguluje ważne elementy szlaku, jak opisano powyżej, kontrolując w ten sposób wejście mitotyczne poprzez aktywność CyclinB-Cdc2. Negatywna regulacja aktywności CyclinB-Cdc2 skutkuje opóźnieniem wejścia mitotycznego, co jest ważne dla komórek w naprawie wszelkich uszkodzeń DNA, które mogły się nagromadzić po fazie S i są niezbędne, zanim podział komórki będzie mógł być kontynuowany.
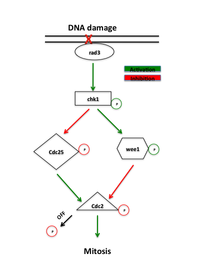
Białka, które działają w punkcie kontrolnym G2-M, zostały pierwotnie zidentyfikowane w badaniach przesiewowych drożdży, które szukały mutantów wykazujących zwiększoną wrażliwość na promieniowanie, zwanych mutantami „rad”. Nieskuteczna naprawa DNA uszkodzonego przez promieniowanie jonizujące lub czynniki chemiczne w tych mutantach ujawniła białka niezbędne w tym szlaku. Wczesne białka sygnałowe w szlaku punktu kontrolnego należą do rodziny 3-kinaz fosfatydyloinozytolu, rad3 u drożdży i ATR u kręgowców, które, jak się uważa, lokalizują się w miejscach uszkodzenia DNA. Rad3 fosforyluje rad26, który jest wymagany do zainicjowania, ale nie utrzymania punktu kontrolnego. Rad3 fosforyluje również szereg innych białek, których brak znosi naprawę DNA w punkcie kontrolnym, w tym rad1, rad9, hus1 i rad17. Postawiono hipotezę, że rad9, hus1 i rad17 są podobne do białek zaangażowanych w tworzenie klamry, która zwiększa procesywność polimerazy DNA podczas replikacji DNA . Zgodnie z tą ideą rad17 jest podobny do białek zaangażowanych w ładowanie klamry na DNA. Potwierdza to model, w którym fosforylacja przez rad3 powoduje rekrutację tych białek do miejsc uszkodzenia DNA, gdzie pośredniczą one w aktywności polimeraz DNA zaangażowanych w naprawę DNA .
Głównym efektorem rad3 jest kinaza Chk1 , która jest wymagana do zatrzymania G2-M w odpowiedzi na czynniki uszkadzające DNA. Chk1 jest efektorową kinazą białkową, która utrzymuje cyklinę mitotyczną w stanie nieaktywnym i jest fosforylowana przez rad3 między fazą S a mitozą, co implikuje jej specyficzną rolę w zatrzymaniu G2. Jego regulacja w górę poprzez nadekspresję może wywołać zatrzymanie niezależnie od uszkodzenia DNA. Ponadto nadekspresja Chk1 ratuje wrażliwość mutantów rad na promieniowanie, przypuszczalnie umożliwiając naprawę DNA przed wejściem w mitozę.
Obecność uszkodzenia DNA uruchamia szlaki ATM (zmutowana ataksja teleangiektazja) lub ATR (pokrewna ataksja telangiektazja i Rad3), które aktywują odpowiednio kinazy Chk2 i Chk1. Kinazy te działają powyżej Cdc25 i Wee1, bezpośrednich regulatorów kompleksu CyclinB-Cdc2. Chk1 i Chk2 fosforylują Cdc25, hamując jego aktywność fosforylującą i oznaczając go do ubikwitynowanej degradacji. Szlaki te stymulują również supresor guza p53 . p53 reguluje funkcję inhibitora Cdk2 p21 i białek 14-3-3 , które odpowiednio fosforylują (a tym samym inaktywują) i sekwestrują Cdc25 w cytoplazmie. Ostatnie badania sugerują również, że Cdk1 i 14-3-3 pozytywnie regulują Wee1 w podobny sposób. Hiperfosforylacja Wee1 przez Cdk1 pozwala na wiązanie 14-3-3, sekwestrację Wee1 do jądra i zwiększenie jego zdolności do fosforylacji Cdc2 . Fosforylacja zarówno Wee1, jak i Cdc25 zapobiega aktywacji Cdc2.
Szlak ATM/ATR skutkuje również negatywną regulacją Plk1, która przyczynia się do stabilności Wee1. Stabilizacja Wee1 i Myt1 zapewnia zatrzymanie komórek w G2 i umożliwia naprawę DNA.
W odpowiedź punktu kontrolnego zaangażowanych jest wiele szlaków, a zatem celowanie w Cdc25 nie jest jedynym mechanizmem leżącym u podstaw opóźnienia cyklu komórkowego, jak proponowały niektóre modele. Współpraca Cdc25 przez Chk1 w odpowiedzi na niereplikowany lub uszkodzony DNA skutkuje silnym zatrzymaniem G2. Wzrost ilości Wee1 i spadek ilości Cdc25 przyczynia się do wzrostu progu stężenia cykliny B w pętli histerezy potrzebnej do wprowadzenia komórki w mitozę.
Utrzymanie punktu kontrolnego
Rad3 jest wymagany do aktywacji Chk1 i zainicjowania zatrzymania G2, ale uważa się, że różne białka utrzymują zatrzymanie G2, tak aby mogła nastąpić wystarczająca naprawa DNA. Jednym z takich białek jest rad18 , który jest wymagany do zatrzymania G2, nawet gdy Chk1 jest ufosforylowany i aktywny. Zatem rad18 jest wymagany do konserwacji punktu kontrolnego G2/M, podczas gdy Chk1 jest wymagany do inicjacji punktu kontrolnego. Jest to dodatkowo wspierane przez jego dodatkową funkcję w naprawie DNA, szczególnie w utrzymaniu struktur chromosomalnych. O jego konieczności świadczy fakt, że przy braku rad18 DNA nie może zostać naprawione, nawet jeśli zatrzymanie G2 jest przedłużane innymi sposobami.
Utrzymanie takiego zatrzymania w fazie G2 jest dodatkowo podtrzymywane przez p53 i p21. W przypadku braku p53 lub p21 wykazano, że napromieniowane komórki przechodziły w mitozę. Brak p21 lub 14-3-3 nie może wystarczająco hamować kompleksu CyclinB-Cdc2, wykazując w ten sposób kontrolę regulacyjną p53 i p21 w punkcie kontrolnym G2 w odpowiedzi na uszkodzenie DNA. Mutacje p53 mogą skutkować znacznym deficytem punktu kontrolnego, co ma ważne implikacje w leczeniu raka.
Dezaktywacja punktu kontrolnego
Inaktywacja zarówno Wee1, jak i Cdc25 znosi punkt kontrolny uszkodzenia DNA G2-M. Brak Wee1 lub usunięcie miejsca tyrozyny-15 usuwa negatywną regulację aktywności Cdc2 i powoduje, że komórki wchodzą w mitozę bez zakończenia naprawy, co skutecznie znosi punkt kontrolny G2-M. Brak Cdc25 zatrzymuje komórki w G2, ale nadal umożliwia aktywację punktu kontrolnego G2-M, co sugeruje, że zarówno aktywacja Wee1, jak i dezaktywacja Cdc25 są ważnymi krokami regulacyjnymi w punkcie kontrolnym.
Inaktywacja Chk1 jest wystarczająca, aby przekroczyć punkt kontrolny i promować wejście w mitozę, niezależnie od tego, czy uszkodzenie DNA zostanie naprawione. Jednak wciąż niewiele wiadomo na temat dokładnego mechanizmu dotyczącego terminacji punktów kontrolnych z możliwymi mechanizmami, w tym fosfatazami białkowymi odwracającymi aktywujące fosforylacje, ukierunkowaną degradacją ubikwityny białek aktywujących i antagonistami punktów kontrolnych promującymi mitozę poprzez niezależne szlaki.
Rak
Stwierdzono, że wiele regulatorów cyklu komórkowego, takich jak Cdks, cykliny i p53, ma nieprawidłową ekspresję w raku. Mówiąc dokładniej, biorą udział w przejściu G2/M poprzez lokalizację w centrosomie, co prowadzi do badań nad manipulowaniem takimi białkami w celu poprawy wrażliwości raka na promieniowanie i chemioterapię. Chk1 ma ważne implikacje w ukierunkowaniu leków na raka, ponieważ jego funkcja działa w odpowiedzi na uszkodzenie DNA. Cytotoksyczne skutki chemioterapii są obecnie badane w zakresie modulacji przejścia G2/M, zarówno w odniesieniu do zniesienia punktu kontrolnego, jak i zatrzymania punktu kontrolnego. Wiele terapii koncentruje się na inaktywacji punktu kontrolnego, aby zmusić komórki z nadmiernym uszkodzeniem DNA do przejścia przez mitozę i wywołania śmierci komórki.