profaza

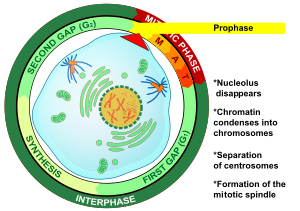
Profaza (od starogreckiego προ- ( pro- ) „przed” i φάσις (phásis) „wygląd”) jest pierwszym etapem podziału komórki zarówno w mitozie , jak i mejozie . Począwszy od interfazy , DNA zostało już zreplikowane, gdy komórka wchodzi w profazę. Główne zjawiska w profazie to kondensacja retikulum chromatyny i zanik jąderka .
Barwienie i mikroskopia
Mikroskopię można wykorzystać do wizualizacji skondensowanych chromosomów podczas ich przechodzenia przez mejozę i mitozę .
różne barwniki DNA , tak że kondensujące się chromosomy można wizualizować jako przejście przez profazę.
Technika giemsa G-banding jest powszechnie stosowana do identyfikacji chromosomów ssaków , ale wykorzystanie tej technologii na komórkach roślinnych było pierwotnie trudne ze względu na wysoki stopień zagęszczenia chromosomów w komórkach roślinnych. Pasmo G zostało w pełni zrealizowane dla chromosomów roślinnych w 1990 r. Zarówno podczas profazy mejotycznej , jak i mitotycznej , barwienie Giemsą można zastosować do komórek w celu wywołania prążków G w chromosomach . Barwienie srebrem, bardziej nowoczesna technologia, w połączeniu z barwieniem giesma może być użyte do zobrazowania kompleksu synaptonemalnego na różnych etapach profazy mejotycznej . Aby wykonać pasmo G , chromosomy muszą być utrwalone, a zatem nie jest możliwe wykonanie na żywych komórkach.
Barwniki fluorescencyjne , takie jak DAPI, można stosować zarówno w żywych komórkach roślinnych , jak i zwierzęcych . Plamy te nie tworzą prążków na chromosomach , ale zamiast tego umożliwiają sondowanie DNA określonych regionów i genów . Zastosowanie mikroskopii fluorescencyjnej znacznie poprawiło rozdzielczość przestrzenną .
Profaza mitotyczna
Profaza jest pierwszym etapem mitozy w komórkach zwierzęcych i drugim etapem mitozy w komórkach roślinnych . Na początku profazy w komórce występują dwie identyczne kopie każdego chromosomu z powodu replikacji w interfazie . Kopie te nazywane są chromatydami siostrzanymi i są połączone elementem DNA zwanym centromerem . Głównymi wydarzeniami profazy są: kondensacja chromosomów , ruch centrosomów , powstawanie wrzeciona mitotycznego i początek rozpadu jąderek .
Kondensacja chromosomów
DNA replikowane w interfazie jest skondensowane z nici DNA o długości od 0,7 μm do 0,2-0,3 μm . Proces ten wykorzystuje kompleks kondensatu . Chromosomy skondensowane składają się z dwóch siostrzanych chromatyd połączonych centromerem .
Ruch centrosomów
Podczas profazy w komórkach zwierzęcych centrosomy oddalają się od siebie na tyle, że można je rozdzielić za pomocą mikroskopu świetlnego . Aktywność mikrotubul w każdym centrosomie jest zwiększona z powodu rekrutacji γ-tubuliny . Zreplikowane centrosomy z interfazy oddalają się od siebie w kierunku przeciwnych biegunów komórki, napędzane przez białka motoryczne związane z centrosomem . Międzypalcowe mikrotubule międzybiegunowe z każdego centrosomu oddziałują na siebie, pomagając przesuwać centrosomy na przeciwne bieguny.
Tworzenie wrzeciona mitotycznego
Mikrotubule zaangażowane w rusztowanie międzyfazowe rozpadają się, gdy replikowane centrosomy rozdzielają się. Ruchowi centrosomów do przeciwległych biegunów towarzyszy w komórkach zwierzęcych organizacja poszczególnych radialnych układów mikrotubul (astry) przy każdym centromerze. Międzybiegunowe mikrotubule z obu centrosomów oddziałują na siebie, łącząc zestawy mikrotubul i tworząc podstawową strukturę wrzeciona mitotycznego . Komórki roślinne nie mają centrosomów i chromosomy mogą zarodkować zespół mikrotubul w aparacie mitotycznym . W komórkach roślinnych mikrotubule gromadzą się na przeciwległych biegunach i zaczynają tworzyć aparat wrzeciona w miejscach zwanych ogniskami. Wrzeciono mitotyczne ma ogromne znaczenie w procesie mitozy i ostatecznie segreguje siostrzane chromatydy w metafazie .
Początek rozpadu jąderka
Jąderka zaczynają się rozkładać w profazie, co powoduje przerwanie produkcji rybosomów . Wskazuje to na przekierowanie energii komórkowej z ogólnego metabolizmu komórkowego do podziału komórkowego . Otoczka jądrowa pozostaje nienaruszona podczas tego procesu.
Profaza mejotyczna
Mejoza obejmuje dwie rundy segregacji chromosomów , a zatem dwukrotnie przechodzi profazę, w wyniku czego powstaje profaza I i profaza II. Profaza I jest najbardziej złożoną fazą całej mejozy, ponieważ homologiczne chromosomy muszą się łączyć i wymieniać informacje genetyczne . Profaza II jest bardzo podobna do profazy mitotycznej .
profaza I
Profaza I dzieli się na pięć faz: leptoten, zygoten, pachyten, diploten i diakineza. Oprócz zdarzeń zachodzących w mitotycznej , w tych fazach zachodzi kilka kluczowych zdarzeń, takich jak parowanie homologicznych chromosomów i wzajemna wymiana materiału genetycznego między tymi homologicznymi chromosomami . Profaza I zachodzi z różną szybkością w zależności od gatunku i płci . Wiele gatunków zatrzymuje mejozę w diplotenie profazy I aż do owulacji . U ludzi mogą minąć dziesięciolecia, ponieważ oocyty pozostają zatrzymane w profazie I tylko po to, by szybko zakończyć mejozę I przed owulacją .
Leptoten
W pierwszym etapie profazy I, leptotenu (z greckiego „delikatny”), chromosomy zaczynają się kondensować. Każdy chromosom jest w haploidalnym i składa się z dwóch siostrzanych chromatyd ; jednak chromatyna siostrzanych chromatyd nie jest jeszcze wystarczająco skondensowana, aby można ją było rozdzielić w mikroskopie . Homologiczne regiony w homologicznych parach chromosomów zaczynają się ze sobą kojarzyć.
zygoten
W drugiej fazie profazy I, zygotenu (z greckiego „koniugacja”), wszystkie chromosomy pochodzące od matki i ojca znalazły swojego homologicznego partnera. Homologiczne pary przechodzą następnie synapsę, proces, w którym kompleks synaptonemalny (struktura białkowa) dopasowuje odpowiednie regiony informacji genetycznej na matczynych i ojcowskich niesiostrzanych chromatydach homologicznych par chromosomów . Sparowany homologiczny chromosom związany przez kompleks synaptonemalny nazywane są biwalentami lub tetradami. Chromosomy płciowe (X i Y) nie ulegają pełnej synapsie, ponieważ tylko niewielki region chromosomów jest homologiczny.
Jąderko przesuwa się z pozycji centralnej do obwodowej w jądrze .
Pachyten
Trzecia faza profazy I, pachyten (z greckiego „gruby”), rozpoczyna się wraz z zakończeniem synapsis. Chromatyna skondensowała się na tyle, że chromosomy można teraz rozdzielić pod mikroskopem . Na kompleksie synaptonemalnym biwalentów tworzą się struktury zwane guzkami rekombinacyjnymi . Te guzki rekombinacyjne ułatwiają wymianę genetyczną między niesiostrzanymi chromatydami kompleksu synaptonemalnego w przypadku znanym jako crossing-over lub rekombinacji genetycznej. Na każdym biwalencie może wystąpić wiele zdarzeń rekombinacji. U ludzi na każdym chromosomie zachodzą średnio 2-3 zdarzenia.
diploten
W czwartej fazie profazy I, diplotene (z greckiego „podwójny”), przejście jest zakończone. Chromosomy homologiczne zachowują pełny zestaw informacji genetycznych; jednak homologiczne chromosomy mają teraz mieszane pochodzenie matczyne i ojcowskie. Widoczne połączenia zwane chiasmata utrzymują homologiczne chromosomy razem w miejscach, w których zachodziła rekombinacja, gdy kompleks synaptonemalny rozpuszcza się. Na tym etapie u wielu gatunków następuje zatrzymanie mejozy .
Diakineza
W piątej i ostatniej fazie profazy I, diakineza (z greckiego „podwójny ruch”), nastąpiła pełna kondensacja chromatyny i wszystkie cztery chromatydy siostrzane można zobaczyć w biwalentach pod mikroskopem . Reszta fazy przypomina wczesne stadia prometafazy mitotycznej , ponieważ profaza mejotyczna kończy się, gdy zaczyna się formować aparat wrzeciona , a błona jądrowa zaczyna się rozpadać.
Profaza II
Profaza II mejozy jest bardzo podobna do profazy mitozy . Najbardziej zauważalną różnicą jest to, że profaza II występuje z haploidalną liczbą chromosomów , w przeciwieństwie do liczby diploidalnej w profazie mitotycznej. Zarówno w zwierzęcych , jak i roślinnych chromosomy mogą ulegać dekondensacji podczas telofazy I, co wymaga ich ponownej kondensacji w profazie II. Jeśli chromosomy nie muszą się ponownie kondensować, profaza II często przebiega bardzo szybko, jak widać w organizmie modelowym Arabidopsis .
Aresztować profazę
Samice ssaków i ptaków rodzą się z wszystkimi oocytami potrzebnymi do przyszłej owulacji, a te oocyty są zatrzymywane w profazie I stadium mejozy . Na przykład u ludzi oocyty powstają między trzecim a czwartym miesiącem ciąży w obrębie płodu i dlatego są obecne przy urodzeniu. Podczas tej profazy I stadium zatrzymania ( dictyate ), które może trwać przez dziesięciolecia, w oocytach obecne są cztery kopie genomu . Adaptacyjne znaczenie zatrzymania profazy I nadal nie jest w pełni zrozumiałe. Zaproponowano jednak, że zatrzymanie oocty na etapie czterech kopii genomu może zapewnić redundancję informacyjną potrzebną do naprawy uszkodzeń w DNA linii zarodkowej . Stosowany proces naprawy wydaje się być homologiczną naprawą rekombinacyjną Oocyty zatrzymane przez profazę mają wysoką zdolność do skutecznej naprawy uszkodzeń DNA . Wydaje się, że zdolność naprawy DNA jest kluczowym mechanizmem kontroli jakości w żeńskiej linii zarodkowej i krytycznym wyznacznikiem płodności .
Różnice w profazie komórek roślinnych i zwierzęcych
Najbardziej zauważalna różnica między profazą w komórkach roślinnych i zwierzęcych występuje, ponieważ komórkom roślinnym brakuje centrioli . Organizacja aparatu wrzeciona jest natomiast związana z ogniskami na przeciwległych biegunach komórki lub pośredniczą w niej chromosomy. Inną godną uwagi różnicą jest preprofaza , dodatkowy etap mitozy roślin , w wyniku którego powstaje prążek preprofazy , struktura złożona z mikrotubul . w mitozie profazie I roślin, to pasmo zanika.
Punkty kontrolne komórek
Profaza I w mejozie jest najbardziej złożoną iteracją profazy, która występuje zarówno w komórkach roślinnych , jak i zwierzęcych . Aby zapewnić prawidłowe parowanie homologicznych chromosomów i rekombinację materiału genetycznego , istnieją komórkowe punkty kontrolne . Sieć mejotycznych punktów kontrolnych to na uszkodzenia DNA , który kontroluje naprawę pęknięć podwójnej nici , strukturę chromatyny oraz ruch i parowanie chromosomów . System składa się z wielu szlaków (w tym punktu kontrolnego rekombinacji mejotycznej ), które uniemożliwiają komórce wejście do metafazy I z błędami wynikającymi z rekombinacji.
Zobacz też
- ^ ab Nussbaum RL, McInnes RR, Huntington F (2016). Thompson & Thompson Genetyka w medycynie . Filadelfia: Elsevier . s. 12–20. ISBN 9781437706963 .
- ^ a b c Schermelleh L, Carlton PM, Haase S, Shao L, Winoto L, Kner P i in. (czerwiec 2008). „Wielokolorowe obrazowanie subdyfrakcyjne peryferii jądrowych za pomocą mikroskopii z oświetleniem strukturalnym 3D” . nauka . 320 (5881): 1332–36. Bibcode : 2008Sci...320.1332S . doi : 10.1126/science.1156947 . PMC 2916659 . PMID 18535242 .
- Bibliografia _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ Genetyka Od genów do genomów . Nowy Jork: McGraw-Hill. s. 90–103 . ISBN 978-0-07-284846-5 .
- ^ a b c Singh RJ (2017). Cytogenetyka roślin (wyd. Trzecie). Boca Raton, Floryda: CBC Press, Taylor & Francis Group. P. 19. ISBN 9781439884188 .
- ^ Wang HC, Kao KN (1988). „G-pasma w chromosomach roślinnych”. Genom . 30 : 48–51. doi : 10.1139/g88-009 – przez ResearchGate.
- ^ Kakeda K, Yamagata H, Fukui K, Ohno M, Fukui K, Wei ZZ, Zhu ES (sierpień 1990). „Wysokiej rozdzielczości prążki w chromosomach kukurydzy metodami pasm G”. Genetyka teoretyczna i stosowana . 80 (2): 265–72. doi : 10.1007/BF00224397 . PMID 24220906 . S2CID 6600449 .
- ^ Pathak S, Hsu TC (styczeń 1979). „Struktury zabarwione srebrem w profazie mejotycznej ssaków”. chromosom . 70 (2): 195–203. doi : 10.1007/bf00288406 . PMID 85512 . S2CID 27763957 .
- ^ Sumner AT (maj 1982). „Natura i mechanizmy pasmowania chromosomów”. Genetyka raka i cytogenetyka . 6 (1): 59–87. doi : 10.1016/0165-4608(82)90022-x . PMID 7049353 .
- ^ de Jong H (grudzień 2003). „Wizualizacja domen i sekwencji DNA za pomocą mikroskopii: pięćdziesiąt lat historii cytogenetyki molekularnej”. Genom . 46 (6): 943-6. doi : 10.1139/g03-107 . PMID 14663510 .
- ^ a b c d e f g hi j k Taiz L, Zeiger E, Moller IM, Murphy A (2015). Fizjologia i rozwój roślin . Sunderland MA: Sinauer Associates. s. 35–39. ISBN 978-1-60535-255-8 .
- ^ ab Zeng XL, Jiao MD, Wang XG , Song ZX, Rao S (2001). „Badania mikroskopowe elektronowe nad zabarwionym srebrem cyklem jądrowym Physarum polycephalum” (PDF) . Acta Botanica Sinica . 43 (7): 680–5. Zarchiwizowane od oryginału (PDF) w dniu 01.10.2018 . Źródło 24 lutego 2015 r .
- ^ a b c d e f g Nussbaum RL, McInnes RR, Willard HF (2016). Thompson & Thompson Genetyka w medycynie . Filadelfia: Elsevier. s. 12–20. ISBN 978-1-4377-0696-3 .
- ^ a b c d e f Alberts B, Bray D, Hopkin K, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2004). Podstawowa biologia komórki . New York NY: Garland Science. s. 639–658 . ISBN 978-0-8153-3481-1 .
- ^ Zickler D, Kleckner N (1998). „Przejście mejozy leptoten-zygoten”. Roczny przegląd genetyki . 32 : 619–97. doi : 10.1146/annurev.genet.32.1.619 . PMID 9928494 .
- ^ abc ) . Mira A (wrzesień 1998 „Dlaczego zatrzymano mejozę?”. Dziennik biologii teoretycznej . 194 (2): 275–87. Bibcode : 1998JThBi.194..275M . doi : 10.1006/jtbi.1998.0761 . PMID 9778439 .
- ^ a b c Stringer JM, Winship A, Zerafa N, Wakefield M, Hutt K (maj 2020). „Oocyty mogą skutecznie naprawiać pęknięcia podwójnej nici DNA, aby przywrócić integralność genetyczną i chronić zdrowie potomstwa” . Proceedings of the National Academy of Sciences of the United States of America . 117 (21): 11513–11522. doi : 10.1073/pnas.2001124117 . PMC 7260990 . PMID 32381741 .
- ^ Hochwagen A, Amon A (marzec 2006). „Sprawdzanie przerw: mechanizmy nadzoru rekombinacji mejotycznej” . Bieżąca biologia . 16 (6): R217-28. doi : 10.1016/j.cub.2006.03.009 . PMID 16546077 .
- ^ MacQueen AJ, Hochwagen A (lipiec 2011). „Mechanizmy punktów kontrolnych: marionetkowi mistrzowie profazy mejotycznej”. Trendy w biologii komórki . 21 (7): 393–400. doi : 10.1016/j.tcb.2011.03.004 . PMID 21531561 .
Linki zewnętrzne
-
 Media związane z Profase w Wikimedia Commons
Media związane z Profase w Wikimedia Commons