Centromer

Centromer łączy ze sobą parę siostrzanych chromatyd podczas podziału komórki. Ten zwężony region chromosomu łączy siostrzane chromatydy, tworząc krótkie ramię (p) i długie ramię (q) na chromatydach. Podczas mitozy włókna wrzeciona przyczepiają się do centromeru za pośrednictwem kinetochoru .
Fizyczną rolą centromeru jest działanie jako miejsce montażu kinetochorów – wysoce złożonej wielobiałkowej struktury odpowiedzialnej za rzeczywiste zdarzenia segregacji chromosomów – tj. wiązanie mikrotubul i sygnalizowanie maszynerii cyklu komórkowego, kiedy wszystkie chromosomy przyjęły prawidłowe przyczepy do wrzeciona , dzięki czemu podziały komórkowe mogą przebiegać do końca i aby komórki mogły wejść w anafazę .
Ogólnie rzecz biorąc, istnieją dwa rodzaje centromerów. „Centromery punktowe” wiążą się ze specyficznymi białkami , które z dużą skutecznością rozpoznają określone sekwencje DNA . Każdy fragment DNA z punktową sekwencją centromeru DNA zazwyczaj tworzy centromer, jeśli występuje u odpowiedniego gatunku. Najlepiej scharakteryzowane centromery punktowe to centromery pączkujących drożdży Saccharomyces cerevisiae . „Regionalne centromery” to termin ukuty w celu opisania większości centromerów, które zwykle tworzą się w regionach preferowanej sekwencji DNA, ale mogą również tworzyć się w innych sekwencjach DNA. Sygnał do powstania regionalnego centromeru wydaje się być epigenetyczny . Większość organizmów, od drożdży rozszczepiających Schizosaccharomyces pombe po ludzi, ma regionalne centromery.
Jeśli chodzi o strukturę chromosomu mitotycznego, centromery reprezentują zwężony region chromosomu (często określany jako pierwotne zwężenie), w którym dwie identyczne chromatydy siostrzane są w najbliższym kontakcie. Kiedy komórki wchodzą w mitozę, siostrzane chromatydy (dwie kopie każdej cząsteczki chromosomalnego DNA powstałe w wyniku replikacji DNA w postaci chromatyny) są łączone wzdłuż swojej długości przez działanie kompleksu kohezyny . Obecnie uważa się, że kompleks ten jest głównie uwalniany z ramion chromosomów podczas profazy, tak że zanim chromosomy ustawią się w linii środkowej wrzeciona mitotycznego (znanego również jako płytka metafazowa), ostatnie miejsce, w którym są połączone ze sobą znajduje się w chromatynie w centromerze i wokół niego.
Pozycja
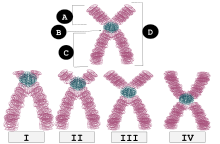
| I | telocentryczny | Umieszczenie centromeru bardzo blisko szczytu, ramiona p ledwo widoczne, jeśli w ogóle widoczne. |
| II | Akrocentryczny | Ramiona q są nadal znacznie dłuższe niż ramiona p, ale ramiona p są dłuższe niż ramiona telocentryczne. |
| III | Submetacentryczny | Ramiona p i q mają bardzo zbliżoną długość, ale nie są sobie równe. |
| IV | Metacentryczny | ramiona p i q są równej długości. |
A : Ramię krótkie (ramię p) B : Centromer C : Ramię długie (ramię q) D : Chromatydy siostrzane
U ludzi pozycje centromeru definiują kariotyp chromosomalny , w którym każdy chromosom ma dwa ramiona, p (krótsze z dwóch) i q (dłuższe). Podobno krótkie ramię „p” pochodzi od francuskiego słowa „petit” oznaczającego „mały”. Położenie centromeru względem dowolnego chromosomu liniowego służy do klasyfikacji chromosomów jako metacentrycznych, submetacentrycznych, akrocentrycznych, telocentrycznych lub holocentrycznych.
| Kategoryzacja chromosomów według względnej długości ramion | ||||||
| Pozycja centromeru | Stosunek długości ramion | Podpisać | Opis | |||
| Środkowe sensu stricto | 1,0 – 1,6 | M | Metacentryczny | |||
| Region środkowy | 1.7 | M | Metacentryczny | |||
| podśrodkowy | 3.0 | sm | Submetacentryczny | |||
| podterminalny | 3,1 – 6,9 | ul | Subtelocentryczny | |||
| Region terminala | 7.0 | T | Akrocentryczny | |||
| Terminal sensu stricto | ∞ | T | telocentryczny | |||
| Notatki | – | Metacentryczny : M + m | Atelocentryczny : M + m + sm + st + t | |||
Metacentryczny
Metacentryczny oznacza, że centromer znajduje się w połowie odległości między końcami chromosomów, co powoduje, że ramiona są mniej więcej równej długości. Kiedy centromery są metacentryczne, chromosomy wydają się mieć „kształt litery X”.
Submetacentryczny
Submetacentryczny oznacza, że centromer jest umieszczony poniżej środka, z jednym ramieniem chromosomu krótszym od drugiego, co często skutkuje kształtem litery L.
Akrocentryczny
Centromer akrocentrycznego chromosomu jest położony w taki sposób, że jedno z ramion chromosomu jest znacznie krótsze od drugiego. „Akro-” w akrocentrycznym odnosi się do greckiego słowa oznaczającego „szczyt”. Ludzki genom zawiera sześć chromosomów akrocentrycznych. Pięć autosomalnych chromosomów akrocentrycznych: 13 , 14 , 15 , 21 , 22 ; a chromosom Y jest również akrocentryczny.
Krótkie akrocentryczne ramiona P zawierają niewiele materiału genetycznego i mogą być translokowane bez znaczącej szkody, jak w zrównoważonej translokacji robertsonowskiej . Oprócz niektórych genów kodujących białka, ludzkie akrocentryczne ramiona p zawierają również regiony organizatora Nucleolus (NOR), z których transkrybowany jest rybosomalny RNA . Jednak część akrocentrycznych ramion P w liniach komórkowych i tkankach od zdrowych dawców ludzkich nie zawiera wykrywalnych NOR. Genom konia domowego zawiera jeden chromosom metacentryczny, który jest homologiczny do dwóch chromosomów akrocentrycznych u tego samego gatunku , ale nieudomowionego konia Przewalskiego . Może to odzwierciedlać albo utrwalenie zrównoważonej translokacji robertsonowskiej u koni domowych, albo odwrotnie, utrwalenie rozszczepienia jednego chromosomu metacentrycznego na dwa chromosomy akrocentryczne u koni Przewalskiego. Podobna sytuacja występuje między genomami człowieka i małpy człekokształtnej, z redukcją dwóch chromosomów akrocentrycznych u małp człekokształtnych do jednego chromosomu metacentrycznego u ludzi (patrz aneuploidia i chromosom ludzki 2 ).
Wiele chorób wynikających z niezrównoważonych translokacji częściej obejmuje chromosomy akrocentryczne niż inne chromosomy nieakrocentryczne. Chromosomy akrocentryczne są zwykle zlokalizowane w jąderku i wokół niego . W rezultacie te chromosomy są zwykle mniej gęsto upakowane niż chromosomy na peryferiach jądra. Konsekwentnie regiony chromosomalne, które są mniej gęsto upakowane, są również bardziej podatne na translokacje chromosomalne w nowotworach.
telocentryczny
Chromosomy telocentryczne mają centromer na jednym końcu chromosomu i dlatego wykazują tylko jedno ramię na poziomie cytologicznym (mikroskopowym). Nie występują u ludzi, ale mogą powstawać w wyniku błędów chromosomów komórkowych. Chromosomy telocentryczne występują naturalnie u wielu gatunków, takich jak mysz domowa , u której wszystkie chromosomy oprócz chromosomu Y są telocentryczne.
Subtelocentryczny
Centromery chromosomów subtelocentrycznych znajdują się między środkiem a końcem chromosomów, ale bliżej końca chromosomów.
Rodzaje centromerów
acentryczny
Chromosom acentryczny to fragment chromosomu pozbawiony centromeru. Ponieważ centromery są punktem mocowania włókien wrzeciona podczas podziału komórki, fragmenty acentryczne nie są równomiernie rozprowadzane do komórek potomnych podczas podziału komórki. W rezultacie komórce potomnej zabraknie acentrycznego fragmentu i mogą wystąpić szkodliwe konsekwencje.
Zdarzenia łamiące chromosomy mogą również generować acentryczne chromosomy lub acentryczne fragmenty.
dicentryczny
Chromosom dicentryczny to nieprawidłowy chromosom z dwoma centromerami, który może być niestabilny w wyniku podziałów komórkowych. Może powstawać w wyniku translokacji lub fuzji dwóch segmentów chromosomów, z których każdy ma centromer. Niektóre rearanżacje tworzą zarówno chromosomy dicentryczne, jak i fragmenty acentryczne, które nie mogą przyczepiać się do wrzecion podczas mitozy. Powstawanie chromosomów dicentrycznych przypisuje się procesom genetycznym, takim jak translokacja Robertsona i inwersja paracentryczna. Chromosomy dicentryczne mogą mieć różne losy, w tym stabilność mitotyczną. W niektórych przypadkach ich stabilność wynika z inaktywacji jednego z dwóch centromerów w celu utworzenia funkcjonalnie monocentrycznego chromosomu zdolnego do normalnej transmisji do komórek potomnych podczas podziału komórki. [1]
Monocentryczny
Chromosom monocentryczny to chromosom, który ma tylko jeden centromer w chromosomie i tworzy wąskie przewężenie.
Centromery monocentryczne są najpowszechniejszą strukturą wysoce powtarzalnego DNA u roślin i zwierząt.
Holocentryczny
W przeciwieństwie do chromosomów monocentrycznych, chromosomy holocentryczne nie mają wyraźnego pierwotnego zwężenia, gdy patrzy się na mitozę. Zamiast tego włókna wrzeciona przyczepiają się wzdłuż prawie całej (greckie: holo-) długości chromosomu. W chromosomach holocentrycznych białka centromerowe, takie jak CENPA (CenH3), są rozmieszczone na całym chromosomie. Nicień, Caenorhabditis elegans , jest dobrze znanym przykładem organizmu z holocentrycznymi chromosomami, ale ten typ centromeru można znaleźć u różnych gatunków, roślin i zwierząt, wśród eukariontów. Holocentromery składają się w rzeczywistości z wielu rozproszonych jednostek centromerów, które podczas mitozy tworzą liniową strukturę wzdłuż chromosomów. Podczas mejozy stosuje się alternatywne lub niekonwencjonalne strategie w celu uzyskania parowania i segregacji homologicznych chromosomów potrzebnych do wytworzenia żywotnych gamet lub gametofitów do rozmnażania płciowego.
U różnych gatunków występują różne typy holocentromerów, mianowicie z centromerowymi powtarzalnymi sekwencjami DNA lub bez nich oraz z CenH3 lub bez . Holocentryczność ewoluowała co najmniej 13 razy niezależnie u różnych zielonych alg, pierwotniaków, bezkręgowców i różnych rodzin roślin. W przeciwieństwie do gatunków monocentrycznych, w których fragmenty acentryczne zwykle giną podczas podziału komórki, pęknięcie chromosomów holocentrycznych tworzy fragmenty z normalnymi miejscami przyczepu włókien wrzeciona. Z tego powodu organizmy z chromosomami holocentrycznymi mogą szybciej ewoluować zmienność kariotypu, zdolne do leczenia pofragmentowanych chromosomów poprzez późniejsze dodawanie czapeczek telomerowych w miejscach pęknięcia.
Policentryczny
Ludzkie chromosomy

| Chromosom |
centromeru ( Mbp ) |
Kategoria |
chromosomu (Mbp) |
centromeru (Mbp) |
|---|---|---|---|---|
| 1 | 125,0 | metacentryczny | 247,2 | 7.4 |
| 2 | 93,3 | submetacentryczny | 242,8 | 6.3 |
| 3 | 91,0 | metacentryczny | 199,4 | 6.0 |
| 4 | 50,4 | submetacentryczny | 191,3 | — |
| 5 | 48,4 | submetacentryczny | 180,8 | — |
| 6 | 61,0 | submetacentryczny | 170,9 | — |
| 7 | 59,9 | submetacentryczny | 158,8 | — |
| 8 | 45,6 | submetacentryczny | 146,3 | — |
| 9 | 49,0 | submetacentryczny | 140,4 | — |
| 10 | 40.2 | submetacentryczny | 135,4 | — |
| 11 | 53,7 | submetacentryczny | 134,5 | — |
| 12 | 35,8 | submetacentryczny | 132,3 | — |
| 13 | 17,9 | akrocentryczny | 114,1 | — |
| 14 | 17.6 | akrocentryczny | 106,3 | — |
| 15 | 19.0 | akrocentryczny | 100,3 | — |
| 16 | 36,6 | metacentryczny | 88,8 | — |
| 17 | 24.0 | submetacentryczny | 78,7 | — |
| 18 | 17.2 | submetacentryczny | 76.1 | — |
| 19 | 26,5 | metacentryczny | 63,8 | — |
| 20 | 27,5 | metacentryczny | 62,4 | — |
| 21 | 13.2 | akrocentryczny | 46,9 | — |
| 22 | 14.7 | akrocentryczny | 49,5 | — |
| X | 60,6 | submetacentryczny | 154,9 | — |
| Y | 12,5 | akrocentryczny | 57,7 | — |
Na podstawie cech mikrograficznych wielkości, położenia centromeru, a czasem obecności satelity chromosomu , ludzkie chromosomy dzielą się na następujące grupy:
| Grupa | Chromosomy | Cechy |
|---|---|---|
| grupa A | Chromosom 1-3 | Duże, metacentryczne i submetacentryczne |
| Grupa B | Chromosom 4-5 | Duży, submetacentryczny |
| Grupa C | Chromosom 6-12, X | Średniej wielkości, submetacentryczny |
| Grupa D | Chromosom 13-15 | Średniej wielkości, akrocentryczny, z satelitą |
| Grupa E | Chromosom 16-18 | Małe, metacentryczne i submetacentryczne |
| Grupa F | Chromosom 19-20 | Bardzo mały, metacentryczny |
| Grupa G | Chromosom 21-22, Y | Bardzo mały, akrocentryczny, z satelitą |
Sekwencja
Istnieją dwa rodzaje centromerów. W regionalnych centromerach DNA przyczyniają się do funkcji, ale ich nie definiują. Regionalne centromery zawierają duże ilości DNA i często są upakowane w heterochromatynie . U większości eukariotów sekwencja DNA centromeru składa się z dużych macierzy powtarzalnego DNA (np. DNA satelitarnego ), gdzie sekwencja w obrębie poszczególnych powtarzających się elementów jest podobna, ale nie identyczna. U ludzi podstawowa jednostka powtórzeń centromerowych nazywana jest α-satelitą (lub alphoidem), chociaż w tym regionie znajduje się wiele innych typów sekwencji. Satelity centromerowe szybko ewoluują między gatunkami, a analizy dzikich myszy pokazują, że liczba kopii satelitarnych i heterogeniczność odnosi się do pochodzenia populacji i podgatunków. Ponadto chów wsobny może wpływać na sekwencje satelitów.
Centromery punktowe są mniejsze i bardziej zwarte. Sekwencje DNA są zarówno niezbędne, jak i wystarczające do określenia tożsamości i funkcji centromeru w organizmach z centromerami punktowymi. U pączkujących drożdży region centromeru jest stosunkowo mały (około 125 pz DNA) i zawiera dwie wysoce konserwatywne sekwencje DNA, które służą jako miejsca wiązania niezbędnych kinetochoru .
Dziedzictwo
Ponieważ centromerowa sekwencja DNA nie jest kluczowym wyznacznikiem tożsamości centromerowej u metazoanów , uważa się, że dziedziczenie epigenetyczne odgrywa główną rolę w określaniu centromeru. Chromosomy potomne będą gromadzić centromery w tym samym miejscu co chromosom rodzicielski, niezależnie od sekwencji. Zaproponowano, że wariant histonu H3 CENP-A (Centromere Protein A) jest epigenetycznym znakiem centromeru. Powstaje pytanie, czy musi istnieć jeszcze jakiś oryginalny sposób określania centromeru, nawet jeśli jest on następnie propagowany epigenetycznie. Jeśli centromer jest dziedziczony epigenetycznie z pokolenia na pokolenie, problem cofa się do pochodzenia pierwszych metazoanów.
Z drugiej strony, dzięki porównaniu centromerów w chromosomach X, w tych regionach zaobserwowano zmiany epigenetyczne i strukturalne. Ponadto niedawny montaż ludzkiego genomu wykrył możliwy mechanizm ewolucji struktur pericentromerycznych i centromerowych, poprzez warstwowy model ekspansji sekwencji αSat. Model ten sugeruje, że różne powtórzenia sekwencji αSat pojawiają się okresowo i rozszerzają się w aktywnym wektorze, wypierając stare sekwencje i stając się miejscem składania kinetochoru. αSat może pochodzić z tego samego lub różnych wektorów. Ponieważ proces ten powtarza się w czasie, warstwy otaczające aktywny centromer kurczą się i niszczą. Proces ten rodzi pytania o związek między tym dynamicznym procesem ewolucyjnym a pozycją centromeru.
Struktura
Centromerowy DNA jest normalnie w stanie heterochromatyny , który jest niezbędny do rekrutacji kompleksu kohezyny , który pośredniczy w kohezji siostrzanej chromatydy po replikacji DNA, jak również koordynuje rozdzielanie siostrzanej chromatydy podczas anafazy. W tej chromatynie normalny histon H3 jest zastąpiony wariantem specyficznym dla centromeru, CENP-A u ludzi. Uważa się, że obecność CENP-A jest ważna dla montażu kinetochoru na centromerze. Wykazano, że CENP-C lokalizuje się prawie wyłącznie w tych regionach chromatyny związanej z CENP-A. Stwierdzono, że w komórkach ludzkich histony są najbardziej wzbogacone w H4K20me 3 i H3K9me3 , które są znanymi modyfikacjami heterochromatycznymi. U Drosophila wyspy retroelementów są głównymi składnikami centromerów.
U drożdży Schizosaccharomyces pombe (i prawdopodobnie u innych eukariotów) tworzenie centromerowej heterochromatyny jest związane z RNAi . U nicieni, takich jak Caenorhabditis elegans , niektóre rośliny i owady z rzędu Lepidoptera i Hemiptera, chromosomy są „holocentryczne”, co wskazuje, że nie ma pierwotnego miejsca przyczepów mikrotubul ani pierwotnego zwężenia, a „rozproszony” kinetochor gromadzi się wzdłuż całego długość chromosomu.
Aberracje centromerowe
W rzadkich przypadkach neocentromery mogą tworzyć się w nowych miejscach na chromosomie w wyniku zmiany położenia centromeru. Zjawisko to jest najlepiej znane z badań klinicznych na ludziach i obecnie istnieje ponad 90 znanych ludzkich neocentromerów zidentyfikowanych na 20 różnych chromosomach. Tworzenie neocentromeru musi być połączone z inaktywacją poprzedniego centromeru, ponieważ chromosomy z dwoma funkcjonalnymi centromerami ( chromosom dicentryczny ) spowodują pęknięcie chromosomu podczas mitozy. W niektórych nietypowych przypadkach zaobserwowano, że ludzkie neocentromery tworzą się spontanicznie na pofragmentowanych chromosomach. Niektóre z tych nowych pozycji były pierwotnie euchromatyczne i całkowicie pozbawione satelitarnego DNA alfa. Neocentromerom brakuje powtarzalnej struktury obserwowanej w normalnych centromerach, co sugeruje, że tworzenie centromerów jest kontrolowane głównie epigenetycznie . Z biegiem czasu neocentrom może gromadzić powtarzające się elementy i dojrzewać do tak zwanego ewolucyjnego nowego centromeru. Istnieje kilka dobrze znanych przykładów w chromosomach naczelnych, w których pozycja centromeru różni się od ludzkiego centromeru tego samego chromosomu i uważa się, że są to ewolucyjne nowe centromery. Sugeruje się, że zmiana położenia centromerów i tworzenie ewolucyjnych nowych centromerów jest mechanizmem specjacji .
Białka centromerowe są również autoantygenicznym celem dla niektórych przeciwciał przeciwjądrowych , takich jak przeciwciała przeciw centromerom .
Dysfunkcja i choroba
Wiadomo, że nieprawidłowa regulacja centromeru przyczynia się do błędnej segregacji chromosomów, co jest silnie związane z rakiem i poronieniami. Warto zauważyć, że nadekspresję wielu genów centromerowych powiązano z fenotypami złośliwych nowotworów. Nadekspresja tych genów centromerowych może zwiększać niestabilność genomową w nowotworach. Podwyższona niestabilność genomowa z jednej strony odnosi się do fenotypów złośliwych; z drugiej strony czyni komórki nowotworowe bardziej podatnymi na specyficzne terapie uzupełniające, takie jak niektóre chemioterapie i radioterapia. Niestabilność powtarzalnego DNA centromeru została niedawno wykazana w przypadku raka i starzenia.
Naprawa centromerowego DNA
Kiedy pęknięcia DNA występują w centromerach w fazie G1 cyklu komórkowego , komórki są w stanie rekrutować homologiczną rekombinacyjną maszynerię naprawczą do uszkodzonego miejsca, nawet przy braku chromatydy siostrzanej . Wydaje się, że homologiczna naprawa rekombinacyjna może zachodzić w przerwach centromerowych w całym cyklu komórkowym, aby zapobiec aktywacji niedokładnych mutagennych szlaków naprawy DNA i zachować integralność centromerową.
Etymologia i wymowa
Słowo centromer ( / kombinację s ɛ n t r ə ˌ m ɪər / ) wykorzystuje form centro- . i -mere , dając „środkową część”, opisującą położenie centromeru w środku chromosomu
Zobacz też
Dalsza lektura
- Mehta GD, poseł Agarwal, Ghosh SK (sierpień 2010). „Tożsamość centromeru: wyzwanie, z którym należy się zmierzyć”. Genetyka molekularna i genomika . 284 (2): 75–94. doi : 10.1007/s00438-010-0553-4 . PMID 20585957 . S2CID 24881938 .
- Lodish H, Berk A, Kaiser CA, Kaiser C, Krieger M, Scott MP, Bretscher A, Ploegh H, Matsudaira (2008). Biologia komórki molekularnej (wyd. 6). Nowy Jork: WH Freeman. ISBN 978-0-7167-7601-7 .
- Nagaki K, Cheng Z, Ouyang S, Talbert PB, Kim M, Jones KM i in. (luty 2004). „Sekwencjonowanie centromeru ryżu odkrywa aktywne geny” . Genetyka przyrody . 36 (2): 138–145. doi : 10.1038/ng1289 . PMID 14716315 .
Linki zewnętrzne
- „Centromer ryżu, rzekomo cicha domena genetyczna, niespodzianki” . ScienceDaily (Informacja prasowa). 13 stycznia 2004.