Nukleoporyna
| Nukleoporyna 133/155, terminal N | |||||||||
|---|---|---|---|---|---|---|---|---|---|
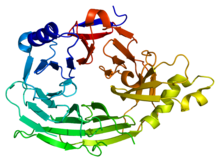 Ta domena ma 7-łopatową strukturę śmigła beta (PDB 1XKS).
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Nukleoporyna_N | ||||||||
| Pfam | PF08801 | ||||||||
| InterPro | IPR014908 | ||||||||
| SCOP2 | 1XKS / ZAKRES / SUPFAM | ||||||||
| |||||||||
| Nukleoporyna 133/155, C terminal (ACE2) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
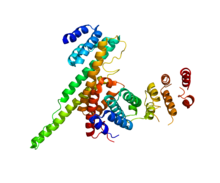 NUP133 (ta domena; po prawej) oddziałująca z NUP107 (PDB 3CQC).
| |||||||||||
| Identyfikatory | |||||||||||
| Symbol | Nukleoporyna_C | ||||||||||
| Pfam | PF03177 | ||||||||||
| InterPro | IPR007187 | ||||||||||
| |||||||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| powtórzeń FG | |||||||||
| Symbol | Nukleoporyna_FG | ||||||||
| Pfam | PF13634 | ||||||||
| Klan Pfam | CL0647 | ||||||||
| InterPro | IPR025574 | ||||||||
| |||||||||
Nukleoporyny to rodzina białek, które są budulcem kompleksu porów jądrowych (NPC). Kompleks porów jądrowych to masywna struktura osadzona w otoczce jądrowej w miejscach, w których wewnętrzna i zewnętrzna błona jądrowa łączą się, tworząc bramę, która reguluje przepływ makrocząsteczek między jądrem komórkowym a cytoplazmą . Pory jądrowe umożliwiają pasywny i ułatwiony transport cząsteczek przez otoczkę jądrową. Nukleoporyny, rodzina około 30 białek, są głównymi składnikami porów jądrowych w komórkach eukariotycznych . Najobficiej występującym członkiem tej rodziny jest nukleoporyna 62 . Nukleoporyny są w stanie przenosić cząsteczki przez otoczkę jądrową z bardzo dużą szybkością. Pojedynczy NPC jest w stanie w ciągu minuty przetransportować 60 000 cząsteczek białka przez otoczkę jądrową.
Struktura
Nukleoporyny łączą się, tworząc kompleks porów jądrowych , ośmiokątny pierścień przechodzący przez otoczkę jądrową. Pierścień składa się z ośmiu podkompleksów rusztowania, z dwiema strukturalnymi warstwami COPII , które otaczają niektóre białka wyściełające pory. Od cytoplazmy do nukleoplazmy, trzy warstwy kompleksu pierścieniowego nazywane są odpowiednio cytoplazmą, porami wewnętrznymi i pierścieniami nukleoplazmy. Różne zestawy białek łączą się na każdym pierścieniu, a niektóre białka transbłonowe zakotwiczają zespół w dwuwarstwie lipidowej.
W podkompleksie rusztowania zarówno cytoplazma, jak i pierścienie nukleoplazmy składają się z kompleksów Y, kompleksu białkowego zbudowanego między innymi z NUP133 i NUP107. Na każdym końcu każdego z ośmiu rusztowań znajdują się dwa kompleksy Y, co daje do 32 kompleksów na por. Związek krzywizny błony porów jądrowych z kompleksami Y można postrzegać jako analogiczny do tworzenia pączków pęcherzyka pokrytego COPII. Białka wyściełające pory wewnętrzne tworzą kompleks NUP62.
Po stronie nukleoplazmy dodatkowe białka związane z pierścieniem tworzą „koszyk jądrowy”, kompleks zdolny do przywiązania nukleoporyny do blaszki jądrowej, a nawet do określonych części genomu. Koniec cytoplazmatyczny jest mniej skomplikowany, z ośmioma włóknami wystającymi do cytoplazmy. Wydaje się, że nie odgrywają żadnej roli w imporcie broni jądrowej.
Niektóre nukleoporyny zawierają powtórzenia FG . Nazwane na cześć fenyloalaniny i glicyny , powtórzenia FG to małe hydrofobowe segmenty, które rozbijają długie odcinki hydrofilowych aminokwasów. Te elastyczne części tworzą się rozłożone lub nieuporządkowane segmenty bez stałej struktury. Tworzą masę łańcuchów, które umożliwiają dyfuzję mniejszym cząsteczkom, ale wykluczają duże hydrofilowe makrocząsteczki. Te duże cząsteczki są w stanie przekroczyć pory jądrowe tylko wtedy, gdy towarzyszy im cząsteczka sygnałowa, która tymczasowo oddziałuje z powtórzonym segmentem FG nukleoporyny. Nukleoporyny FG zawierają również kulistą część, która służy jako kotwica do przyłączenia do kompleksu porów jądrowych.
Nukleoporyny błonowe łączą się zarówno z rusztowaniem, jak i z błoną jądrową. Niektóre z nich, jak GP210 , przechodzą przez całą membranę, inne (jak NUP98 ) działają jak gwoździe z elementami konstrukcyjnymi podszewki, jak również części wbijające się w membranę. Wcześniej uważano, że NUP98 jest nukleoporyną FG, dopóki nie wykazano, że „FG” w nim występuje ma zwinięty fałd.
Wykazano, że nukleoporyny tworzą ze sobą różne podkompleksy. Najpopularniejszym z tych kompleksów jest kompleks nup62, który jest zespołem składającym się z NUP62 , NUP58, NUP54 i NUP45. Innym przykładem takiego kompleksu jest kompleks Y (NUP107-160), złożony z wielu różnych nukleoporyn. Kompleks NUP107-160 został zlokalizowany w kinetochorach i odgrywa rolę w mitozie .
Ewolucja
Wiele strukturalnych nukleoporyn zawiera solenoidowe domeny białkowe , domeny składające się z powtórzeń, które można układać razem jako duże bloki budulcowe. Istnieją beta-śmigła z podobieństwami do powtórzeń WD40 i, co ciekawsze, unikalne typy powtórzeń solenoidów alfa (wiązek helis), które tworzą własną klasę, przodków elementów powłokowych (ACE). Do tej pory zidentyfikowano dwie klasy ACE. ACE1 to domena o 28 helisach występująca w wielu nukleoproteinach rusztowania, jak również w SEC31 , składnik COPII. ACE2, pokazany w infoboksie, znajduje się w drożdżach Nup157/Nup170 (ludzki Nup155) i Nup133. W obu przypadkach wspólne domeny, jak sugerują ich nazwy, wskazują na wspólne pochodzenie zarówno w obrębie nukleoprotein, jak i między nukleoproteinami a cotamerami.
Wszystkie żyjące eukarioty dzielą wiele ważnych składników NPC, co wskazuje, że u ich wspólnego przodka obecny jest kompletny kompleks.
Funkcjonować
Nukleoporyny pośredniczą w transporcie makrocząsteczek między jądrem komórkowym a cytoplazmą u eukariontów . Pewni członkowie rodziny nukleoporyn tworzą strukturalne rusztowanie kompleksu porów jądrowych . Jednak nukleoporyny działają głównie poprzez interakcję z cząsteczkami transportowymi znanymi jako karioferyny . Te karioferyny oddziałują z nukleoporynami, które zawierają powtarzające się sekwencje aminokwasów fenyloalaniny ( F) i glicyny (G) (powtórzenia FG). W ten sposób karioferyny są w stanie przenosić swój ładunek przez otoczkę jądrową. Nukleoporyny są wymagane tylko do transportu dużych cząsteczek hydrofilowych powyżej 40 kDa, ponieważ mniejsze cząsteczki przechodzą przez pory jądrowe na drodze biernej dyfuzji . Nukleoporyny odgrywają ważną rolę w transporcie mRNA z jądra do cytoplazmy po transkrypcji . W zależności od ich funkcji, niektóre nukleoporyny są zlokalizowane po cytozolowej lub nukleoplazmatycznej stronie kompleksu porów jądrowych. Inne nukleoporyny można znaleźć po obu stronach. Niedawno wykazano, że nukleoporyny FG mają specyficzne ewolucyjnie zachowane cechy zakodowane w ich sekwencjach, które zapewniają wgląd w sposób, w jaki regulują transport cząsteczek przez kompleks porów jądrowych.
Mechanizm transportu
Nukleoporyny regulują transport makrocząsteczek przez otoczkę jądrową poprzez interakcje z cząsteczkami transportującymi karioferyny . Karyoferyny będą wiązać się ze swoim ładunkiem i odwracalnie oddziaływać z powtórzeniami FG w nukleoporynach. Karyoferyny i ich ładunek są przepuszczane między powtórzeniami FG, dopóki nie dyfuzują w dół swojego gradientu stężeń i przez kompleks porów jądrowych. Karyoferyny mogą służyć jako importyny (transportujące białka do jądra) lub eksportyny ( transportujące białka z jądra). Karyoferyny uwalniają swój ładunek napędzany przez Ran , białko G. Ran jest na tyle mały, że może dyfundować przez pory jądrowe w dół swojego gradientu stężenia bez interakcji z nukleoporynami. Ran wiąże się z GTP lub GDP i ma zdolność zmiany powinowactwa karioferyny do jej ładunku. Wewnątrz jądra RanGTP powoduje zmianę konformacji importowanej karioferyny, umożliwiając uwolnienie jej ładunku. RanGTP może również wiązać się z eksportynami karioferyn i przechodzić przez pory jądrowe. Po dotarciu do cytosolu, RanGTP może ulec hydrolizie do RanGDP, umożliwiając uwolnienie ładunku eksportu.
Patologia
Kilka chorób zostało powiązanych z patologiami nukleoporyn, zwłaszcza cukrzyca , pierwotna marskość żółciowa wątroby , choroba Parkinsona i choroba Alzheimera . Wykazano również, że nadekspresja genów kodujących różne nukleoporyny jest związana z powstawaniem guzów nowotworowych .
Wykazano, że nukleoporyny są bardzo wrażliwe na zmiany stężenia glukozy . Dlatego osoby dotknięte cukrzycą często wykazują zwiększoną glikozylację nukleoporyn, zwłaszcza nukleoporyny 62 .
autoimmunologiczne , takie jak przeciwciała anty-p62 , które hamują kompleksy p62, mają związek z pierwotną marskością żółciową , która niszczy drogi żółciowe wątroby.
Zmniejszenie wytwarzania kompleksu p62 jest wspólne dla wielu chorób neurodegeneracyjnych . Modyfikacja promotora p62 przez utlenianie jest skorelowana z chorobą Alzheimera , chorobą Huntingtona i chorobą Parkinsona wśród innych zaburzeń neurodegeneracyjnych.
Zwiększona ekspresja genu NUP88 , który koduje nukleoporynę 88, jest powszechnie obserwowana w dysplazjach przedrakowych i nowotworach złośliwych .
Aladyna białkowa nukleoporyny jest składnikiem kompleksu porów jądrowych . Mutacje w genie aladyny są odpowiedzialne za zespół potrójnego A , autosomalną recesywną chorobę neuroendokrynologiczną . Zmutowana aladyna powoduje selektywną niewydolność importu białek jądrowych i nadwrażliwość na stres oksydacyjny . Import białek naprawy DNA aprataksyny i ligazy DNA I DNA komórki na uszkodzenia wywołane stresem oksydacyjnym , które powodują śmierć komórki.
Przykłady
Każda pojedyncza nukleoporyna jest nazywana zgodnie z jej masą cząsteczkową (w kilodaltonach ). Poniżej znajduje się kilka przykładów białek z rodziny nukleoporyn:
- NUP35 , NUP37 , NUP43 , NUP50
- NUP54 , NUP62 , NUP85 , NUP88 , NUP93 , NUP98
- NUP107 , NUP133 , NUP153 , NUP155 , NUP160 , NUP188
- NUP205 , NUP210 , NUP214
Linki zewnętrzne
- Nukleoporyna w US National Library of Medicine Medical Subject Headings (MeSH)
- Nukleoporyna (wyszukiwanie InterPro)