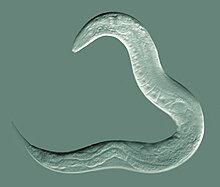
Caenorhabditis elegans

|
|
| Caenorhabditis elegans | |
|---|---|
| Dorosły hermafrodyta C. elegans robak | |
| Klasyfikacja naukowa | |
| Królestwo: | Animalia |
| Gromada: | nicienie |
| Klasa: | Chromadorea |
| Zamówienie: | Rhabditida |
| Rodzina: | Rhabditidae |
| Rodzaj: | Caenorhabditis |
| Gatunek: |
C. elegancja
|
| Nazwa dwumianowa | |
|
Caenorhabditis elegans ( Maupas , 1900)
|
|
| podgatunki | |
Caenorhabditis elegans ( / ˌ s iː n oʊ r æ b d aɪ t ə s około 1 mm, który ɛ l ə ɡ ć n s / ) to wolno żyjący przezroczysty nicień o długości żyje w umiarkowanych środowiskach glebowych. Jest to gatunek typowy w swoim rodzaju. Nazwa jest mieszanką greckich caeno- (niedawny), rhabditis (podobny do pręta) i łacińskiego elegans (elegancki). W 1900 roku Maupas początkowo nazwał ją Rhabditides elegans. Osche umieścił go w podrodzaju Caenorhabditis w 1952, aw 1955 Dougherty podniósł Caenorhabditis do rangi rodzaju .
C. elegans jest niesegmentowanym pseudocelomatem i nie ma układu oddechowego ani krążenia. Większość z tych nicieni to hermafrodyty , a kilka to samce. Samce mają wyspecjalizowane ogony do krycia, które zawierają drzazgi .
W 1963 roku Sydney Brenner zaproponował badania C. elegans, głównie w obszarze rozwoju neuronów. W 1974 roku rozpoczął badania nad molekularną i biologią rozwojową C. elegans , która od tego czasu jest szeroko stosowana jako organizm modelowy . Był to pierwszy organizm wielokomórkowy , którego cały genom został zsekwencjonowany , a od 2019 roku jest jedynym organizmem, którego konektom (schemat połączeń neuronowych) został ukończony.
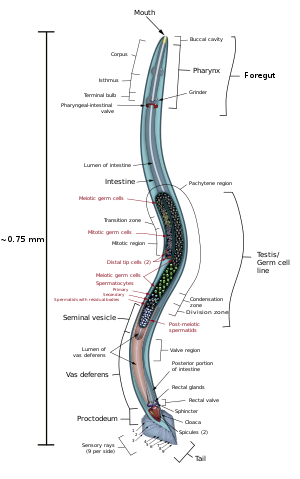
Anatomia
C. elegans jest niesegmentowany , robakowaty i obustronnie symetryczny . Ma naskórek (twardą powłokę zewnętrzną, jako egzoszkielet ), cztery główne sznury naskórka i wypełnioną płynem rzekomą komorę (jamę ciała). Ma również niektóre z tych samych układów narządów, co większe zwierzęta. Około jeden na tysiąc osobników to mężczyzna, a reszta to hermafrodyty. Podstawowa anatomia C. elegans obejmuje jamę ustną, gardło , jelito , gonadę i naskórek kolagenowy . Jak wszystkie nicienie nie mają układu krążenia ani układu oddechowego. Cztery pasma mięśni biegnące wzdłuż ciała są połączone z układem nerwowym, który umożliwia mięśniom poruszanie ciałem zwierzęcia tylko jako zginanie grzbietowe lub brzuszne, ale nie w lewo ani w prawo, z wyjątkiem głowy, gdzie cztery mięśnie ćwiartki są połączone niezależnie od siebie. Kiedy fala skurczów mięśni grzbietowych/brzusznych przechodzi od tyłu do przodu zwierzęcia, zwierzę jest odpychane do tyłu. Kiedy fala skurczów rozpoczyna się z przodu i przechodzi do tyłu wzdłuż ciała, zwierzę jest wypychane do przodu. Ze względu na to grzbietowe / brzuszne odchylenie w zgięciach ciała, każdy normalnie żyjący, poruszający się osobnik ma tendencję do leżenia na lewym lub prawym boku, gdy obserwuje się go przekraczającego poziomą powierzchnię. Uważa się, że zestaw grzbietów po bokach naskórka ciała, alae, zapewnia zwierzęciu dodatkową przyczepność podczas tych ruchów zginających.
W odniesieniu do metabolizmu lipidów, C. elegans nie posiada żadnych wyspecjalizowanych tkanek tłuszczowych, trzustki , wątroby , a nawet krwi dostarczającej składniki odżywcze w porównaniu do ssaków. Zamiast tego neutralne lipidy są przechowywane w jelicie, naskórku i zarodkach. Naskórek odpowiada adipocytom ssaków, będąc głównym magazynem triglicerydów .
Gardło jest mięśniową pompą pokarmową w głowie C. elegans , która ma trójkątny przekrój poprzeczny. To rozdrabnia pokarm i transportuje go bezpośrednio do jelita. Zestaw „komórek zastawki” łączy gardło z jelitem, ale sposób działania tej zastawki nie jest zrozumiały. Po strawieniu zawartość jelita jest wydalana przez odbyt, podobnie jak w przypadku wszystkich innych nicieni. Nie istnieje bezpośrednie połączenie między gardłem a wydalniczym , którego funkcją jest uwalnianie płynnego moczu.
Samce mają gonadę jednopłatową, nasieniowód i ogon wyspecjalizowany do krycia, który zawiera drzazgi . Hermafrodyty mają dwa jajniki , jajowody i spermatekę oraz jedną macicę .
C. elegans zawierają dendryty, które rozciągają się od komórki, aby odbierać neuroprzekaźniki, oraz proces , który rozciąga się do pierścienia nerwowego („mózgu”) w celu połączenia synaptycznego między neuronami. Największą różnicą jest to, że C. elegans ma motoryczne neurony pobudzające i hamujące, znane jako neurony cholinergiczne i gabaergiczne , które po prostu działają jako dodatkowa regulacja dla tego maleńkiego stworzenia. Nie mają żadnego wpływu na układ nerwowy poza regulacją impulsów neuronalnych.
Granulki jelitowe
W jelicie C. elegans obecne są liczne ziarnistości jelitowe, których funkcje wciąż nie są w pełni poznane, podobnie jak wiele innych aspektów tego nicienia, pomimo wielu lat jego badań. Te granulki jelitowe znajdują się we wszystkich rzędach Rhabditida. Są bardzo podobne do lizosomów , ponieważ mają kwaśne wnętrze i zdolność do endocytozy , ale są znacznie większe, co wzmacnia pogląd, że są organellami magazynującymi. Niezwykłą cechą granulek jest to, że gdy są obserwowane w świetle ultrafioletowym , reagują emitując intensywną niebieską fluorescencję . Innym obserwowanym zjawiskiem jest „fluorescencja śmierci”. Gdy robaki umierają, emitowany jest dramatyczny wybuch niebieskiej fluorescencji. Ta śmiertelna fluorescencja zwykle ma miejsce w przedniej i tylnej fali, która porusza się wzdłuż jelita i jest obserwowana zarówno u młodych, jak i starych robaków, niezależnie od tego, czy zostały poddane śmiertelnemu urazowi, czy spokojnie umierają ze starości.
Na temat funkcji granulek jelitowych wysunięto wiele teorii, przy czym wcześniejsze odkrycia zostały wyeliminowane przez późniejsze odkrycia. Uważa się, że przechowują cynk jako jedną ze swoich funkcji. Niedawna analiza chemiczna zidentyfikowała niebieski materiał fluorescencyjny, który zawierają, jako glikozylowaną postać kwasu antranilowego (AA). Zapotrzebowanie na duże ilości AA, które zawiera wiele granulek jelitowych, jest kwestionowane. Jedną z możliwości jest to, że AA jest antybakteryjny i używany w obronie przed inwazją patogenów. Inną możliwością jest to, że granulki zapewniają fotoochronę; wybuchy fluorescencji AA pociągają za sobą konwersję szkodliwego światła UV na stosunkowo nieszkodliwe światło widzialne. Jest to postrzegane jako możliwy związek z melanosomami zawierającymi melaninę .
Reprodukcja
Robak hermafrodytyczny jest uważany za wyspecjalizowaną formę samopłodnej samicy, ponieważ jego soma jest samicą. Hermafrodytyczna linia zarodkowa najpierw wytwarza gamety męskie , a po zapłodnieniu wewnętrznym składa jaja przez macicę. Hermafrodyty produkują wszystkie swoje plemniki w stadium L4 (150 plemników na ramię gonady), a następnie produkują tylko oocyty . Gonada hermafrodytyczna działa jak ovotestis, a plemniki są przechowywane w tym samym obszarze gonady co oocyty, dopóki pierwszy oocyt nie wepchnie plemnika do spermateki ( komory , w której oocyty zostają zapłodnione przez plemnik).
Samiec może zapłodnić hermafrodytę, który preferencyjnie wykorzysta plemniki samca (oba rodzaje plemników są przechowywane w spermatece).
Plemniki C. elegans są ameboidalne, pozbawione wici i akrosomów . Po samozapłodnieniu robak typu dzikiego składa około 300 jaj. Po zapłodnieniu przez samca liczba potomstwa może przekroczyć 1000. Hermafrodyty zazwyczaj nie łączą się w pary z innymi hermafrodytami. W temperaturze 20 ° C szczep laboratoryjny C. elegans (N2) ma średnią długość życia około 2–3 tygodni i czas generacji od 3 do 4 dni.
C. elegans ma pięć par autosomów i jedną parę chromosomów płciowych . Płeć w C. elegans jest oparta na systemie determinacji płci X0 . Hermafrodyty C. elegans mają dopasowaną parę chromosomów płciowych (XX); rzadkie samce mają tylko jeden chromosom płciowy (X0).
Determinacja seksualna
C. elegans to w większości organizmy hermafrodytyczne, produkujące zarówno plemniki, jak i oocyty . Samce występują w populacji w przybliżeniu 1 na 200 hermafrodytów, ale obie płci są bardzo zróżnicowane. Samce różnią się od swoich hermafrodytycznych odpowiedników tym, że są mniejsze i można je rozpoznać po kształcie ogona. C.elegans rozmnażają się w procesie zwanym androdioecy . Oznacza to, że mogą rozmnażać się na dwa sposoby: albo przez samozapłodnienie u hermafrodytów, albo przez rozmnażanie się hermafrodytów z samcami. Samce powstają w wyniku niedysjunkcji chromosomów X podczas mejozy. Robaki, które rozmnażają się poprzez samozapłodnienie, są narażone na wysoki poziom nierównowagi sprzężeń, co prowadzi do zmniejszenia różnorodności genetycznej w populacjach i wzrostu akumulacji szkodliwych alleli . U C. elegans determinację płci somatycznej przypisuje się genowi tra-1 . Tra -1 to gen w obrębie szlaku determinacji płci czynnika transkrypcyjnego TRA-1, który jest regulowany potranskrypcyjnie i działa poprzez promowanie rozwoju kobiet. U hermafrodytów (XX) występuje wysoki poziom tra-1 , która wytwarza żeński układ rozrodczy i hamuje rozwój samców. W pewnym momencie ich cyklu życiowego, jeden dzień przed dorosłością, hermafrodyty można zidentyfikować poprzez dodanie sromu w pobliżu ogona. U samców (XO) występuje niski poziom tra-1 , co skutkuje męskim układem rozrodczym. Ostatnie badania wykazały, że istnieją trzy inne geny, fem-1, fem-2 i fem-3, które negatywnie regulują szlak TRA-1 i działają jako ostateczny determinant płci u C. elegans .
Ewolucja
System determinacji płci u C. elegans to temat, który od lat interesuje naukowców. Ponieważ są używane jako organizmy modelowe, wszelkie odkryte informacje na temat sposobu, w jaki ich system determinacji płci mógł ewoluować, mogą pomóc w tych samych badaniach biologii ewolucyjnej w innych organizmach. Po prawie 30 latach badań naukowcy zaczęli składać elementy ewolucji takiego systemu. Odkryli, że istnieje złożona ścieżka, która obejmuje kilka warstw regulacji. Blisko spokrewniony organizm Caenorhabditis briggsae był szeroko badany, a cała sekwencja jego genomu pomogła połączyć brakujące elementy w ewolucji determinacji płci C. elegans . Odkryto, że zasymilowały się dwa geny, co doprowadziło do tego, że białka XOL-1 i MIX-1 mają wpływ na determinację płci również u C. elegans . Mutacje w szlaku XOL-1 prowadzą do feminizacji u C. elegans. Wiadomo, że gen mix-1 powoduje hipoaktywację chromosomu X i reguluje morfologię męskiego ogona u C. elegans. Patrząc na nicienie jako całość, płeć męska i hermafrodyta prawdopodobnie wyewoluowały z ewolucji równoległej. Ewolucję równoległą definiuje się jako podobne cechy ewoluujące od przodka w podobnych warunkach; Mówiąc najprościej, oba gatunki ewoluują w podobny sposób w czasie. Przykładem tego mogą być torbacze i ssaki łożyskowe . Naukowcy postawili również hipotezę, że bezpłciowe hermafrodyty lub „samozapylenie” mogło ewoluować konwergentnie, badając gatunki podobne do C. elegans . Inne badania nad ewolucją determinacji płci sugerują, że geny obejmujące plemniki ewoluują szybciej niż geny żeńskie. Jednak geny plemników na chromosomie X mają zmniejszone tempo ewolucji. Geny plemników mają krótkie sekwencje kodujące, duże odchylenia kodonów i nieproporcjonalną reprezentację wśród genów sierocych. Te cechy genów plemników mogą być przyczyną ich wysokiego tempa ewolucji, a także mogą sugerować, w jaki sposób geny plemników wyewoluowały z robaków obojnaczych. Ogólnie rzecz biorąc, naukowcy mają ogólne pojęcie o ścieżce determinacji płci u C. elegans , jednak ewolucja tego, jak powstała ta ścieżka, nie jest jeszcze dobrze zdefiniowana.
Rozwój
Rozwój zarodkowy
Zapłodniona zygota ulega obrotowemu cięciu holoblastycznemu .
Wejście plemnika do komórki jajowej rozpoczyna tworzenie osi przednio-tylnej. Ośrodek organizacji mikrotubul plemników kieruje ruchem przedjądrza plemnika do przyszłego tylnego bieguna zarodka, jednocześnie pobudzając ruch białek PAR , grupy cytoplazmatycznych czynników determinujących, do odpowiednich miejsc. W wyniku różnicy w dystrybucji białek PAR pierwszy podział komórki jest wysoce asymetryczny . Embriogeneza C. elegans jest jednym z najlepiej poznanych przykładów asymetrycznego podziału komórek.
Wszystkie komórki linii zarodkowej powstają z pojedynczej pierwotnej komórki zarodkowej , zwanej komórką P4 , powstałej na wczesnym etapie embriogenezy . Ta pierwotna komórka dzieli się, tworząc dwa prekursory linii zarodkowej, które dzielą się dalej dopiero po wykluciu.
Formacja osi
Powstałe komórki potomne pierwszego podziału komórkowego nazywane są komórkami AB (zawierającymi PAR-6 i PAR-3) i komórkami P1 (zawierającymi PAR-1 i PAR-2). Drugi podział komórkowy wytwarza komórki ABp i ABa z komórki AB oraz komórki EMS i P2 z komórki P1. Podział ten ustanawia oś grzbietowo-brzuszną, przy czym komórka ABp tworzy stronę grzbietową, a komórka EMS wyznacza stronę brzuszną. Poprzez sygnalizację Wnt komórka P2 instruuje komórkę EMS, aby podzieliła się wzdłuż osi przednio-tylnej. Poprzez sygnalizację Notch komórka P2 różnie określa komórki ABp i ABa, co dodatkowo definiuje oś grzbietowo-brzuszną. Oś lewa-prawa również staje się widoczna na wczesnym etapie embriogenezy, chociaż nie jest jasne, kiedy dokładnie określa się oś. Jednak większość teorii rozwoju osi LR obejmuje pewne różnice w komórkach pochodzących z komórki AB.
Gastrulacja
Gastrulacja następuje po osiągnięciu przez zarodek stadium 24 komórek. C. elegans to gatunek protostomów , więc blastopor ostatecznie tworzy usta. Inwolucja do blastoporu rozpoczyna się od ruchu endodermy i późniejszego tworzenia jelita, po którym następuje prekursor linii zarodkowej P4, a na koniec komórki mezodermy , w tym komórki, które ostatecznie tworzą gardło. Gastrulacja kończy się, gdy epibolia hipoblastów zamyka blastopor.
Rozwój postembrionalny
W warunkach środowiskowych sprzyjających rozmnażaniu wyklute larwy rozwijają się przez cztery stadia larwalne – L1, L2, L3 i L4 – w ciągu zaledwie 3 dni w temperaturze 20°C. W stresowych warunkach, takich jak niedobór pożywienia, nadmierne zagęszczenie populacji lub wysoka temperatura, C. elegans może wejść w alternatywne trzecie stadium larwalne, L2d, zwane stadium dauer ( Dauer to po niemiecku stałe). Specyficzny feromon dauer reguluje wejście w stan dauer. Ten feromon składa się z podobnych pochodnych 3,6-dideoksycukru, asskarylozy. Askarozydy, nazwane na cześć zasady askarylozy, biorą udział w wielu zachowaniach specyficznych dla płci i społecznych. W ten sposób tworzą język chemiczny, którego C. elegans używa do modulowania różnych fenotypów. Larwy Dauera są odporne na stres; są chude, a ich usta są zamknięte charakterystycznym naskórkiem dauera i nie mogą przyjmować pokarmu. Mogą pozostać na tym etapie przez kilka miesięcy. Etap kończy się, gdy poprawiają się warunki sprzyjające dalszemu wzrostowi larwy, która przechodzi teraz do stadium L4, mimo że rozwój gonad zostaje zatrzymany na etapie L2.
Każde przejście etapowe jest przerywane wylinką przezroczystego naskórka robaka. Przejścia przez te etapy są kontrolowane przez geny szlaku heterochronicznego, ewolucyjnie konserwowany zestaw czynników regulacyjnych. Wiele heterochronicznych genów koduje mikroRNA , które hamują ekspresję heterochronicznych czynników transkrypcyjnych i innych heterochronicznych miRNA. miRNA zostały pierwotnie odkryte w C. elegans. Ważne zdarzenia rozwojowe kontrolowane przez geny heterochroniczne obejmują podział i ostateczną syncytalną fuzję komórek szwu podskórnego oraz ich późniejsze wydzielanie alae u młodych dorosłych. Uważa się, że ścieżka heterochroniczna reprezentuje ewolucyjnie zachowanego poprzednika zegarów okołodobowych .
Niektóre nicienie mają ustaloną, genetycznie określoną liczbę komórek, co jest zjawiskiem znanym jako eutely . Dorosły C. elegans ma 959 komórek somatycznych, a samiec 1033, chociaż sugeruje się, że liczba ich komórek jelitowych może wzrosnąć od jednego do trzech w odpowiedzi na drobnoustroje jelitowe doświadczane przez matki. Znaczna część literatury opisuje liczbę komórek u samców jako 1031, ale odkrycie pary lewych i prawych neuronów MCM zwiększyło tę liczbę o dwa w 2015 r. Liczba komórek nie zmienia się po ustaniu podziału komórki na końcu larwy okresie, a późniejszy wzrost wynika wyłącznie ze wzrostu wielkości poszczególnych komórek.
Ekologia
Różne gatunki Caenorhabditis zamieszkują różne środowiska bogate w składniki odżywcze i bakterie. Żywią się bakteriami, które rozwijają się w rozkładającej się materii organicznej ( mikrobivory ). W glebie brakuje wystarczającej ilości materii organicznej, aby utrzymać samowystarczalne populacje. C. elegans może przetrwać na diecie składającej się z różnych bakterii, ale jego dzika ekologia jest w dużej mierze nieznana. Większość szczepów laboratoryjnych pochodziła ze sztucznych środowisk, takich jak ogrody i stosy kompostu . Niedawno stwierdzono , że C. elegans rozwija się w innych rodzajach materii organicznej, zwłaszcza w gnijących owocach. C. elegans może również wykorzystywać różne gatunki drożdży , w tym Cryptococcus laurentii i C. kuetzingii , jako jedyne źródła pożywienia. Chociaż C. elegans jest bakteriożercą , może zostać zabita przez wiele bakterii chorobotwórczych, w tym patogeny ludzkie, takie jak Staphylococcus aureus , Pseudomonas aeruginosa , Salmonella enterica lub Enterococcus faecalis . Bakterie chorobotwórcze mogą również tworzyć biofilmy, których lepka matryca egzopolimerowa może utrudniać C. elegans i ukrywać chemoatraktanty wykrywające kworum bakteryjne przed wykryciem drapieżników.
Bezkręgowce, takie jak krocionogi , owady , równonogi i ślimaki , mogą przenosić larwy dauer w różne odpowiednie miejsca. Widziano również, jak larwy żywią się żywicielami, gdy umierają. Nicienie mogą przetrwać wysychanie , a u C. elegans wykazano, że mechanizmem tej zdolności są białka obfitujące w późną embriogenezę . C. elegans , podobnie jak inne nicienie, może być zjadana przez nicienie drapieżne i inne wszystkożerne, w tym niektóre owady.
Wirus Orsay jest wirusem, który atakuje C. elegans , podobnie jak wirus Caenorhabditis elegans Cer1 i wirus Caenorhabditis elegans Cer13 .
- Interakcje z grzybami
Dzikie izolaty Caenorhabditis elegans są regularnie wykrywane z infekcjami grzybów Microsporidia . Jeden z takich gatunków, Nematocida parisii , namnaża się w jelitach C. elegans .
Arthrobotrys oligospora jest organizmem modelowym dla interakcji między grzybami a nicieniami. Jest to najczęstszy i najbardziej rozpowszechniony grzyb przechwytujący nicienie.
Użyj jako organizm modelowy
W 1963 roku Sydney Brenner zaproponował wykorzystanie C. elegans jako organizmu modelowego do badania głównie rozwoju neuronów u zwierząt. Jest to jeden z najprostszych organizmów z układem nerwowym . Neurony nie wyzwalają potencjałów czynnościowych i nie wyrażają żadnych bramkowanych napięciem kanałów sodowych . U hermafrodyty system ten składa się z 302 neuronów , których wzór został kompleksowo zmapowany w tak zwanym konektomie i okazał się siecią małego świata .
W badaniach zbadano mechanizmy neuronalne i molekularne, które kontrolują kilka zachowań C. elegans , w tym chemotaksję , termotaksję , mechanotransdukcję , uczenie się , pamięć i zachowania godowe . W 2019 roku opublikowano konektom samca przy użyciu techniki innej niż ta stosowana w przypadku hermafrodyty. W tym samym artykule wykorzystano nową technikę do ponownego wykonania konektomu hermafrodyty, znajdując 1500 nowych synaps.
Został wykorzystany jako organizm modelowy do badania mechanizmów molekularnych w chorobach metabolicznych. Brenner również ją wybrał, ponieważ jest łatwa w uprawie w dużych populacjach i wygodna do analizy genetycznej. Jest to wielokomórkowy organizm eukariotyczny , ale na tyle prosty, że można go szczegółowo badać. Przezroczystość C. elegans ułatwia badanie różnicowania komórek i innych procesów rozwojowych w nienaruszonym organizmie. Spikule u samca wyraźnie odróżniają samce od samic. Szczepy są tanie w hodowli i można je zamrozić. Po późniejszym rozmrożeniu zachowują żywotność, umożliwiając długoterminowe przechowywanie. Konserwacja jest łatwa w porównaniu z innymi wielokomórkowymi organizmami modelowymi. Kilkaset nicieni może być trzymanych na jednej płytce agarowej i odpowiedniej pożywce wzrostowej. Brenner opisał zastosowanie mutanta E. coli – OP50. OP50 jest uracylu , a jego niedobór w płytce uniemożliwia namnażanie się bakterii, które przesłaniałyby robaki. Stosowanie OP50 nie wymaga żadnych poważnych środków bezpieczeństwa w laboratorium, ponieważ jest niepatogenne i łatwo hoduje się w podłożu Luria-Bertani (LB) przez noc.
Mapowanie linii komórkowych
Zmapowano los rozwojowy każdej pojedynczej komórki somatycznej (959 u dorosłego hermafrodyty; 1031 u dorosłego mężczyzny). Te wzorce linii komórkowej są w dużej mierze niezmienne między osobnikami, podczas gdy u ssaków rozwój komórek jest bardziej zależny od sygnałów komórkowych z zarodka.
Jak wspomniano wcześniej, pierwsze podziały komórkowe wczesnej embriogenezy u C. elegans należą do najlepiej poznanych przykładów asymetrycznych podziałów komórkowych , a robak jest bardzo popularnym systemem modelowym do badania biologii rozwoju.
Zaprogramowana śmierć komórki
Zaprogramowana śmierć komórki ( apoptoza ) eliminuje wiele dodatkowych komórek (131 u hermafrodyty, z których większość w przeciwnym razie stałaby się neuronami ); ta „przewidywalność apoptozy” przyczyniła się do wyjaśnienia niektórych genów apoptozy . Zidentyfikowano geny sprzyjające śmierci komórkowej i pojedynczy inhibitor śmierci komórkowej.
Interferencja RNA i wyciszanie genów
Interferencja RNA (RNAi) jest stosunkowo prostą metodą zakłócania funkcji określonych genów. Wyciszenie funkcji genu może czasami pozwolić badaczowi na wywnioskowanie jego możliwej funkcji. Nicienie mogą być moczone, wstrzykiwane lub karmione genetycznie transformowanymi bakteriami, które wykazują ekspresję dwuniciowego RNA będącego przedmiotem zainteresowania, którego sekwencja uzupełnia sekwencję genu, który badacz chce wyłączyć. RNAi stało się potężnym narzędziem w badaniu genomiki funkcjonalnej. C. elegans został wykorzystany do analizy funkcji genów i obiecujących przyszłych odkryć w systematycznych interakcjach genetycznych.
Środowiskowa absorpcja RNAi jest znacznie gorsza u innych gatunków robaków z rodzaju Caenorhabditis . Chociaż wstrzyknięcie RNA do jamy ciała zwierzęcia indukuje wyciszenie genów u większości gatunków, tylko C. elegans i kilka innych daleko spokrewnionych nicieni może pobierać RNA z bakterii, które jedzą dla RNAi. Zdolność ta została zmapowana do pojedynczego genu, sid-2 , który wprowadzony jako transgen do innych gatunków, pozwala im pobierać RNA dla RNAi, tak jak robi to C. elegans .
Podział komórki i cykl komórkowy
Badania nad mejozą zostały znacznie uproszczone, ponieważ każde jądro komórki rozrodczej znajduje się w tej samej pozycji, gdy porusza się w dół gonady, a więc znajduje się na tym samym etapie mejozy. We wczesnej fazie mejozy oocyty stają się niezwykle odporne na promieniowanie, a odporność ta zależy od ekspresji genów rad51 i atm , które odgrywają kluczową rolę w naprawie rekombinacyjnej. Gen mre-11 odgrywa również kluczową rolę w rekombinacyjnej naprawie uszkodzeń DNA podczas mejozy. Badanie częstotliwości krzyżowania się w populacjach naturalnych wykazało, że samozapylenie jest dominującym sposobem rozmnażania się C. elegans , ale rzadkie przypadki krzyżowania się występują z częstością około 1%. Jest mało prawdopodobne, aby mejozy, które powodują samozapylenie, znacząco przyczyniły się do korzystnej zmienności genetycznej, ale te mejozy mogą zapewnić korzyści adaptacyjne w postaci rekombinacyjnej naprawy uszkodzeń DNA, które powstają, zwłaszcza w stresujących warunkach.
Nadużywanie narkotyków i uzależnienia
Uzależnienie od nikotyny można również badać za pomocą C. elegans, ponieważ wykazuje reakcje behawioralne na nikotynę, które są podobne do reakcji ssaków. Reakcje te obejmują ostrą reakcję, tolerancję, wycofanie i uczulenie.
Biologiczne bazy danych
Jeśli chodzi o większość organizmów modelowych, naukowcy pracujący w terenie tworzą dedykowaną internetową bazę danych, a WormBase jest przeznaczony dla C. elegans . WormBase próbuje zebrać wszystkie opublikowane informacje na temat C. elegans i innych pokrewnych nicieni. Ich strona internetowa ogłosiła nagrodę w wysokości 4000 dolarów dla odkrywcy nowego gatunku blisko spokrewnionego nicienia. Takie odkrycie poszerzyłoby możliwości badawcze z robakiem.
Starzenie się
C. elegans jest organizmem modelowym do badań nad starzeniem się ; na przykład wykazano , że hamowanie szlaku sygnałowego insulinopodobnego czynnika wzrostu trzykrotnie zwiększa długość życia dorosłych; podczas gdy karmienie glukozą sprzyja stresowi oksydacyjnemu i skraca dorosłe życie o połowę. Podobnie indukowana degradacja receptora insuliny/IGF-1 w późnym okresie życia radykalnie wydłużyła oczekiwaną długość życia robaków. długowieczne mutanty C. elegans są odporne na stres oksydacyjny i promieniowanie UV . Te długowieczne mutanty miały większą naprawy DNA niż C. elegans typu dzikiego . Powalenie naprawy wycinania nukleotydów Xpa-1 zwiększyło wrażliwość na promieniowanie UV i skróciło długość życia długowiecznych mutantów. Odkrycia te wskazują, że zdolność do naprawy DNA leży u podstaw długowieczności .
Zdolność do naprawy uszkodzeń DNA w procesie naprawy wycinania nukleotydów zmniejsza się wraz z wiekiem.
C. elegans wystawiony na działanie 5 mM chlorku litu (LiCl) wykazał wydłużony okres życia. Po wystawieniu na działanie 10 μM LiCl zaobserwowano zmniejszoną śmiertelność, ale nie przy 1 μM.
C. elegans odegrała kluczową rolę w identyfikacji funkcji genów zaangażowanych w chorobę Alzheimera , takich jak presenilina . Co więcej, szeroko zakrojone badania nad C. elegans wykazały, że białka wiążące RNA są istotnymi czynnikami podczas rozwoju linii zarodkowej i wczesnego zarodka.
Telomery , których długość, jak wykazano, koreluje ze zwiększoną długością życia i opóźnionym starzeniem się wielu organizmów, od C. elegans po ludzi, wykazują interesujące zachowanie u C. elegans. Podczas gdy C. elegans utrzymuje swoje telomery w kanoniczny sposób, podobnie jak inne eukarionty, w przeciwieństwie do tego Drosophila melanogaster jest godna uwagi w używaniu retrotranspozonów do utrzymania swoich telomerów podczas nokautu katalitycznej podjednostki telomerazy ( trt-1 ) C. elegans mogą zyskać zdolność alternatywnego wydłużania telomerów (ALT). C. elegans był pierwszym eukariontem, który uzyskał funkcjonalność ALT po nokaucie kanonicznego szlaku telomerazy . ALT obserwuje się również w około 10-15% wszystkich klinicznych nowotworów. Tak więc C. elegans jest głównym kandydatem do badań nad ALT. Bayat i in. wykazali paradoksalne skrócenie telomerów podczas nadekspresji trt-1 , co prowadziło do niemal bezpłodności , podczas gdy robaki wykazywały nawet niewielki wzrost długości życia, pomimo skrócenia telomerów.
Spać
C. elegans wyróżnia się w badaniach snu na zwierzętach jako najbardziej prymitywny organizm wykazujący stany przypominające sen. U C. elegans faza letargu występuje na krótko przed każdym pierzeniem . Wykazano również, że C. elegans śpi po ekspozycji na stres fizyczny, w tym szok termiczny, promieniowanie UV i toksyny bakteryjne.
Biologia sensoryczna
Chociaż robak nie ma oczu, stwierdzono, że jest wrażliwy na światło dzięki trzeciemu typowi światłoczułego białka fotoreceptora zwierzęcego , LITE-1 , które pochłania światło od 10 do 100 razy skuteczniej niż pozostałe dwa rodzaje fotopigmenty ( opsyny i kryptochromy ) występujące w królestwie zwierząt.
C. elegans jest niezwykle biegły w tolerowaniu przyspieszenia. Według genetyków z Uniwersytetu w São Paulo w Brazylii może wytrzymać ciężar 400 000 g . W eksperymencie 96% z nich nadal żyło bez skutków ubocznych po godzinie w ultrawirówce.
Badania lotów kosmicznych
C. elegans pojawił się w wiadomościach, gdy odkryto, że okazy przeżyły katastrofę promu kosmicznego Columbia w lutym 2003 r. Później, w styczniu 2009 r., ogłoszono, że żywe próbki C. elegans z University of Nottingham spędzą dwa tygodnie na Międzynarodowej Stacji Kosmicznej w październiku tego roku w projekcie badań kosmicznych mającym na celu zbadanie wpływu zerowej grawitacji na rozwój i fizjologię mięśni. Badania dotyczyły przede wszystkim genetycznego podłoża zaniku mięśni , który ma związek z lotami kosmicznymi , obłożnie chorym, geriatrycznym lub cukrzycowym . Potomkowie robaków znajdujących się na pokładzie Columbii w 2003 roku zostali wystrzeleni w kosmos na pokładzie Endeavour w ramach misji STS-134 . Dodatkowe eksperymenty dotyczące dystrofii mięśniowej podczas lotów kosmicznych będą przeprowadzane na pokładzie ISS począwszy od grudnia 2018 r. [ wymaga aktualizacji ]
Genetyka
Genom

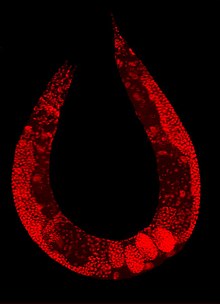
Kariotyp C. elegans
wyjaśnienie kolorów
Chromosomy mitotyczne C. elegans . DNA (czerwony)/ Kinetochory (zielony). Organizmy holocentryczne , w tym C. elegans , gromadzą rozproszone kinetochory wzdłuż całej biegunowej powierzchni każdej chromatydy siostrzanej.
| |
| Identyfikator genomu NCBI | |
|---|---|
| Ploidia | diploidalny |
| Rozmiar genomu | 101,169 Mb (haploidalny) |
| Liczba chromosomów | 5 par autosomów (I, II, III, IV i V) + 1 lub 2 chromosomy płciowe (X) |
| Rok ukończenia | 1998 |
| Sekwencja organelli | mitochondrium |
| Rozmiar organelli | 0,01 MB |
C. elegans był pierwszym organizmem wielokomórkowym, którego cały genom został zsekwencjonowany . Sekwencja została opublikowana w 1998 roku, chociaż występowały pewne niewielkie luki; ostatnia luka została ukończona do października 2002 r. [ potrzebne źródło ] W okresie poprzedzającym cały genom Konsorcjum Sekwencjonowania C. elegans / C. elegans Genome Project opublikowało kilka częściowych skanów, w tym Wilson et al. 1994.
Wielkość i zawartość genów
Genom C. elegans ma długość około 100 milionów par zasad i składa się z sześciu par chromosomów u hermafrodytów lub pięciu par autosomów z chromosomem XO u samców C. elegans i genomu mitochondrialnego . Jego gęstość genów wynosi około jednego genu na pięć kilopar zasad . Introny stanowią 26%, a regiony międzygenowe 47% genomu. Wiele genów jest ułożonych w klastry, a ile z nich to operony , nie jest jasne. C. elegans i inne nicienie należą do nielicznych eukariontów, o których obecnie wiadomo, że mają operony; należą do nich trypanosomy , płazińce (zwłaszcza trematode Schistosoma mansoni ) i prymitywny strunowiec osłonicowy Oikopleura dioica . Prawdopodobnie okaże się, że znacznie więcej organizmów ma te operony.
Genom zawiera około 20 470 genów kodujących białka . Około 35% C. elegans ma ludzkie homologi . Co ciekawe, wielokrotnie wykazano, że ludzkie geny zastępują swoje C. elegans po wprowadzeniu do C. elegans . I odwrotnie, wiele C. elegans może działać podobnie do genów ssaków.
Liczba znanych genów RNA w genomie znacznie wzrosła dzięki odkryciu w 2006 roku nowej klasy zwanej genami 21U-RNA , a obecnie uważa się, że genom zawiera ponad 16 000 genów RNA, w porównaniu z zaledwie 1300 w 2005 roku.
Kuratorzy naukowi nadal oceniają zestaw znanych genów; wciąż dodawane są nowe modele genów, a nieprawidłowe modyfikowane lub usuwane.
Referencyjna sekwencja genomu C. elegans wciąż się zmienia, ponieważ nowe dowody ujawniają błędy w pierwotnym sekwencjonowaniu. Większość zmian jest niewielka, dodając lub usuwając tylko kilka par zasad DNA. Na przykład wydanie WormBase WS202 (kwiecień 2009) dodało dwie pary zasad do sekwencji genomu. Czasami wprowadzane są bardziej rozległe zmiany, jak zauważono w wydaniu WS197 z grudnia 2008 r., W którym dodano do sekwencji region o wielkości ponad 4300 pz.
Projekt C. elegans Genome Project Wilson et al. 1994 znalazł domenę CelVav i czynnika A von Willebranda , a wraz z Wilsonem i in. 1998 dostarcza pierwszych wiarygodnych dowodów na istnienie homologu receptora węglowodorów arylowych (AHR) poza kręgowcami. 2
Powiązane genomy
określono również sekwencję genomu spokrewnionego nicienia C. briggsae , co umożliwiło naukowcom zbadanie porównawczej genomiki tych dwóch organizmów. Sekwencje genomu większej liczby nicieni z tego samego rodzaju , np. C. remanei , C. japonica i C. brenneri (nazwane na cześć Brennera), również badano przy użyciu techniki sekwencjonowania typu shotgun . Te sekwencje zostały już zakończone.
Inne badania genetyczne
Od 2014 r. C. elegans jest najbardziej podstawowym gatunkiem w grupie „Elegans” (10 gatunków) supergrupy „Elegans” (17 gatunków) w badaniach filogenetycznych. Tworzy odrębną gałąź w stosunku do innych gatunków z tej grupy.
Transpozon Tc1 jest transpozonem DNA aktywnym w C. elegans .
Społeczność naukowa
W 2002 roku Nagrodę Nobla w dziedzinie fizjologii lub medycyny otrzymali Sydney Brenner , H. Robert Horvitz i John Sulston za ich pracę nad genetyką rozwoju narządów i programowanej śmierci komórki u C. elegans . Nagrodę Nobla w dziedzinie fizjologii lub medycyny w 2006 r. otrzymali Andrew Fire i Craig C. Mello za odkrycie interferencji RNA u C. elegans . W 2008 roku Martin Chalfie otrzymał Nagrodę Nobla w dziedzinie chemii za pracę nad białkiem zielonej fluorescencji ; niektóre z badań obejmowały wykorzystanie C. elegans .
Wielu naukowców badających C. elegans blisko nawiązuje do Sydneya Brennera, z którym prawie wszystkie badania w tej dziedzinie rozpoczęły się w latach siedemdziesiątych; pracowali jako ze stopniem doktora lub podyplomowi w laboratorium Brennera lub w laboratorium kogoś, kto wcześniej pracował z Brennerem. Większość osób pracujących w jego laboratorium założyła później własne laboratoria badawcze nad robakami, tworząc w ten sposób dość dobrze udokumentowaną „linię” naukowców C. elegans , która została szczegółowo zarejestrowana w bazie danych WormBase podczas Międzynarodowego Spotkania Robaków w 2003 roku.
Zobacz też
- Testy na zwierzętach na bezkręgowcach
- Bioluminescencja
- Eileen Southgate
- Intronerator
- OpenWorm
- WormBook
Dalsza lektura
- Ptak J, Ptak AC (1991). Struktura nicieni . Prasa akademicka . s. 1, 69–70, 152–153, 165, 224–225. ISBN 978-0-12-099651-3 .
- Nadzieja, IA (1999). C. elegans : podejście praktyczne . Oxford University Press . s. 1–6. ISBN 978-0-19-963738-6 .
- Zagadka DL, Blumenthal T, Meyer RJ, Priess JR (1997). C. elegans II . Prasa laboratoryjna Cold Spring Harbor . s. 1–4, 679–683. ISBN 978-0-87969-532-3 . PMID 21413221 .
Linki zewnętrzne
- Brenner S (2002) Dar natury dla nauki. W. http://nobelprize.org/nobel_prizes/medicine/laureates/2002/brenner-lecture.pdf (również wykłady Horvitza i Sulstona)
- WormBase – obszerna internetowa baza danych obejmująca biologię i genomikę C. elegans i innych nicieni
- WormAtlas - internetowa baza danych dotycząca wszystkich aspektów anatomii C. elegans ze szczegółowymi wyjaśnieniami i wysokiej jakości obrazami
- WormBook - internetowy przegląd biologii C. elegans
- AceView WormGenes – kolejna baza danych genomu C. elegans , utrzymywana w NCBI
- C. elegans II – darmowy podręcznik online.
- WormWeb Neural Network - narzędzie online do wizualizacji i nawigacji po konektomie C. elegans
- Filmy C. elegans – wizualne wprowadzenie do C. elegans
- Zobacz zestaw genomu ce11 w przeglądarce UCSC Genome Browser .
- Caenorhabditis elegans na eppo.int ( kod EPPO CAEOEL)
-
Cylinder, Drew (2022). „Wykorzystanie C. elegans do badania znieczulenia” . doi : 10.6084/m9.figshare.20963590.v1 .
{{ cite journal }}: Cite journal wymaga|journal=( pomoc )