BRCA2
| BRCA2 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , BRCC2, BROVCA2, FACD, FAD, FAD1, FANCD, FANCD1, GLM3, PNCA2, XRCC11, rak piersi 2, związany z naprawą DNA, rak piersi 2, wczesny początek, BRCA2 związany z naprawą DNA, geny Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
BRCA2 i BRCA2 ( / ˌ b r ć k ə t uː produkt / ) to odpowiednio ludzki gen i jego białkowy . Oficjalny symbol (BRCA2, kursywa dla genu, bez kursywy dla białka) i oficjalna nazwa (pierwotnie rak piersi 2 ; obecnie BRCA2, związany z naprawą DNA ) są utrzymywane przez Komitet Nomenklatury Genów HUGO . Jeden alternatywny symbol, FANCD1 , rozpoznaje jego związek z kompleksem białkowym FANC . Ortologi , stylizowane na Brca2 i Brca2, są powszechne u innych gatunków kręgowców . BRCA2 to ludzki gen supresorowy guza (konkretnie gen opiekuna ), występujący u wszystkich ludzi; jego białko , zwane także synonimem białka podatności na raka piersi typu 2 , jest odpowiedzialne za naprawę DNA.
BRCA2 i BRCA1 są zwykle wyrażane w komórkach piersi i innych tkankach, gdzie pomagają naprawić uszkodzone DNA lub zniszczyć komórki, jeśli DNA nie może zostać naprawione. Biorą udział w naprawie chromosomów , odgrywając ważną rolę w bezbłędnej naprawie pęknięć podwójnej nici DNA . Jeśli sam BRCA1 lub BRCA2 zostanie uszkodzony przez mutację BRCA , uszkodzone DNA nie zostanie odpowiednio naprawione, co zwiększa ryzyko raka piersi . BRCA1 i BRCA2 zostały opisane jako „geny podatności na raka piersi” i „białka podatności na raka piersi”. Dominujący allel ma normalną funkcję supresyjną guza, podczas gdy mutacje o wysokiej penetracji w tych genach powodują utratę funkcji supresyjnej nowotworu, co koreluje ze zwiększonym ryzykiem raka piersi.
Gen BRCA2 znajduje się na długim (q) ramieniu chromosomu 13 w pozycji 12.3 (13q12.3). Ludzki referencyjny BRCA2 zawiera 27 eksonów, a cDNA ma 10 254 par zasad kodujących białko o długości 3418 aminokwasów.
Funkcjonować

Chociaż struktury genów BRCA1 i BRCA2 są bardzo różne, przynajmniej niektóre funkcje są ze sobą powiązane. Białka wytwarzane przez oba geny są niezbędne do naprawy uszkodzonego DNA (patrz rysunek przedstawiający etapy naprawy rekombinacyjnej). BRCA2 wiąże pojedynczą nić DNA i bezpośrednio oddziałuje z rekombinazą RAD51 w celu stymulacji i utrzymania inwazji nici, istotnego etapu rekombinacji homologicznej . Lokalizacja RAD51 na pęknięciu podwójnej nici DNA wymaga utworzenia kompleksu BRCA1-PALB2-BRCA2. PALB2 (partner i lokalizator BRCA2) może działać synergistycznie z chimerą BRCA2 (określaną jako piccolo lub piBRCA2) w celu dalszego promowania inwazji nici. Pęknięcia te mogą być spowodowane promieniowaniem naturalnym i medycznym lub innymi ekspozycjami środowiskowymi, ale występują również, gdy chromosomy wymieniają materiał genetyczny podczas specjalnego rodzaju podziału komórki, który tworzy plemniki i komórki jajowe ( mejoza ). Pęknięcia podwójnej nici są również generowane podczas naprawy wiązań krzyżowych DNA. Naprawiając DNA, białka te odgrywają rolę w utrzymaniu stabilności ludzkiego genomu i zapobiegają niebezpiecznym rearanżacjom genów, które mogą prowadzić do nowotworów hematologicznych i innych.
Wykazano, że BRCA2 odgrywa kluczową rolę w ochronie przed degradacją nukleolityczną zależną od MRE11 odwróconych widełek, które tworzą się podczas przeciągania widełek replikacyjnych DNA (spowodowanego przez przeszkody, takie jak mutacje, czynniki interkalujące itp.).
Podobnie jak BRCA1, BRCA2 prawdopodobnie reguluje aktywność innych genów i odgrywa kluczową rolę w rozwoju zarodka.
Znaczenie kliniczne
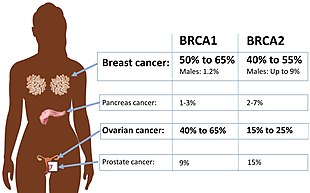
Niektóre odmiany genu BRCA2 zwiększają ryzyko raka piersi jako część dziedzicznego zespołu raka piersi i jajnika . Naukowcy zidentyfikowali setki mutacji w BRCA2 , z których wiele powoduje zwiększone ryzyko zachorowania na raka. Mutacje BRCA2 to zazwyczaj insercje lub delecje niewielkiej liczby par zasad DNA w genie. W wyniku tych mutacji produkt białkowy genu BRCA2 jest nieprawidłowy i nie funkcjonuje prawidłowo. Naukowcy uważają, że wadliwe BRCA2 nie jest w stanie naprawić uszkodzeń DNA, które występują w całym genomie. W rezultacie następuje wzrost mutacji spowodowanych podatną na błędy syntezą translezji po nienaprawionych uszkodzeniach DNA, a niektóre z tych mutacji mogą powodować niekontrolowane podziały komórek i tworzenie guza.
Ludzie, którzy mają dwie zmutowane kopie genu BRCA2 , mają jeden rodzaj niedokrwistości Fanconiego . Stan ten spowodowany jest skrajnie obniżonym poziomem białka BRCA2 w komórkach, co umożliwia gromadzenie się uszkodzonego DNA. Pacjenci z niedokrwistością Fanconiego są podatni na kilka rodzajów białaczki (rodzaj raka krwinek); guzy lite, zwłaszcza głowy, szyi, skóry i narządów rozrodczych; i zahamowanie czynności szpiku kostnego (zmniejszona produkcja krwinek prowadząca do niedokrwistości ). U kobiet, które odziedziczyły wadliwy BRCA1 lub BRCA2 , ryzyko raka piersi i jajnika jest tak wysokie i wydaje się tak selektywne, że wielu nosicielek mutacji decyduje się na profilaktyczną operację . Było wiele przypuszczeń wyjaśniających tak uderzającą specyficzność tkankową. Główne determinanty BRCA1 i BRCA2 są związane ze specyficznością tkankową patogenu nowotworowego, czynnika wywołującego przewlekłe zapalenie lub czynnika rakotwórczego. Tkanka docelowa może mieć receptory dla patogenu, być selektywnie narażona na czynniki rakotwórcze i proces zakaźny. Wrodzony deficyt genomowy upośledza normalne reakcje i zaostrza podatność na choroby w narządach docelowych. Teoria ta pasuje również do danych dla kilku supresorów nowotworów poza BRCA1 lub BRCA2 . Główną zaletą tego modelu jest to, że sugeruje on, że oprócz operacji profilaktycznych istnieją pewne opcje.
Oprócz raka piersi u mężczyzn i kobiet, mutacje w BRCA2 prowadzą również do zwiększonego ryzyka raka jajnika , jajowodu , prostaty i trzustki . W niektórych badaniach mutacje w centralnej części genu wiązano z wyższym ryzykiem raka jajnika i niższym ryzykiem raka prostaty niż mutacje w innych częściach genu. W niektórych rodzinach z mutacjami BRCA2 zaobserwowano również kilka innych rodzajów raka .
Ogólnie rzecz biorąc, silnie odziedziczone mutacje genów (w tym mutacje w BRCA2 ) stanowią jedynie 5-10% przypadków raka piersi; specyficzne ryzyko zachorowania na raka piersi lub innego raka u każdego nosiciela BRCA2 zależy od wielu czynników.
Historia
| Gen BRCA2 został odkryty w 1994 roku. W 1996 roku Kenneth Offit i jego grupa badawcza w Memorial Sloan Kettering Cancer Center z powodzeniem zidentyfikowali najczęstszą mutację w genie związanym z rakiem piersi i jajnika wśród osób pochodzenia żydowskiego aszkenazyjskiego . Gen został po raz pierwszy sklonowany przez naukowców z Myriad Genetics , Endo Recherche, Inc., HSC Research & Development Limited Partnership oraz University of Pennsylvania . Metody diagnozowania prawdopodobieństwa zachorowania na raka u pacjenta z mutacjami BRCA1 i BRCA2 były objęte patentami będącymi własnością Myriad Genetics lub kontrolowanymi przez nią . Model biznesowy Myriad polegający na oferowaniu wyłącznie testów diagnostycznych prowadził od początków Myriad jako startupu w 1994 roku do bycia spółką notowaną na giełdzie, zatrudniającą 1200 pracowników i około 500 milionów dolarów rocznych przychodów w 2012 roku; doprowadziło to również do kontrowersji wokół wysokich cen testów i niedostępności drugich opinii z innych laboratoriów diagnostycznych, co z kolei doprowadziło do przełomowego procesu Association for Molecular Pathology przeciwko Myriad Genetics . Mutacje linii płciowej i efekt założycielaWszystkie zidentyfikowane do tej pory mutacje linii zarodkowej BRCA2 zostały odziedziczone, co sugeruje możliwość dużego efektu „założyciela”, w którym pewna mutacja jest wspólna dla dobrze określonej grupy populacji i teoretycznie można ją prześledzić wstecz do wspólnego przodka. Biorąc pod uwagę złożoność badań przesiewowych mutacji w kierunku BRCA2, te powszechne mutacje mogą uprościć metody wymagane do badań przesiewowych mutacji w niektórych populacjach. Analiza mutacji występujących z dużą częstotliwością pozwala również na badanie ich ekspresji klinicznej. Uderzający przykład mutacji założycielskiej można znaleźć w Islandii, gdzie pojedyncza mutacja BRCA2 (999del5) odpowiada za praktycznie wszystkie rodziny raka piersi/jajnika. Ta mutacja polegająca na przesunięciu ramki prowadzi do wysoce skróconego produktu białkowego. W dużym badaniu obejmującym setki osób z rakiem i osób kontrolnych, ta mutacja 999del5 została znaleziona u 0,6% populacji ogólnej. Warto zauważyć, że podczas gdy 72% pacjentów, u których wykryto nosicielstwo, miało umiarkowany lub silny wywiad rodzinny w kierunku raka piersi, 28% miało niewielki lub żaden wywiad rodzinny w kierunku tej choroby. To silnie sugeruje obecność genów modyfikujących, które wpływają na fenotypową ekspresję tej mutacji lub prawdopodobnie interakcję mutacji BRCA2 z czynnikami środowiskowymi. Dodatkowe przykłady mutacji założycielskich w BRCA2 podano w poniższej tabeli.
MejozaW roślinie Arabidopsis thaliana utrata homologu BRCA2 , AtBRCA2 , powoduje poważne defekty zarówno w mejozie męskiej, jak iw rozwoju gametocytów żeńskich . Białko AtBRCA2 jest niezbędne do prawidłowej lokalizacji kompleksu synaptonemalnego AtZYP1 oraz rekombinaz AtRAD51 i AtDMC1. Ponadto AtBRCA2 jest wymagany do prawidłowej synapsy mejotycznej. Zatem AtBRCA2 jest prawdopodobnie ważny dla rekombinacji mejotycznej. Wydaje się, że AtBRCA2 działa podczas mejozy, kontrolując etapy inwazji pojedynczej nici, w których pośredniczą AtRAD51 i AtDMC1, występujące podczas mejotycznej homologicznej rekombinacyjnej naprawy uszkodzeń DNA. Homologi BRCA2 są również istotne dla mejozy u grzyba Ustilago maydis , robaka Caenorhabditis elegans i muszki owocowej Drosophila melanogaster . Myszy, które produkują skrócone wersje BRCA2, są żywotne, ale bezpłodne. Szczury z mutacją BRCA2 mają fenotyp zahamowania wzrostu i bezpłodności u obu płci. Aspermatogeneza u tych zmutowanych szczurów jest spowodowana niepowodzeniem synapsy homologicznego chromosomu podczas mejozy. Sekwencje powtórzeń BRCDMC1 (rekombinaza mejotyczna DNA 1) jest specyficznym dla mejozy homologiem RAD51 , który pośredniczy w wymianie nici podczas homologicznej naprawy rekombinacyjnej. DMC1 promuje tworzenie produktów inwazji nici DNA (cząsteczek wspólnych) pomiędzy homologicznymi cząsteczkami DNA. Ludzki DMC1 oddziałuje bezpośrednio z każdą z serii sekwencji powtórzeń w białku BRCA2 (zwanych powtórzeniami BRC), które stymulują tworzenie cząsteczek stawowych przez DMC1. Powtórzenia BRC są zgodne z motywem składającym się z sekwencji około 35 wysoce konserwatywnych aminokwasów, które są obecne przynajmniej raz we wszystkich białkach podobnych do BRCA2. Powtórzenia BRCA2 BRC stymulują tworzenie cząsteczek stawowych poprzez promowanie interakcji jednoniciowego DNA (ssDNA) z DMC1. ssDNA w kompleksie z DMC1 może łączyć się w pary z homologicznym ssDNA z innego chromosomu podczas etapu streszczenia mejozy , tworząc wspólną cząsteczkę, centralny etap rekombinacji homologicznej . Zatem sekwencje powtórzeń BRC BRCA2 wydają się odgrywać kluczową rolę w rekombinacyjnej naprawie uszkodzeń DNA podczas rekombinacji mejotycznej. Ogólnie wydaje się, że rekombinacja homologiczna podczas mejozy działa w celu naprawy uszkodzeń DNA [ potrzebne źródło ] i że BRCA2 odgrywa kluczową rolę w wykonywaniu tej funkcji. NeurogenezaBRCA2 jest wymagany u myszy do neurogenezy i supresji rdzeniaka . Utrata „BRCA2” głęboko wpływa na neurogenezę, szczególnie podczas embrionalnego i poporodowego rozwoju neuronów. Te defekty neurologiczne wynikają z uszkodzenia DNA. Kontrola epigenetycznaZmiany epigenetyczne w ekspresji BRCA2 (powodujące nadekspresję lub niedostateczną ekspresję) są bardzo częste w sporadycznych nowotworach (patrz tabela poniżej), podczas gdy mutacje w BRCA2 są rzadko spotykane. W niedrobnokomórkowym raku płuc BRCA2 jest represjonowany epigenetycznie przez hipermetylację promotora. W tym przypadku hipermetylacja promotora jest istotnie związana z niską mRNA i niską ekspresją białka, ale nie z utratą heterozygotyczności genu. W sporadycznym raku jajnika stwierdza się odwrotny efekt. Promotor BRCA2 i regiony 5'-UTR mają stosunkowo mało metylowanych dinukleotydów CpG lub nie mają ich wcale w DNA guza w porównaniu z DNA nienowotworowym, i stwierdzono istotną korelację między hipometylacją a >3-krotną nadekspresją BRCA2. Wskazuje to, że hipometylacja promotora BRCA2 i regionów 5'-UTR prowadzi do nadekspresji mRNA BRCA2. Jeden raport wskazywał na pewną epigenetyczną kontrolę ekspresji BRCA2 przez mikroRNA miR-146a i miR-148a. Ekspresja BRCA2 w rakuU eukariontów białko BRCA2 odgrywa ważną rolę w homologicznej naprawie rekombinacyjnej. U myszy i ludzi BRCA2 pośredniczy przede wszystkim w uporządkowanym składaniu RAD51 na jednoniciowym (ss) DNA, formie, która jest aktywna w parowaniu homologicznym i inwazji nici. BRCA2 przekierowuje również RAD51 z dwuniciowego DNA i zapobiega dysocjacji z ssDNA. Ponadto cztery paralogi RAD51 , składające się z RAD51B ( RAD51L1 ), RAD51C (RAD51L2), RAD51D ( RAD51L3 ), XRCC2 tworzą kompleks zwany kompleksem BCDX2 (patrz rysunek: Rekombinacyjna naprawa DNA). Kompleks ten bierze udział w rekrutacji lub stabilizacji RAD51 w miejscach uszkodzeń. Wydaje się, że kompleks BCDX2 działa poprzez ułatwianie składania lub stabilności włókna nukleoproteinowego RAD51 . RAD51 katalizuje przeniesienie nici między zepsutą sekwencją a jej nieuszkodzonym homologiem, aby umożliwić ponowną syntezę uszkodzonego regionu (patrz modele rekombinacji homologicznej ). Niektóre badania nad nowotworami wskazują na nadmierną ekspresję BRCA2 , podczas gdy inne badania wskazują na niedostateczną ekspresję BRCA2 . Co najmniej dwa doniesienia wykazały nadekspresję w niektórych sporadycznych guzach piersi i niedostateczną ekspresję w innych sporadycznych guzach piersi. (patrz tabela). Wiele nowotworów ma niedobory epigenetyczne w różnych genach naprawy DNA (patrz Częstotliwości epimutacji w genach naprawy DNA w nowotworach ). Te braki naprawcze prawdopodobnie powodują zwiększone nienaprawione uszkodzenia DNA. Nadekspresja BRCA2 obserwowana w wielu nowotworach może odzwierciedlać kompensacyjną nadekspresję BRCA2 i zwiększoną homologiczną naprawę rekombinacyjną, aby przynajmniej częściowo poradzić sobie z takimi nadmiernymi uszkodzeniami DNA. Egawa i in. sugerują, że zwiększoną ekspresję BRCA2 można wytłumaczyć niestabilnością genomową często obserwowaną w nowotworach, która indukuje ekspresję mRNA BRCA2 z powodu zwiększonej potrzeby BRCA2 do naprawy DNA. Niedostateczna ekspresja BRCA2 sama w sobie doprowadziłaby do zwiększenia nienaprawionych uszkodzeń DNA. Błędy replikacji poza tymi uszkodzeniami (patrz synteza translesion ) doprowadziłyby do zwiększonej liczby mutacji i raka.
InterakcjeWykazano, że BRCA2 wchodzi w interakcje Architektura domeny
BRCA2 zawiera 39 powtórzeń aminokwasowych , które są krytyczne dla wiązania RAD51 (białka kluczowego w rekombinacyjnej naprawie DNA) i odporności na leczenie metanosulfonianem metylu. Domena helikalna BRCA2 przyjmuje strukturę helikalną , składającą się z rdzenia klastra z czterema helisami (alfa 1, alfa 8, alfa 9, alfa 10) i dwóch kolejnych spinek do włosów beta (od beta 1 do beta 4). Segment składający się z około 50 aminokwasów, który zawiera cztery krótkie helisy (od alfa 2 do alfa 4), wije się wokół powierzchni struktury rdzenia . W BRCA2 helisy alfa 9 i alfa 10 pakują się z domeną BRCA2 OB1 poprzez kontakty van der Waalsa obejmujące reszty hydrofobowe i aromatyczne, a także poprzez wiązania wodorowe łańcucha bocznego i szkieletu . Ta domena wiąże 70-aminokwasowe białko DSS1 (usunięte w zespole rozszczepionej ręki / rozszczepionej stopy), które pierwotnie zidentyfikowano jako jeden z trzech genów mapujących locus 1,5 Mb usunięty w odziedziczonym zespole wad rozwojowych. Domena BRCA OB1 zakłada fałd OB, który składa się z silnie zakrzywionej pięcioniciowej beta-kartki , która zamyka się, tworząc beczkę beta . OB1 ma płytki rowek utworzony przez jedną stronę zakrzywionego arkusza i jest wyznaczony przez dwie pętle, jedną między beta 1 i beta 2, a drugą między beta 4 i beta 5, co pozwala na słabe wiązanie pojedynczej nici DNA . Domena wiąże również 70-aminokwasowe białko DSS1 (usunięte w zespole rozszczepionej ręki/stopy). Domena BRCA OB3 zakłada fałd OB, który składa się z silnie zakrzywionej pięcioniciowej beta-kartki , która zamyka się, tworząc beczkę beta . OB3 ma wyraźny rowek utworzony przez jedną stronę zakrzywionego arkusza i jest wyznaczony przez dwie pętle, jedną między beta 1 i beta 2, a drugą między beta 4 i beta 5, co pozwala na silne wiązanie ssDNA . Domena Tower przyjmuje strukturę drugorzędową składającą się z pary długich, antyrównoległych helis alfa (rdzeń), które podtrzymują wiązkę trzech helis (3HB) na ich końcu. 3HB zawiera helisa-obrót-helisa i jest podobny do domen wiążących DNA bakteryjnych rekombinaz specyficznych dla miejsca oraz eukariotycznych czynników transkrypcyjnych Myb i homeodomen . Domena Tower odgrywa ważną rolę w supresorowej guza BRCA2 i jest niezbędna do odpowiedniego wiązania BRCA2 z DNA. Patenty, egzekwowanie prawa, spory sądowe i kontrowersjeZgłoszenie patentowe na wyizolowany gen BRCA1 i mutacje sprzyjające rakowi, a także metody diagnozowania prawdopodobieństwa zachorowania na raka piersi, zostało złożone przez University of Utah, National Institute of Environmental Health Sciences (NIEHS) i Myriad Genetics w 1994 r . ; w ciągu następnego roku Myriad, we współpracy z innymi badaczami, wyizolował i zsekwencjonował gen BRCA2 oraz zidentyfikował odpowiednie mutacje, a pierwszy patent BRCA2 został złożony w USA przez Myriad i inne instytucje w 1995 r. Myriad jest wyłącznym licencjobiorcą tych patentów i narzucił je w USA przeciwko klinicznym laboratoriom diagnostycznym. Ten model biznesowy doprowadził od tego, że Myriad był start-upem w 1994 r., do spółki giełdowej z 1200 pracownikami i około 500 mln USD rocznych przychodów w 2012 r.; doprowadziło to również do kontrowersji wokół wysokich cen i niemożności uzyskania drugiej opinii z innych laboratoriów diagnostycznych, co z kolei doprowadziło do przełomowego procesu Association for Molecular Pathology przeciwko Myriad Genetics . Patenty zaczynają wygasać w 2014 roku. Peter Meldrum, dyrektor generalny Myriad Genetics, przyznał, że Myriad ma „inne przewagi konkurencyjne, które mogą sprawić, że egzekwowanie [patentów] stanie się niepotrzebne” w Europie. Decyzje prawne dotyczące patentów BRCA1 i BRCA2 wpłyną ogólnie na dziedzinę badań genetycznych. W czerwcu 2013 r. w sprawie Association for Molecular Pathology v. Myriad Genetics (nr 12-398) Sąd Najwyższy Stanów Zjednoczonych jednogłośnie orzekł, że „naturalnie występujący segment DNA jest produktem natury i nie podlega ochronie patentowej tylko dlatego, że został wyizolowany ”, unieważniając patenty firmy Myriad na geny BRCA1 i BRCA2. Jednak Trybunał orzekł również, że manipulacja genem w celu stworzenia czegoś, co nie występuje w przyrodzie, nadal może kwalifikować się do ochrony patentowej. Sąd Federalny Australii doszedł do przeciwnego wniosku, podtrzymując ważność australijskiego patentu Myriad Genetics na gen BRCA1 w lutym 2013 r., ale ta decyzja jest przedmiotem odwołania, a odwołanie będzie obejmowało rozpatrzenie orzeczenia Sądu Najwyższego Stanów Zjednoczonych. Dalsza lektura
Linki zewnętrzne
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||