SDHB
 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| SDHB | |||||||||||||||||||||||||||||||||||||||||||||||
| , CWS2, IP, PGL4, SDH, SDH1, SDH2, SDHIP, kompleks dehydrogenazy bursztynianowej, podjednostka B żelaza, siarki, MC2DN4 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Dehydrogenaza bursztynianowa [ubichinon] podjednostka żelazowo-siarkowa, mitochondrialna (SDHB) znana również jako podjednostka żelazowo-siarkowa kompleksu II (Ip) jest białkiem , które u ludzi jest kodowane przez gen SDHB .
Dehydrogenaza bursztynianowa (zwana także SDH lub Complex II) kompleks białkowy katalizuje utlenianie bursztynianu (bursztynian + ubichinon => fumaran + ubichinol). SDHB jest jedną z czterech podjednostek białkowych tworzących dehydrogenazę bursztynianową, pozostałe trzy to SDHA , SDHC i SDHD . Podjednostka SDHB jest połączona z SDHA na hydrofilowym, katalitycznym końcu kompleksu SDH. Jest również podłączony do SDHC / SDHD podjednostki na hydrofobowym końcu kompleksu zakotwiczone w błonie mitochondrialnej. Podjednostka jest białkiem żelazowo-siarkowym z trzema skupiskami żelazowo-siarkowymi. Waży 30 kDa .
Struktura
Gen kodujący białko SDHB to DNA jądrowe , a nie mitochondrialne . Jednak ulegające ekspresji białko znajduje się w wewnętrznej błonie mitochondriów . Lokalizacja genu u ludzi znajduje się na pierwszym chromosomie w locus p36.1-p35. Gen jest zakodowany w 1162 parach zasad podzielonych na 8 eksonów . Ekspresjonowane białko waży 31,6 kDa i składa się z 280 aminokwasów. SDHB zawiera klastry żelazowo-siarkowe niezbędne do tunelowania elektronów przez kompleks. Znajduje się między SDHA a dwiema podjednostkami transbłonowymi SDHC i SDHD .
Funkcjonować
Kompleks SDH znajduje się na wewnętrznej błonie mitochondriów i uczestniczy zarówno w cyklu kwasu cytrynowego , jak iw łańcuchu oddechowym . SDHB działa jako półprodukt w podstawowym działaniu enzymu SDH pokazanym na rycinie 1:
- SDHA przekształca bursztynian w fumaran w ramach cyklu kwasu cytrynowego . Ta reakcja również przekształca FAD w FADH 2 .
- Elektrony z FADH 2 są przenoszone do klastrów żelaza podjednostki SDHB [2Fe-2S],[4Fe-4S],[3Fe-4S].
- Wreszcie elektrony są przenoszone do puli ubichinonu (Q) przez podjednostki SDHC / SDHD . Ta funkcja jest częścią łańcucha oddechowego .
Początkowo SDHA utlenia bursztynian poprzez deprotonację w miejscu wiązania FAD, tworząc FADH 2 i pozostawiając luźno związany fumaran z miejscem aktywnym, który może swobodnie opuszczać białko. Elektrony z FADH 2 są przenoszone do klastrów żelaza podjednostki SDHB [2Fe-2S], [4Fe-4S], [3Fe-4S] i tunelują wzdłuż przekaźnika [Fe-S], aż dotrą do siarki żelaza [3Fe-4S ] klaster . Elektrony są następnie przenoszone do oczekującej ubichinonu w miejscu aktywnym puli Q w Dimer SDHC / SDHD . Tlen karbonylowy O1 ubichinonu jest zorientowany w miejscu aktywnym (zdjęcie 4) przez oddziaływania wiązań wodorowych z Tyr83 z SDHD . Obecność elektronów w klastrze siarkowo-żelazowym [3Fe-4S] indukuje ruch ubichinonu do drugiej orientacji. Ułatwia to drugie oddziaływanie wiązaniami wodorowymi między grupą karbonylową O4 ubichinonu i Ser27 z SDHC . Po pierwszym etapie redukcji pojedynczego elektronu, semichinon powstaje gatunek radykalny. Drugi elektron przybywa z klastra [3Fe-4S], aby zapewnić pełną redukcję ubichinonu do ubichinolu .
Znaczenie kliniczne
germinalne w genie mogą powodować rodzinnego paraganglioma (w starej nomenklaturze Paraganglioma typu PGL4). Ten sam stan jest często nazywany rodzinnym guzem chromochłonnym . Rzadziej rak nerkowokomórkowy może być spowodowany tą mutacją.
Przyzwojaki związane z mutacjami SDHB mają wysoki wskaźnik złośliwości. W przypadku nowotworu złośliwego leczenie jest obecnie takie samo, jak w przypadku każdego złośliwego przyzwojaka / guza chromochłonnego.
Rak
Przyzwojaki spowodowane mutacjami SDHB mają kilka wyróżniających cech:
- Nowotwory złośliwe są powszechne i wahają się od 38% do 83% u nosicieli z chorobą. Natomiast guzy spowodowane SDHD są prawie zawsze łagodne. Sporadyczne przyzwojaki są złośliwe w mniej niż 10% przypadków.
- Złośliwe przyzwojaki wywołane przez SDHB są zwykle (być może w 92%) pozanadnerczowe. Sporadyczne guzy chromochłonne / przyzwojaki występują pozanadnerczowo w mniej niż 10% przypadków.
- penetracja genu wynosi 77% w wieku 50 lat (tj. 77% nosicieli będzie miało co najmniej jeden guz w wieku 50 lat) . Jest to prawdopodobnie przeszacowanie. Obecnie (2011) rodziny z cichymi mutacjami SDHB są badane w celu określenia częstotliwości cichych nosicieli.
- Średni wiek zachorowania jest w przybliżeniu taki sam dla choroby SDHB i choroby niezwiązanej z SDHB (około 36 lat).
Mutacje powodujące chorobę obserwowano w eksonach od 1 do 7, ale nie w eksonach 8. Podobnie jak w przypadku genów SDHC i SDHD , SDHB jest genem supresorowym guza .
Tworzenie się guza jest generalnie zgodne z hipotezą Knudsona „dwóch trafień” . Pierwsza kopia genu jest zmutowana we wszystkich komórkach, natomiast druga kopia funkcjonuje normalnie. Kiedy druga kopia mutuje w określonej komórce z powodu zdarzenia losowego, utrata heterozygotyczności (LOH) i białko SDHB nie jest już produkowane. Tworzenie się guza staje się wtedy możliwe.
Biorąc pod uwagę fundamentalną naturę białka SDH we wszystkich funkcjach komórkowych, obecnie nie jest zrozumiałe, dlaczego dotyczy to tylko komórek przyzwojowych. Jednak wrażliwość tych komórek na poziomy tlenu może odgrywać pewną rolę.
Drogi chorobowe
Dokładna ścieżka prowadząca od mutacji SDHB do nowotworzenia nie jest określona; istnieje kilka proponowanych mechanizmów.
Generowanie reaktywnych form tlenu
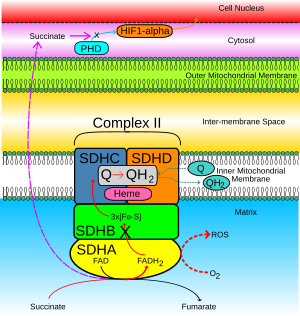
Gdy aktywność bursztynianu-ubichinonu jest zahamowana, elektrony, które normalnie przechodzą przez podjednostkę SDHB do puli ubichinonu, są zamiast tego przenoszone do O2, tworząc reaktywne formy tlenu (ROS), takie jak nadtlenek . Pokazuje to przerywana czerwona strzałka na rysunku 2. ROS gromadzą się i stabilizują produkcję HIF1-α . HIF1-α łączy się z HIF1-β, tworząc stabilny kompleks heterodimeryczny HIF, co z kolei prowadzi do indukcji genów antyapoptotycznych w jądrze komórkowym.
Akumulacja bursztynianu w cytosolu
Inaktywacja SDH może blokować utlenianie bursztynianu , rozpoczynając kaskadę reakcji:
- Bursztynian zgromadzony w macierzy mitochondrialnej dyfunduje przez wewnętrzną i zewnętrzną błonę mitochondrialną do cytozolu ( fioletowe przerywane strzałki na rycinie 2).
- W normalnych warunkach komórkowych HIF1-α w cytozolu jest szybko hydroksylowany przez hydroksylazę prolilową (PHD), co pokazano jasnoniebieską strzałką. Proces ten jest blokowany przez nagromadzony bursztynian.
- HIF1-α stabilizuje się i przechodzi do jądra komórkowego (pomarańczowa strzałka), gdzie łączy się z HIF1-β, tworząc aktywny kompleks HIF, który indukuje ekspresję genów powodujących nowotwór.
Szlak ten stwarza możliwość leczenia terapeutycznego. Nagromadzenie bursztynianu hamuje aktywność PHD. Działanie PHD normalnie wymaga tlenu i alfa-ketoglutaranu jako kosubstratów oraz żelaza i askorbinianu jako kofaktorów . Bursztynian konkuruje z α-ketoglutaranem w wiązaniu z enzymem PHD. Dlatego zwiększenie poziomu α-ketoglutaranu może zrównoważyć efekt akumulacji bursztynianu.
Normalny α-ketoglutaran nie przenika skutecznie przez ściany komórkowe i konieczne jest wytworzenie pochodnej przenikającej do komórki (np. estrów α-ketoglutaranu). Badania in vitro pokazują, że takie podejście do suplementacji może obniżyć poziom HIF1-α i może skutkować terapeutycznym podejściem do nowotworów wynikających z niedoboru SDH.
Upośledzona apoptoza rozwojowa
Tkanka przyzwojowa pochodzi z komórek grzebienia nerwowego obecnych w zarodku . Pozanadnerczowe komórki przyzwojowe jamy brzusznej wydzielają katecholaminy, które odgrywają ważną rolę w rozwoju płodu. Po urodzeniu komórki te zwykle umierają, a proces ten jest wyzwalany spadkiem czynnika wzrostu nerwów (NGF), który inicjuje apoptozę (śmierć komórki).
W tym procesie śmierci komórki pośredniczy enzym zwany hydroksylazą prolilową EglN3. Akumulacja bursztynianu spowodowana inaktywacją SDH hamuje hydroksylazę prolilową EglN3. Wynik netto jest taki, że tkanka przyzębia, która normalnie obumarłaby po urodzeniu, pozostaje, a tkanka ta może później wywołać przyzwojaka/guza chromochłonnego.
Regulacja w górę glikolizy
Hamowanie cyklu kwasu cytrynowego zmusza komórkę do glikolitycznego tworzenia ATP w celu wytworzenia wymaganej energii. Indukowane enzymy glikolityczne mogą potencjalnie blokować apoptozę komórek.
edycja RNA
Transkrypty mRNA genu SDHB u człowieka są edytowane za pomocą nieznanego mechanizmu w pozycji nukleotydu ORF 136, powodując konwersję C do U, a tym samym generowanie kodonu stop, co skutkuje translacją edytowanych transkryptów do skróconego białka SDHB z aminokwasem R46X zmiana kwasu. Ta edycja została pokazana w monocytach i niektórych ludzkich liniach komórek limfatycznych i jest wzmocniona przez niedotlenienie .
Interaktywna mapa szlaków
Kliknij geny, białka i metabolity poniżej, aby przejść do odpowiednich artykułów.
Dalsza lektura
- Milosevic D, Lundquist P, Cradic K i in. (2010). „Opracowanie i walidacja kompleksowego testu wykrywania mutacji i delecji dla SDHB, SDHC i SDHD” . Clin. Biochem . 43 (7–8): 700–4. doi : 10.1016/j.clinbiochem.2010.01.016 . PMC 3419008 . PMID 20153743 .
- Alrashdi I, Bano G, Maher ER, Hodgson SV (2010). „Triada Carneya a zespół Carneya Stratakisa: dwa przypadki, które ilustrują trudność w rozróżnieniu tych stanów u poszczególnych pacjentów”. Fam. Rak . 9 (3): 443–7. doi : 10.1007/s10689-010-9323-z . PMID 20119652 . S2CID 21792188 .
- Okada Y, Kamatani Y, Takahashi A i in. (2010). „Badanie asocjacyjne całego genomu przeprowadzone na 19 633 Japończykach zidentyfikowało LHX3-QSOX2 i IGF1 jako loci wzrostu dorosłego” . Szum. Mol. Genet . 19 (11): 2303–12. doi : 10.1093/hmg/ddq091 . PMID 20189936 .
- Bayley JP (2010). „Czy te złożone heterozygotyczne mutacje SDHB są naprawdę mutacjami?”. Rak krwi u dzieci . 55 (1): 211, odpowiedź autora 212. doi : 10.1002/pbc.22455 . Identyfikator PMID 20213850 . S2CID 31378042 .
- Rose JE, Behm FM, Drgon T i in. (2010). „Spersonalizowane rzucanie palenia: interakcje między dawką nikotyny, uzależnieniem a wynikiem genotypu sukcesu w rzuceniu palenia” . Mol. Med . 16 (7-8): 247-53. doi : 10.2119/molmed.2009.00159 . PMC 2896464 . PMID 20379614 .
- Gill AJ, Benn DE, Chou A i in. (2010). „Immunohistochemia dla SDHB segreguje testy genetyczne SDHB, SDHC i SDHD w zespołach paraganglioma-pheochromocytoma”. Szum. Patol . 41 (6): 805–14. doi : 10.1016/j.humpath.2009.12.005 . Identyfikator PMID 20236688 .
- Martin TP, Irving RM, Maher ER (2007). „Genetyka przyzwojaków: przegląd” . Clin Otolaryngol . 32 (1): 7–11. doi : 10.1111/j.1365-2273.2007.01378.x . PMID 17298303 .
- Eng C, Kiuru M, Fernandez MJ, Aaltonen LA (2003). „Rola enzymów mitochondrialnych w dziedzicznej neoplazji i poza nią”. Nat. Wielebny Rak . 3 (3): 193–202. doi : 10.1038/nrc1013 . PMID 12612654 . S2CID 20549458 .
- Lee J, Wang J, Torbenson M i in. (2010). „Utrata genów SDHB i NF1 w złośliwym guzie liściastym piersi wykryta za pomocą porównawczej hybrydyzacji genomowej z oligomacierzami”. Rak Genetyczny. cytogenet . 196 (2): 179–83. doi : 10.1016/j.cancergencyto.2009.09.005 . PMID 20082856 .
- Hermsen MA, Sevilla MA, Llorente JL i in. (2010). „Znaczność badań przesiewowych mutacji germinalnych zarówno w rodzinnym, jak i sporadycznym przyzwojaku głowy i szyi dla wczesnej diagnozy i postępowania klinicznego” . Komórka. onkol . 32 (4): 275–83. doi : 10.3233/CLO-2009-0498 . PMC 4619289 . Identyfikator PMID 20208144 .
- Musiał Z; Puchmajerová A; Krepelowa A; i in. (2010). „Paraganglioma u 13-letniej dziewczynki: nowa mutacja genu SDHB w rodzinie?”. Rak Genetyczny. cytogenet . 197 (2): 189–92. doi : 10.1016/j.cancergencyto.2009.11.010 . Identyfikator PMID 20193854 .
- Shimada M, Miyagawa T, Kawashima M i in. (2010). „Podejście oparte na badaniu asocjacyjnym całego genomu ujawnia kandydujące loci na narkolepsję”. Szum. Genet . 128 (4): 433–41. doi : 10.1007/s00439-010-0862-z . PMID 20677014 . S2CID 24207887 .
- Brière JJ; Faviera J.; El Ghouzzi V; i in. (2005). „Niedobór dehydrogenazy bursztynianowej u ludzi”. Komórka. Mol. Nauka o życiu . 62 (19–20): 2317–24. doi : 10.1007/s00018-005-5237-6 . PMID 16143825 . S2CID 23793565 .
- Schimke RN, Collins DL, Stolle CA (2010). „Paraganglioma, nerwiak niedojrzały i mutacja SDHB: rozwiązanie 30-letniej tajemnicy”. Jestem. J. Med. Genet. A. _ 152A (6): 1531-5. doi : 10.1002/ajmg.a.33384 . PMID 20503330 . S2CID 22768946 .
- Gill AJ, Chou A, Vilain R i in. (2010). „Immunohistochemia dla SDHB dzieli guzy podścieliskowe przewodu pokarmowego (GIST) na 2 różne typy”. Jestem. J. Surg. Patol . 34 (5): 636–44. doi : 10.1097/PAS.0b013e3181d6150d . PMID 20305538 . S2CID 2314622 .
-
Hendrickson SL, Lautenberger JA, Chinn LW i in. (2010). „Warianty genetyczne w genach mitochondrialnych kodowanych w jądrze wpływają na postęp AIDS” . PLOS JEDEN . 5 (9): e12862. Bibcode : 2010PLoSO...512862H . doi : 10.1371/journal.pone.0012862 . PMC 2943476 . PMID 20877624 .

- Cerecer-Gil NY, Figuera LE, Llamas FJ i in. (2010). „Mutacja SDHB jest przyczyną paraganglioma związanego z niedotlenieniem na dużych wysokościach” . Clin. Rak Res . 16 (16): 4148–54. doi : 10.1158/1078-0432.CCR-10-0637 . PMID 20592014 .
- Krawczyk A, Hasse-Lazar K, Pawlaczek A i in. (2010). „Mutacje germinalne genów RET, SDHB, SDHD i VHL u pacjentów z pozornie sporadycznymi guzami chromochłonnymi i przyzwojakami”. Endokrynol Pol . 61 (1): 43–8. Identyfikator PMID 20205103 .
-
Hes FJ, Weiss MM, Woortman SA i in. (2010). „Niska penetracja mutacji SDHB w dużej holenderskiej rodzinie paraganglioma” . BMC Med. Genet . 11 : 92. doi : 10.1186/1471-2350-11-92 . PMC 2891715 . PMID 20540712 .

- Bailey SD, Xie C, Do R i in. (2010). „Zmiana w locus NFATC2 zwiększa ryzyko obrzęku wywołanego przez tiazolidynodion w badaniu oceny redukcji cukrzycy za pomocą ramiprylu i leku rozyglitazonu (DREAM)” . Opieka nad cukrzycą . 33 (10): 2250–3. doi : 10.2337/dc10-0452 . PMC 2945168 . Identyfikator PMID 20628086 .
-
Baysal BE (2007). „Nawracająca mutacja kodonu stop w genie podjednostki B dehydrogenazy bursztynianowej w normalnej krwi obwodowej i ostrej białaczce T-komórkowej u dzieci” . PLOS JEDEN . 2 (5): e436. Bibcode : 2007PLoSO...2..436B . doi : 10.1371/journal.pone.0000436 . PMC 1855983 . PMID 17487275 .

- Baysal BE, Jong KD, Liu B i in. (2013). „Edycja RNA kodująca C-do-U indukowana hipoksją obniża regulację SDHB w monocytach” . PeerJ . 1 : e152. doi : 10.7717/peerj.152 . PMC 3775634 . PMID 24058882 .