Dehydrogenaza bursztynianowa
| dehydrogenaza bursztynianowa (oksydoreduktaza bursztynianowo-ubichinonowa) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
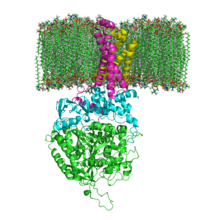 Struktura SQR w błonie fosfolipidowej. SdhA , SdhB , SdhC i SdhD
| |||||||||
| Identyfikatory | |||||||||
| nr WE | 1.3.5.1 | ||||||||
| nr CAS | 9028-11-9 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
| Identyfikatory | |
|---|---|
| dehydrogenazy bursztynianowej | |
| Symbol | Zespół oddechowy II |
| Nadrodzina OPM | 3 |
| Białko OPM | 1zoj |
| Błona | 656 |
Dehydrogenaza bursztynianowa ( SDH ) lub reduktaza koenzymu Q bursztynianu ( SQR ) lub kompleks oddechowy II to kompleks enzymatyczny występujący w wielu komórkach bakteryjnych oraz w wewnętrznej błonie mitochondrialnej eukariontów . Jest to jedyny enzym biorący udział zarówno w cyklu kwasu cytrynowego , jak i łańcuchu transportu elektronów . Analiza histochemiczna wykazująca wysoki poziom dehydrogenazy bursztynianowej w mięśniach wykazuje wysoką zawartość mitochondriów i wysoki potencjał oksydacyjny.
W etapie 6 cyklu kwasu cytrynowego SQR katalizuje utlenianie bursztynianu do fumaranu z redukcją ubichinonu do ubichinolu . Dzieje się tak w wewnętrznej błonie mitochondrialnej poprzez połączenie tych dwóch reakcji.
Struktura
podjednostki
Mitochondrialne i wiele bakteryjnych SQR składa się z czterech strukturalnie różnych podjednostek : dwóch hydrofilowych i dwóch hydrofobowych . Pierwsze dwie podjednostki, flawoproteina (SdhA) i białko żelazowo-siarkowe (SdhB), tworzą hydrofilową głowę, w której zachodzi aktywność enzymatyczna kompleksu. SdhA zawiera kowalencyjnie przyłączony kofaktor dinukleotydu flawinoadeninowego (FAD) i miejsce wiązania bursztynianu a SdhB zawiera trzy klastry żelazowo-siarkowe: [2Fe-2S], [4Fe-4S] i [3Fe-4S]. Drugie dwie podjednostki to hydrofobowe podjednostki kotwiczące w błonie, SdhC i SdhD. Ludzkie mitochondria zawierają dwie różne izoformy SdhA (podjednostki Fp typu I i typu II), izoformy te występują również w Ascaris suum i Caenorhabditis elegans . Podjednostki tworzą związany z błoną cytochromu b z sześcioma helisami przezbłonowymi zawierającymi jedną grupę hemu b i miejsce wiązania ubichinonu . Dwie fosfolipidów , jedna kardiolipina i jedna fosfatydyloetanoloamina znajdują się również w podjednostkach SdhC i SdhD (nie pokazano na rysunku). Służą do zajmowania przestrzeni hydrofobowej poniżej hemu b. Te podjednostki są pokazane na załączonym obrazku. SdhA to kolor zielony, SdhB to turkusowy, SdhC to fuksja, a SdhD to żółty. Wokół SdhC i SdhD znajduje się błona fosfolipidowa z przestrzenią międzybłonową u góry obrazu.
Tabela składu podjednostki
| NIE. | Nazwa podjednostki | Białko ludzkie | Opis białka z UniProt | Pfam z ludzkim białkiem |
|---|---|---|---|---|
| 1 | SdhA | SDHA _CZŁOWIEK | Podjednostka flawoproteiny dehydrogenazy bursztynianowej [ubichinonu], mitochondrialna | Pfam PF00890 , Pfam PF02910 |
| 2 | SdhB | SDHB _CZŁOWIEK | Dehydrogenaza bursztynianowa [ubichinon] podjednostka żelaza i siarki, mitochondrialna | Pfam PF13085 , Pfam PF13183 |
| 3 | SdhC | C560_CZŁOWIEK | Podjednostka dehydrogenazy bursztynianowej cytochromu b560, mitochondrialna | Pfam PF01127 |
| 4 | SdhD | DHSD_HUMAN | Dehydrogenaza bursztynianowa [ubichinon] mała podjednostka cytochromu b, mitochondrialna | Pfam PF05328 |
Miejsce wiązania ubichinonu
Na SDH ssaków można rozpoznać dwa charakterystyczne miejsca wiązania ubichinonu - macierzowo-proksymalną QP i macierzowo-dystalną QD . Miejsce wiązania ubichinonu Qp, które wykazuje większe powinowactwo do ubichinonu, znajduje się w luce złożonej z SdhB, SdhC i SdhD. Ubichinon jest stabilizowany łańcuchami bocznymi His207 podjednostki B, Ser27 i Arg31 podjednostki C oraz Tyr83 podjednostki D. Pierścień chinonu jest otoczony przez Ile28 podjednostki C i Pro160 podjednostki B. Reszty te wraz z Il209, Trp163 i Trp164 podjednostki B oraz Ser27 (atom C) podjednostki C tworzą hydrofobowe środowisko kieszeni Qp wiążącej chinon . Natomiast miejsce wiązania ubichinonu QD , które znajduje się bliżej przestrzeni międzybłonowej, składa się wyłącznie z SdhD i ma mniejsze powinowactwo do ubichinonu.
Miejsce wiązania bursztynianu
SdhA zapewnia miejsce wiązania dla utleniania bursztynianu . Łańcuchy boczne Thr254, His354 i Arg399 podjednostki A stabilizują cząsteczkę, podczas gdy FAD utlenia i przenosi elektrony do pierwszego z klastrów żelazowo-siarkowych [2Fe-2S]. Można to zobaczyć na obrazku 5.
centra redoks
Miejsce wiązania bursztynianu i miejsce wiązania ubichinonu są połączone łańcuchem centrów redoks, w tym FAD i skupisk żelaza i siarki . Łańcuch ten rozciąga się na ponad 40 Å poprzez monomer enzymu . Wszystkie odległości od krawędzi do krawędzi między centrami są mniejsze niż sugerowana granica 14 Å dla fizjologicznego transferu elektronów . Ten transfer elektronów pokazano na obrazku 8.
Montaż i dojrzewanie
Wszystkie podjednostki ludzkiego mitochondrialnego SDH są kodowane jądrowo. Po translacji SDHA jest translokowana jako apoproteina do macierzy mitochondrialnej. Następnie jednym z pierwszych etapów jest kowalencyjne przyłączenie kofaktora FAD ( kowalencyjna flawinylacja). Proces ten jest wzmocniony przez czynnik składania dehydrogenazy bursztynianowej 2 ( SDHAF2 ; zwany także Sdh5 u drożdży i SdhE u bakterii) oraz przez niektóre półprodukty cyklu Krebsa. Fumaran najsilniej stymuluje kowalencyjną flawinylację SDHA. Poprzez badania układu bakteryjnego wykazano, że mechanizm przyłączania FAD obejmuje związek pośredni chinon: metid. W zespole mitochondrialnym, ale nie bakteryjnym, SDHA oddziałuje z drugim czynnikiem składania zwanym czynnikiem składania dehydrogenazy bursztynianowej 4 (SDHAF4; zwany Sdh8 u drożdży), zanim zostanie wstawiony do końcowego kompleksu.
Grupy prostetyczne Fe-S podjednostki SDHB są wstępnie formowane w macierzy mitochondrialnej przez kompleks białkowy ISU. Uważa się również, że kompleks jest zdolny do wstawiania klastrów żelazowo-siarkowych w SDHB podczas jego dojrzewania. Badania sugerują, że wstawienie klastra Fe-S poprzedza tworzenie dimeru SDHA-SDHB. Takie włączenie wymaga redukcji cysteiny w miejscu aktywnym SDHB. Zarówno zredukowane reszty cysteiny, jak i już wbudowane klastry Fe-S są bardzo podatne na ROS . Dwa kolejne czynniki montażowe SDH, SDHAF1 (Sdh6) i SDHAF3 (Sdh7 w drożdżach) wydają się być zaangażowane w dojrzewanie SDHB w celu ochrony podjednostki lub dimeru SDHA-SDHB przed uszkodzeniem klastra Fe-S spowodowanym przez ROS.
montaż kotwicy hydrofobowej składającej się z podjednostek SDHC i SDHD . Zwłaszcza w przypadku hemu b , a nawet jego funkcji. Wydaje się, że grupa prostetyczna hemu b nie jest częścią szlaku transportu elektronów w kompleksie II. Kofaktor raczej utrzymuje stabilność kotwicy.
Mechanizm
Utlenianie bursztynianu
Wiele wiadomo o mechanizmie utleniania bursztynianu , który obejmuje przeniesienie białka i wodorku. Połączenie mutagenezy i analizy strukturalnej identyfikuje Arg-286 podjednostki SDHA ( E. coli ) jako wahadłowiec protonów. Struktury krystaliczne enzymów z wielu organizmów pokazują, że jest to dobrze przygotowane do etapu przeniesienia protonu. Następnie istnieją dwa możliwe mechanizmy eliminacji: E2 lub E1cb. W eliminacji E2 mechanizm jest uzgodniony. Zasadowa reszta lub kofaktor deprotonuje węgiel alfa , a FAD przyjmuje wodorek z węgla beta , utleniając związany bursztynian do fumaranu - patrz obraz 6. W E1cb tworzy się półprodukt enolanowy , pokazany na obrazku 7, zanim FAD zaakceptuje wodorek . Konieczne są dalsze badania w celu określenia mechanizmu eliminacji bursztynianu w dehydrogenazie bursztynianowej. Utleniony fumaran , teraz luźno związany z miejscem aktywnym , może swobodnie opuścić białko .
Tunelowanie elektronów
Po tym, jak elektrony pochodzą z utleniania bursztynianu przez FAD , tunelują wzdłuż przekaźnika [Fe-S], aż dotrą do klastra [3Fe-4S]. Te elektrony są następnie przenoszone do oczekującej cząsteczki ubichinonu w miejscu aktywnym . System tunelowania elektronów żelaza i siarki pokazano na obrazku 9 .
Redukcja ubichinonu
Tlen karbonylowy O1 ubichinonu jest zorientowany w miejscu aktywnym (zdjęcie 4) przez oddziaływania wiązań wodorowych z Tyr83 podjednostki D. Obecność elektronów w klastrze siarkowo-żelazowym [3Fe-4S] indukuje ruch ubichinonu do drugiej orientacji. Ułatwia to drugie wiązaniami wodorowymi między grupą karbonylową O4 ubichinonu i Ser27 podjednostki C. Po pierwszym etapie redukcji pojedynczego elektronu , powstaje rodnik semichinonowy . Drugi elektron przybywa z klastra [3Fe-4S], aby zapewnić pełną redukcję ubichinonu do ubichinolu . Ten mechanizm ubichinonu pokazano na rycinie 8.
Hemowa grupa protetyczna
Chociaż funkcjonalność hemu w dehydrogenazie bursztynianowej jest nadal badana, niektóre badania [ przez kogo? ] stwierdzili, że pierwszy elektron dostarczony do ubichinonu przez [3Fe-4S] może tunelować tam iz powrotem między hemem a produktem pośrednim ubichinonu . W ten sposób kofaktor hemu działa jak pochłaniacz elektronów . Jego rolą jest zapobieganie interakcji półproduktu z tlenem cząsteczkowym w celu wytworzenia reaktywne formy tlenu (ROS). Grupa hemu , w stosunku do ubichinonu , jest pokazana na obrazku 4.
Zaproponowano również, że może istnieć mechanizm bramkowania, aby zapobiec tunelowaniu elektronów bezpośrednio do hemu z klastra [3Fe-4S]. Potencjalnym kandydatem jest reszta His207, która leży bezpośrednio między klastrem a hemem . His207 podjednostki B znajduje się w bezpośrednim sąsiedztwie klastra [3Fe-4S], związanego ubichinonu i hemu ; i może modulować elektronów między tymi centrami redoks.
Transfer protonów
Aby w pełni zredukować chinon w SQR, potrzebne są dwa elektrony oraz dwa protony . Argumentowano, że cząsteczka wody (HOH39) dociera do miejsca aktywnego i jest koordynowana przez His207 podjednostki B, Arg31 podjednostki C i Asp82 podjednostki D. Gatunek semichinonu jest protonowany przez protony dostarczane z HOH39, uzupełniając ubichinon redukcja do ubichinolu . His207 i Asp82 najprawdopodobniej ułatwiają ten proces. skoordynowany z pobliską histydyną , jak również tlenem karbonylowym O1 ubichinonu . Reszta histydyny zmniejsza pKa tyrozyny , czyniąc ją bardziej odpowiednią do oddawania jej protonu zredukowanemu pośredniemu ubichinonowi .
Inhibitory
Istnieją dwie odrębne klasy inhibitorów (SDHI) kompleksu II: te, które wiążą się w kieszeni bursztynianowej i te, które wiążą się w kieszeni ubichinonu. Inhibitory typu ubichinonu obejmują karboksynę i tenoilotrifluoroaceton . Inhibitory analogów bursztynianu obejmują syntetyczny związek malonian, a także półprodukty cyklu TCA, jabłczan i szczawiooctan . Rzeczywiście, szczawiooctan jest jednym z najsilniejszych inhibitorów kompleksu II. Dlaczego wspólny związek pośredni cyklu TCA miałby hamować Kompleks II, nie jest do końca zrozumiały, chociaż może odgrywać rolę ochronną w minimalizowaniu produkcji nadtlenku za pośrednictwem odwrotnego transferu elektronów przez Kompleks I. Atpenina 5a to bardzo silne inhibitory Kompleksu II naśladujące wiązanie ubichinonu.
Inhibitory typu ubichinonu są stosowane jako fungicydy w rolnictwie od lat 60. XX wieku. Karboksynę stosowano głównie do zwalczania chorób powodowanych przez podstawczaki , takich jak rdza łodygi i choroby Rhizoctonia . Niedawno opracowano inne związki o szerszym spektrum działania przeciwko szeregowi patogenów roślin, w tym boskalid , pentiopirad i fluopyram . Niektóre grzyby o znaczeniu rolniczym nie są wrażliwe na przedstawicieli nowej generacji inhibitorów typu ubichinonu.
FRAC ma grupę roboczą ds. SDHI i zaleca praktyki zarządzania odpornością .
Rola w chorobie
Podstawowa rola reduktazy bursztynianu-koenzymu Q w łańcuchu przenoszenia elektronów w mitochondriach sprawia, że jest ona niezbędna w większości organizmów wielokomórkowych , wykazano również, że usunięcie tego enzymu z genomu jest śmiertelne na etapie embrionalnym u myszy.
- Mutacje SdhA mogą prowadzić do zespołu Leigha , encefalopatii mitochondrialnej i zaniku nerwu wzrokowego .
- Mutacje SdhB mogą prowadzić do nowotworu w komórkach chromochłonnych , powodując klasę nowotworów znanych jako niedobór dehydrogenazy bursztynianowej , w tym dziedzicznego przyzwojaka i dziedzicznego guza chromochłonnego , raka nerki z niedoborem dehydrogenazy bursztynianowej i guza podścieliskowego przewodu pokarmowego z niedoborem dehydrogenazy bursztynianowej (GIST). Guzy są zwykle złośliwe . Może to również prowadzić do skrócenia długości życia i zwiększonej produkcji ponadtlenkowych .
- Mutacje SdhC mogą prowadzić do skrócenia długości życia, zwiększonej produkcji jonów ponadtlenkowych , dziedzicznego przyzwojaka i dziedzicznego guza chromochłonnego . Guzy są zwykle łagodne . Te mutacje są rzadkie.
- Mutacje SdhD mogą prowadzić do dziedzicznego przyzwojaka i dziedzicznego guza chromochłonnego . Guzy są zwykle łagodne i często występują w okolicach głowy i szyi. Mutacje te mogą również zmniejszać długość życia i zwiększać produkcję ponadtlenkowych .
Dehydrogenaza bursztynianowa ssaków działa nie tylko w wytwarzaniu energii mitochondrialnej , ale także odgrywa rolę w wykrywaniu tlenu i supresji guza ; i dlatego jest przedmiotem ciągłych badań.
Obniżone poziomy mitochondrialnego enzymu dehydrogenazy bursztynianowej (SDH), głównego składnika kompleksu II, obserwuje się post mortem w mózgach pacjentów z chorobą Huntingtona, a defekty metabolizmu energetycznego zidentyfikowano zarówno u przedobjawowych, jak i objawowych pacjentów HD.




