Dehydrogenaza flawoproteinowa przenosząca elektrony
| Dehydrogenaza flawoprotein przenoszących elektrony | |||||||
|---|---|---|---|---|---|---|---|
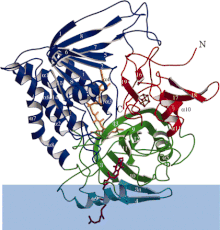
Diagram wstążkowy dehydrogenazy flawoprotein przenoszących elektrony z różnymi kolorami każdej domeny funkcjonalnej. Niebieski pasek to obszar membrany.
| |||||||
| Identyfikatory | |||||||
| Symbol | ETFD | ||||||
| Alt. symbolika | ETF-QO | ||||||
| gen NCBI | 2110 | ||||||
| HGNC | 3483 | ||||||
| OMIM | 231675 | ||||||
| WPB | 2GMH | ||||||
| RefSeq | NM_004453 | ||||||
| UniProt | Q16134 | ||||||
| Inne dane | |||||||
| numer WE | 1.5.5.1 | ||||||
| Umiejscowienie | Chr. 4 q4q32.1 | ||||||
| |||||||
Dehydrogenaza flawoprotein przenosząca elektrony ( dehydrogenaza ETF lub oksydoreduktaza flawoprotein-ubichinonu przenosząca elektrony , EC 1.5.5.1 ) jest enzymem, który przenosi elektrony z flawoproteiny przenoszącej elektrony w macierzy mitochondrialnej do puli ubichinonu w wewnętrznej błonie mitochondrialnej . Jest częścią łańcucha transportu elektronów . Enzym występuje zarówno u prokariotów, jak i eukariontów i zawiera flawiny i FE-S . U ludzi jest kodowany przez ETFDH . Niedobór dehydrogenazy ETF powoduje niedobór dehydrogenazy acylo-CoA o podłożu genetycznym u ludzi .
Funkcjonować
ETQ-QO łączy utlenianie kwasów tłuszczowych i niektórych aminokwasów z fosforylacją oksydacyjną w mitochondriach. W szczególności katalizuje przeniesienie elektronów z flawoproteiny przenoszącej elektrony (ETF) do ubichinonu, redukując go do ubichinolu. Cała sekwencja reakcji przenoszenia jest następująca:
Acyl-CoA → Dehydrogenaza acylo-CoA → ETF → ETF-QO → UQ → Kompleks III .
Katalizowana reakcja
Ogólna reakcja katalizowana przez ETF-QO jest następująca:
ETF-QO(czerwony) + ubichinon ↔ ETF-QO(ox) + ubichinol
Aktywność enzymatyczną zwykle oznacza się spektrofotometrycznie w reakcji z oktanoilo-CoA jako donorem elektronów i ubichinonem-1 jako akceptorem elektronów. Enzym można również oznaczać poprzez dysproporcjonowanie semichinonu ETF. Poniżej obie reakcje:
Oktanoilo-CoA + Q 1 ↔ Q 1 H 2 + Oct-2-enoilo-CoA
2 ETF 1- ↔ ETF wół + ETF 2-
Struktura
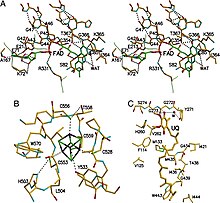
ETF-QO składa się z jednej domeny strukturalnej z trzema domenami funkcjonalnymi upakowanymi w bliskiej odległości: domeną FAD, domeną klastrową 4Fe4S i domeną wiążącą UQ. FAD ma rozszerzoną konformację i jest głęboko schowany w swojej domenie funkcjonalnej. Wiele wiązań wodorowych i dodatni dipol helisy modulują potencjał redoks FAD i mogą prawdopodobnie stabilizować anionowy semichinonowy związek pośredni. Klaster 4Fe4S jest również stabilizowany przez rozległe wiązania wodorowe wokół klastra i jego składników cysteinowych . Wiązanie ubichinonu uzyskuje się poprzez głęboką hydrofobową kieszeń wiążącą, która jest innym trybem niż inne białka wiążące UQ, takie jak oksydoreduktaza bursztynianu-Q . Chociaż ETF-QO jest integralnym białkiem błonowym, nie przechodzi przez całą błonę, w przeciwieństwie do innych białek wiążących UQ.
Mechanizm
Dokładny mechanizm redukcji nie jest znany, chociaż istnieją dwie hipotetyczne ścieżki. Pierwsza ścieżka polega na przenoszeniu elektronów z jednego ETF zredukowanego elektronowo pojedynczo do centrum FAD o niższym potencjale. Jeden elektron jest przenoszony ze zredukowanego FAD do klastra żelaza, co skutkuje stanem zredukowanym z dwoma elektronami, z jednym elektronem w domenach FAD i klastrach. Następnie związany ubichinon jest redukowany do ubichinolu, co najmniej przejściowo tworzy pojedynczo zredukowany semiubichinon. Druga ścieżka obejmuje oddawanie elektronów z ETF do klastra żelaza, po którym następują wewnętrzne przejścia między dwoma centrami elektronowymi. Po zrównoważeniu reszta ścieżki przebiega jak powyżej.
Znaczenie kliniczne
Niedobór ETF-QO skutkuje zaburzeniem znanym jako kwasica glutarowa typu II (znana również jako MADD dla wielu niedoborów dehydrogenazy acylo-CoA), w której dochodzi do nieprawidłowego gromadzenia się tłuszczów i białek w organizmie. Powikłania mogą obejmować kwasicę lub hipoglikemię z innymi objawami, takimi jak ogólne osłabienie, powiększenie wątroby, zwiększona niewydolność serca i niedobór karnityny . Cięższe przypadki obejmują wady wrodzone i pełny kryzys metaboliczny. Genetycznie jest to zaburzenie autosomalne recesywne, co sprawia, że jego występowanie jest dość rzadkie. Większość pacjentów dotkniętych chorobą jest wynikiem pojedynczych mutacji punktowych wokół interfejsu ubichinonu FAD. Łagodniejsze formy zaburzenia reagują na ryboflawiną i są określane jako MADD reagujący na ryboflawinę (RR-MADD), chociaż ze względu na różne mutacje powodujące leczenie choroby i objawy mogą się znacznie różnić.