Grzebień nerwowy
| Grzebień nerwowy | |
|---|---|
 Tworzenie się grzebienia nerwowego w procesie neurulacji. Grzebień nerwowy jest najpierw indukowany w obszarze płytki nerwowej . Po cewy nerwowej grzebień nerwowy rozwarstwia się z obszaru między cewą nerwową grzbietową a leżącą nad nią ektodermą i migruje w kierunku obwodu.
| |
| Identyfikatory | |
| Siatka | D009432 |
| TE | crest_by_E5.0.2.1.0.0.2 E5.0.2.1.0.0.2 |
| FMA | 86666 |
| Terminologia anatomiczna | |
grzebienia nerwowego to tymczasowa grupa komórek, które powstają z listka zarodkowego ektodermy embrionalnej i z kolei dają początek zróżnicowanej linii komórkowej, w tym melanocytom , chrząstce i kościom twarzoczaszki, mięśniom gładkim , neuronom obwodowym i jelitowym oraz glejowi .
Po gastrulacji komórki grzebienia nerwowego są określone na granicy płytki nerwowej i nienerwowej ektodermy . Podczas neurulacji granice płytki nerwowej, znane również jako fałdy nerwowe , zbiegają się w grzbietowej linii środkowej, tworząc cewę nerwową . Następnie komórki grzebienia nerwowego z płytki dachowej cewy nerwowej przechodzą przemianę nabłonkową w mezenchymalną , rozwarstwiając się z neuroepithelium i migrują przez obwód, gdzie różnicują się w różne typy komórek. Pojawienie się grzebienia nerwowego było ważne w kręgowców , ponieważ wiele jego pochodnych strukturalnych definiuje cechy kladu kręgowców .
U podstaw rozwoju grzebienia nerwowego leży sieć regulacji genów , opisana jako zestaw oddziałujących sygnałów, czynników transkrypcyjnych i genów efektorowych , które nadają komórce cechy, takie jak multipotencja i zdolności migracyjne. Zrozumienie molekularnych mechanizmów powstawania grzebienia nerwowego jest ważne dla naszej wiedzy o chorobach człowieka ze względu na ich udział w wielu liniach komórkowych . Nieprawidłowości w rozwoju grzebienia nerwowego powodują neurokrystopatie , które obejmują stany takie jak dysplazja czołowo-nosowa , zespół Waardenburga-Shaha i zespół DiGeorge'a .
Dlatego zdefiniowanie mechanizmów rozwoju grzebienia nerwowego może ujawnić kluczowe informacje na temat ewolucji kręgowców i neurokrystopatii.
Historia
Grzebień nerwowy został po raz pierwszy opisany w zarodku kurczęcia przez Wilhelma His Sr. w 1868 r. jako „sznur pomiędzy” ( Zwischenstrang ) ze względu na jego pochodzenie między płytką nerwową a nienerwową ektodermą. Nazwał grzebień zwojowy tkanki, ponieważ jego ostatecznym celem była każda boczna strona cewy nerwowej, gdzie różnicował się w zwoje rdzeniowe. W pierwszej połowie XX wieku większość badań nad grzebieniem nerwowym prowadzono na embrionach płazów, co zostało zrecenzowane przez Hörstadiusa (1950) w znanej monografii.
Techniki znakowania komórek rozwinęły dziedzinę grzebienia nerwowego, ponieważ umożliwiły naukowcom wizualizację migracji tkanki w rozwijających się zarodkach. W latach sześćdziesiątych Weston i Chibon zastosowali znakowanie radioizotopowe jądra trytowaną tymidyną odpowiednio u kurcząt i zarodków płazów. Jednak ta metoda ma wady związane ze stabilnością, ponieważ za każdym razem, gdy znakowana komórka dzieli się, sygnał jest rozcieńczany. Opracowano również nowoczesne techniki znakowania komórek, takie jak dekstran lizowany rodaminą i barwnik witalny diI, aby przejściowo oznaczać linie grzebienia nerwowego.
System znakowania piskląt przepiórek, opracowany przez Nicole Le Douarin w 1969 roku, był kolejną instrumentalną techniką stosowaną do śledzenia komórek grzebienia nerwowego. Chimery , powstałe w wyniku przeszczepu, umożliwiły naukowcom odróżnienie komórek grzebienia nerwowego jednego gatunku od otaczającej tkanki innego gatunku. Dzięki tej technice pokolenia naukowców były w stanie wiarygodnie oznaczać i badać ontogenezę komórek grzebienia nerwowego.
Wprowadzenie
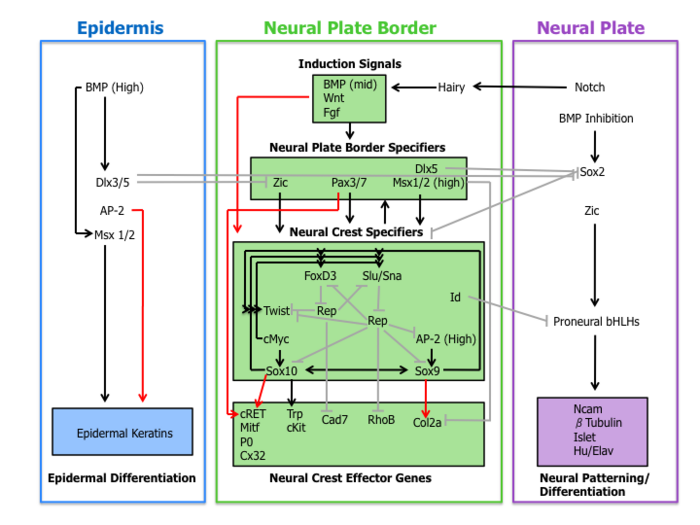
Molekularna kaskada zdarzeń jest zaangażowana w ustalanie migracyjnych i multipotentnych cech komórek grzebienia nerwowego. Tę sieć regulacyjną genów można podzielić na następujące cztery podsieci opisane poniżej.
Sygnały indukcyjne
Po pierwsze, pozakomórkowe cząsteczki sygnałowe, wydzielane z sąsiedniego naskórka i leżącej pod nim mezodermy , takie jak Wnt , BMP i Fgf , oddzielają nienerwową ektodermę (naskórek) od płytki nerwowej podczas indukcji neuronalnej .
Sygnalizacja Wnt została wykazana w indukcji grzebienia nerwowego u kilku gatunków poprzez eksperymenty dotyczące wzmocnienia i utraty funkcji. Zgodnie z tą obserwacją promotora ślimaka (gen specyficzny dla grzebienia nerwowego) zawiera miejsce wiązania czynników transkrypcyjnych zaangażowanych w aktywację docelowych genów zależnych od Wnt, co sugeruje bezpośrednią rolę sygnalizacji Wnt w specyfikacji grzebienia nerwowego.
Obecna rola BMP w tworzeniu grzebienia nerwowego jest związana z indukcją płytki nerwowej. Antagoniści BMP dyfundujący z ektodermy generują gradient aktywności BMP. W ten sposób linia grzebienia nerwowego tworzy się z pośrednich poziomów sygnalizacji BMP wymaganych do rozwoju płytki nerwowej (niski BMP) i naskórka (wysoki BMP).
, że Fgf z mezodermy przyosiowej jest źródłem sygnału indukcyjnego grzebienia nerwowego. Naukowcy wykazali, że ekspresja dominującego ujemnego receptora Fgf w eksplantatach ektodermy blokuje indukcję grzebienia nerwowego po rekombinacji z mezodermą przyosiową. Zrozumienie roli szlaków BMP, Wnt i Fgf w ekspresji specyfikatora grzebienia nerwowego pozostaje niepełne.
Specyfikatory granicy płytki neuronowej
Zdarzenia sygnalizacyjne, które ustanawiają granicę płytki nerwowej, prowadzą do ekspresji zestawu czynników transkrypcyjnych określonych tutaj jako specyfikatory granicy płytki nerwowej. Cząsteczki te obejmują czynniki Zic, Pax3/7, Dlx5, Msx1/2, które mogą pośredniczyć we wpływie Wnts, BMPs i Fgfs. Geny te ulegają szerokiej ekspresji w regionie granicznym płytki nerwowej i poprzedzają ekspresję prawdziwych markerów grzebienia nerwowego.
Dowody eksperymentalne umieszczają te czynniki transkrypcyjne przed specyfikatorami grzebienia nerwowego. Na przykład w Xenopus Msx1 jest niezbędny i wystarczający do ekspresji Slug, Snail i FoxD3. Ponadto Pax3 jest niezbędny do ekspresji FoxD3 w zarodkach myszy.
Specyfikatory grzebienia neuronowego
Po ekspresji specyfikatorów granicy płytki nerwowej następuje zbiór genów, w tym Slug/Snail, FoxD3, Sox10, Sox9, AP-2 i c-Myc. Ten zestaw genów, oznaczony tutaj jako specyfikatory grzebienia nerwowego, jest aktywowany w powstających komórkach grzebienia nerwowego. Przynajmniej w Xenopusie każdy specyfikator grzebienia nerwowego jest konieczny i/lub wystarczający do wyrażenia wszystkich innych specyfikatorów, wykazując istnienie rozległej regulacji krzyżowej. Co więcej, ten organizm modelowy odegrał kluczową rolę w wyjaśnieniu roli szlaku sygnałowego Hedgehog w specyfikacji grzebienia nerwowego, przy czym czynnik transkrypcyjny Gli2 odgrywał kluczową rolę.
Poza ściśle regulowaną siecią specyfikatorów grzebienia nerwowego znajdują się dwa inne czynniki transkrypcyjne Twist i Id. Twist, bHLH , jest wymagany do różnicowania mezenchymów struktur łuku gardłowego . Id jest bezpośrednim celem c-Myc i wiadomo, że jest ważny dla utrzymania komórek macierzystych grzebienia nerwowego.
Geny efektorowe grzebienia nerwowego
Wreszcie specyfikatory grzebienia nerwowego włączają ekspresję genów efektorowych, które nadają pewne właściwości, takie jak migracja i multipotencja. Dwa efektory grzebienia nerwowego, GTPazy Rho i kadheryny , działają w rozwarstwieniu poprzez regulację morfologii komórek i właściwości adhezyjnych. Sox9 i Sox10 regulują różnicowanie grzebienia nerwowego poprzez aktywację wielu efektorów specyficznych dla typu komórki, w tym Mitf, P0, Cx32, Trp i cKit.
Migracja
Migracja komórek grzebienia nerwowego obejmuje wysoce skoordynowaną kaskadę zdarzeń, która rozpoczyna się zamknięciem grzbietowej cewy nerwowej .
Rozwarstwienie
Po zrośnięciu fałdu nerwowego w celu utworzenia cewy nerwowej komórki pierwotnie zlokalizowane na granicy płytki nerwowej stają się komórkami grzebienia nerwowego . Aby migracja mogła się rozpocząć, komórki grzebienia nerwowego muszą przejść proces zwany rozwarstwieniem, który obejmuje pełne lub częściowe przejście nabłonkowo-mezenchymalne (EMT) . Rozwarstwienie definiuje się jako rozdzielenie tkanki na różne populacje, w tym przypadku komórki grzebienia nerwowego oddzielające się od otaczającej tkanki. I odwrotnie, EMT to seria zdarzeń koordynujących zmianę z nabłonka do fenotypu mezenchymalnego . Na przykład rozwarstwienie zarodków kurcząt jest wyzwalane przez kaskadę BMP / Wnt , która indukuje ekspresję czynników transkrypcyjnych promujących EMT , takich jak SNAI2 i FoxD3 . Chociaż wszystkie komórki grzebienia nerwowego przechodzą EMT, czas rozwarstwienia występuje na różnych etapach w różnych organizmach: w Xenopus laevis występuje masywne rozwarstwienie, które pojawia się, gdy płytka nerwowa nie jest całkowicie zrośnięty, podczas gdy rozwarstwienie zarodka kurzego następuje podczas fuzji fałdu nerwowego .
Przed rozwarstwieniem przypuszczalne komórki grzebienia nerwowego są początkowo zakotwiczone w sąsiednich komórkach przez białka ścisłego połączenia , takie jak okludyna i cząsteczki adhezyjne, takie jak NCAM i N - kadheryna . Wyrażane grzbietowo BMP inicjują rozwarstwienie poprzez indukcję ekspresji czynników transkrypcyjnych białka palca cynkowego ślimaka , ślimaka i skrętu . Czynniki te odgrywają bezpośrednią rolę w wywoływaniu przejście nabłonkowo-mezenchymalne poprzez zmniejszenie ekspresji okludyny i N-kadheryny , oprócz promowania modyfikacji NCAM resztami kwasu polisialowego w celu zmniejszenia adhezyjności . Komórki grzebienia nerwowego również zaczynają wyrażać proteazy zdolne do degradacji kadheryn , takich jak ADAM10 i wydzielające metaloproteinazy macierzy (MMP) , które degradują leżącą nad nimi blaszkę podstawną cewy nerwowej, aby umożliwić ucieczkę komórkom grzebienia nerwowego. Dodatkowo komórki grzebienia nerwowego zaczynają wyrażać integryny , które łączą się z białkami macierzy pozakomórkowej , w tym kolagenem , fibronektyną i lamininą podczas migracji. Gdy blaszka podstawna stanie się przepuszczalna, komórki grzebienia nerwowego mogą rozpocząć migrację w całym zarodku.
Migracja
Migracja komórek grzebienia nerwowego zachodzi w kierunku dziobowym do ogonowym bez potrzeby stosowania rusztowania neuronowego , takiego jak wzdłuż promieniowej komórki glejowej . Z tego powodu proces migracji komórek grzebienia określa się jako „swobodną migrację”. Zamiast rusztowania na komórkach progenitorowych , migracja grzebienia nerwowego jest wynikiem odpychającego przewodnictwa poprzez sygnalizację EphB / EphrinB i semaforyny / neuropiliny , interakcji z macierzą pozakomórkową i hamowanie kontaktu ze sobą. Podczas gdy białka Ephrin i Eph mają zdolność do przechodzenia dwukierunkowej sygnalizacji, odpychanie komórek grzebienia nerwowego wykorzystuje głównie sygnalizację do przodu, aby zainicjować odpowiedź w komórce grzebienia nerwowego niosącej receptor . Pęczniejące komórki grzebienia nerwowego wykazują ekspresję EphB, receptorowej kinazy tyrozynowej , która wiąże transbłonowy ligand EphrinB wyrażany w ogonowej połowie każdego somitu . Kiedy te dwie domeny oddziałują na siebie, powoduje to fosforylację tyrozyny receptora, aktywację rhoGTPaz i ostatecznie cytoszkieletu w komórkach grzebienia, powodujące ich odpychanie. Zjawisko to umożliwia komórkom grzebienia nerwowego przechodzenie przez dziobową część każdego somitu.
Odpychająca sygnalizacja semaforyny i neuropiliny działa synergistycznie z sygnalizacją EphB, aby kierować komórkami grzebienia nerwowego w dół dziobowej połowy somitów u myszy. W zarodkach kurzych semaforyna działa w okolicy głowy, prowadząc komórki grzebienia nerwowego przez łuki gardłowe . Oprócz odpychającej odpychającej sygnalizacji, komórki grzebienia nerwowego wyrażają integryny β1 i α4 , co pozwala na wiązanie i kierowaną interakcję z kolagenem , lamininą i fibronektyną macierzy pozakomórkowej podczas podróży. Ponadto komórki grzebienia mają wewnętrzne hamowanie kontaktu ze sobą, podczas swobodnej inwazji na tkanki różnego pochodzenia, takie jak mezoderma . Komórki grzebienia nerwowego, które migrują przez dziobową połowę somitów, różnicują się w neurony czuciowe i współczulne obwodowego układu nerwowego . Inną główną drogą, którą pokonują komórki grzebienia nerwowego, jest droga grzbietowo-boczna między naskórkiem a dermamiotomem . Komórki migrujące tą drogą różnicują się w komórki barwnikowe skóry właściwej . Dalsze różnicowanie komórek grzebienia nerwowego i specyfikacja ich ostatecznego typu komórek jest obciążona ich czasoprzestrzennym poddaniem się morfogenicznym wskazówkom, takim jak BMP, Wnt, FGF, Hox i Notch .
Znaczenie kliniczne
Neurokrystopatie wynikają z nieprawidłowej specyfikacji, migracji, różnicowania lub śmierci komórek grzebienia nerwowego podczas rozwoju embrionalnego. Ta grupa chorób obejmuje szerokie spektrum wrodzonych wad rozwojowych dotykających wiele noworodków. Dodatkowo powstają na skutek defektów genetycznych wpływających na powstawanie grzebienia nerwowego oraz na skutek działania Teratogenów
zespół Waardenburga
Zespół Waardenburga jest neurokrystopatią wynikającą z wadliwej migracji komórek grzebienia nerwowego. Główne cechy tego stanu to piebaldyzm i wrodzona głuchota . W przypadku piebaldyzmu bezbarwne skóry są spowodowane całkowitym brakiem melanocytów wytwarzających pigmenty pochodzące z grzebienia nerwowego . Istnieją cztery różne typy zespołu Waardenburga, z których każdy ma inną genetykę i cechy fizjologiczne. Typy I i II rozróżnia się na podstawie tego, czy członkowie rodziny osoby dotkniętej chorobą mają dystopię canthorum . Typ III powoduje nieprawidłowości kończyn górnych. Wreszcie, typ IV jest również znany jako zespół Waardenburga-Shaha, a osoby dotknięte chorobą wykazują zarówno zespół Waardenburga, jak i chorobę Hirschsprunga . Typy I i III są dziedziczone w sposób autosomalny dominujący , podczas gdy typy II i IV wykazują autosomalny recesywny wzór dziedziczenia. Ogólnie rzecz biorąc, zespół Waardenburga jest rzadki, z zapadalność ~ 2/100 000 osób w Stanach Zjednoczonych. Wszystkie rasy i płci są w równym stopniu dotknięte. Obecnie nie ma lekarstwa ani leczenia zespołu Waardenburga.
Choroba Hirschsprunga
migracją komórek grzebienia nerwowego odpowiada również choroba Hirschsprunga (HD lub HSCR), charakteryzująca się brakiem unerwienia w obszarach jelita . Ten brak unerwienia może prowadzić do dalszych nieprawidłowości fizjologicznych , takich jak powiększona okrężnica ( megacolon ), niedrożność jelit , a nawet spowolnienie wzrostu. W zdrowym rozwoju komórki grzebienia nerwowego migrują do jelita i tworzą zwoje jelitowe . Geny odgrywające rolę w zdrowej migracji tych komórek grzebienia nerwowego do jelita obejmują RET , GDNF , GFRα , EDN3 i EDNRB . RET , receptorowa kinaza tyrozynowa (RTK), tworzy kompleks z GDNF i GFRα . EDN3 i EDNRB są następnie zaangażowane w tę samą sieć sygnalizacyjną. Kiedy ta sygnalizacja jest zakłócona u myszy, aganlionoza lub brak tych zwojów jelitowych.
Płodowe zaburzenia ze spektrum alkoholowego
Prenatalna ekspozycja na alkohol (PAE) jest jedną z najczęstszych przyczyn wad rozwojowych . W zależności od stopnia narażenia i ciężkości powstałych nieprawidłowości, pacjenci są diagnozowani w ramach kontinuum zaburzeń szeroko określanych jako Spektrum Płodowych Zaburzeń Alkoholowych (FASD). Ciężki FASD może upośledzać migrację grzebienia nerwowego , o czym świadczą charakterystyczne nieprawidłowości twarzoczaszki , w tym krótkie szpary powiekowe , wydłużona górna warga i wygładzona rynienka podnosowa . Jednak ze względu na rozwiązły charakter wiązania etanolu , mechanizmy powstawania tych nieprawidłowości są nadal niejasne. Eksplantaty z hodowli komórkowej komórek grzebienia nerwowego, a także rozwijające się in vivo zarodki danio pręgowanego wystawione na działanie etanolu wykazują zmniejszoną liczbę komórek migrujących i zmniejszone odległości pokonywane przez migrujące komórki grzebienia nerwowego. Mechanizmy stojące za tymi zmianami nie są dobrze poznane, ale dowody sugerują, że PAE może zwiększać apoptozę z powodu zwiększonej cytozolu wapnia spowodowane uwalnianiem wapnia z zapasów wewnątrzkomórkowych za pośrednictwem IP3 . Zaproponowano również, że zmniejszona żywotność komórek grzebienia nerwowego wystawionych na działanie etanolu jest spowodowana zwiększonym stresem oksydacyjnym . Pomimo tych i innych postępów wiele pozostaje do odkrycia na temat wpływu etanolu na rozwój grzebienia nerwowego. Na przykład wydaje się, że etanol różnie wpływa na niektóre komórki grzebienia nerwowego w porównaniu z innymi; to znaczy, podczas gdy nieprawidłowości twarzoczaszki są powszechne w PAE, komórkach barwnikowych pochodzących z grzebienia nerwowego wydają się mieć minimalny wpływ.
Zespół DiGeorge'a
Zespół DiGeorge'a jest związany z delecjami lub translokacjami małego segmentu ludzkiego chromosomu 22 . Ta delecja może zakłócić migrację lub rozwój rostralnych komórek grzebienia nerwowego . Niektóre obserwowane defekty są związane z torebki gardłowej , który otrzymuje wkład z rostralnych wędrownych komórek grzebienia. Objawy zespołu DiGeorge'a obejmują wrodzone wady serca , wady twarzy i niektóre neurologiczne i trudnościami w uczeniu się . Zgłaszano również, że pacjenci z delecjami 22q11 mają większą częstość występowania schizofrenii i choroby afektywnej dwubiegunowej .
Syndrom Treachera Collinsa
Zespół Treachera Collinsa (TCS) wynika z upośledzonego rozwoju pierwszego i drugiego łuku gardłowego we wczesnym stadium embrionalnym, co ostatecznie prowadzi do nieprawidłowości środkowej i dolnej części twarzy. TCS jest spowodowany mutacją zmiany sensu genu TCOF1 , która powoduje apoptozę komórek grzebienia nerwowego podczas embriogenezy . Chociaż mutacje genu TCOF1 należą do najlepiej scharakteryzowanych pod względem ich roli w TCS, mutacje w genach POLR1C i POLR1D zostały również powiązane z patogenezą TCS.
Linie komórkowe
Komórki grzebienia nerwowego pochodzące z różnych miejsc wzdłuż osi przednio -tylnej rozwijają się w różne tkanki. Te obszary grzebienia nerwowego można podzielić na cztery główne domeny funkcjonalne, które obejmują grzebień nerwowy czaszkowy, grzebień nerwowy tułowia, grzebień nerwowy nerwu błędnego i krzyżowego oraz grzebień nerwowy serca.
Grzebień nerwowy czaszki
Grzebień nerwowy czaszki migruje grzbietowo-bocznie, tworząc mezenchym twarzoczaszki, który różnicuje się w różne zwoje czaszki oraz chrząstki i kości twarzoczaszki. Komórki te wchodzą do kieszonek i łuków gardłowych, gdzie wchodzą w skład grasicy , kości ucha środkowego i szczęki oraz odontoblastów zawiązków zębów.
Grzebień nerwowy tułowia
Grzebień nerwowy pnia powoduje powstanie dwóch populacji komórek. Jedna grupa komórek, której przeznaczeniem jest stać się melanocytami , migruje grzbietowo-bocznie do ektodermy w kierunku brzusznej linii środkowej. Druga grupa komórek migruje brzuszno-bocznie przez przednią część każdego sklerotomu . Komórki, które pozostają w sklerotomie, tworzą zwoje korzeni grzbietowych , podczas gdy te, które znajdują się bardziej brzusznie, tworzą zwoje współczulne, rdzeń nadnerczy i nerwy otaczające aortę.
Grzebień nerwowy nerwu błędnego i krzyżowego
Komórki grzebienia nerwowego nerwu błędnego i krzyżowego rozwijają się w zwoje jelitowego układu nerwowego i zwoje przywspółczulne.
Grzebień nerwowy serca
Grzebień nerwowy serca rozwija się w melanocyty, chrząstkę, tkankę łączną i neurony niektórych łuków gardłowych. Również ta domena powoduje powstanie obszarów serca, takich jak tkanka mięśniowo-łączna dużych tętnic i część przegrody , która oddziela krążenie płucne od aorty. Według nowych badań zastawki półksiężycowate serca są związane z komórkami grzebienia nerwowego.
Ewolucja
Kilka struktur, które odróżniają kręgowce od innych strunowców, powstaje z pochodnych komórek grzebienia nerwowego. W swojej teorii „nowej głowy” Gans i Northcut argumentują, że obecność grzebienia nerwowego była podstawą specyficznych cech kręgowców, takich jak zwoje czuciowe i szkielet czaszki. Co więcej, pojawienie się tych cech było kluczowe w ewolucji kręgowców, ponieważ umożliwiło drapieżny styl życia.
Jednak uznanie grzebienia nerwowego za innowację wśród kręgowców nie oznacza, że powstał on de novo . Zamiast tego często powstają nowe struktury poprzez modyfikację istniejących rozwojowych programów regulacyjnych. Na przykład programy regulacyjne mogą zostać zmienione przez kooptację nowych regulatorów wyższego szczebla lub zastosowanie nowych docelowych genów niższego szczebla, umieszczając w ten sposób istniejące sieci w nowym kontekście. Pomysł ten jest poparty hybrydyzacji in situ , które pokazują zachowanie specyfikatorów granicy płytki nerwowej w protochordach , co sugeruje, że część sieci prekursorów grzebienia nerwowego była obecna u wspólnego przodka akordów. W niektórych akordach innych niż kręgowce, takich jak osłonice, zidentyfikowano linię komórek (melanocytów), które są podobne do komórek grzebienia nerwowego u kręgowców. Oznacza to, że szczątkowy grzebień nerwowy istniał u wspólnego przodka kręgowców i osłonic.
Pochodne grzebienia nerwowego
Ectomesenchyme (znany również jako mesektoderma ): odontoblasty , brodawki zębowe , chondrocranium (torebka nosowa, chrząstka Meckela , kosteczki twardówki, kwadratowe, stawowe, gnykowe i columella), chrząstka tchawicy i krtani , dermatokranium (kości błoniaste), płetwy grzbietowe i plastron żółwia (dolne kręgowce), perycyty i mięśnie gładkie tętnic i żył skrzelowych, ścięgna mięśni oka i żucia, tkanka łączna gruczołów głowy i szyi (przysadki, ślinianek, łzowych, grasicy, tarczycy) skóra właściwa i tkanka tłuszczowa czaszki, brzusznej części szyi i twarzy
Komórki wydzielania wewnętrznego : komórki chromochłonne rdzenia nadnerczy, komórki kłębuszkowe typu I/II.
Obwodowy układ nerwowy : neurony czuciowe i glej zwojów korzeni grzbietowych , zwoje głowowe (VII i częściowo V, IX i X), komórki Rohona-Bearda , niektóre komórki Merkla w wąsach, satelitarne komórki glejowe wszystkich autonomicznych i czuciowych zwoje nerwowe, komórki Schwanna wszystkich nerwów obwodowych.
Komórki jelitowe : Komórki enterochromafinowe .
Melanocyty i komórki mięśniowe i barwnikowe tęczówki , a nawet związane z niektórymi nowotworami (takimi jak melanotyczny guz neuroektodermalny wieku niemowlęcego ).
Zobacz też
- Syndrom pierwszego łuku
- DGCR2 — może kontrolować migrację komórek grzebienia nerwowego
- Lista typów komórek ludzkich pochodzących z listków zarodkowych

