Komórka neuroepitelialna
Komórki neuroepitelialne lub komórki neuroektodermalne tworzą ścianę zamkniętej cewy nerwowej we wczesnym rozwoju embrionalnym . Komórki neuroepitelialne rozciągają się na grubość ścianki rurki, łącząc się z miednicy oraz z powierzchnią komory lub światła . Są one połączone w świetle rurki przez kompleksy węzłowe , gdzie tworzą pseudostratyfikowaną warstwę nabłonka zwaną neuroepithelium .
Komórki neuroepitelialne są komórkami macierzystymi ośrodkowego układu nerwowego , znanymi jako nerwowe komórki macierzyste i wytwarzają pośrednie komórki progenitorowe , znane jako komórki gleju promienistego , które różnicują się w neurony i glej w procesie neurogenezy .
Embrionalny rozwój neuronów
Rozwój mózgu
W trzecim tygodniu rozwoju embrionalnego mózg zaczyna się rozwijać we wczesnym płodzie w procesie zwanym morfogenezą . Komórki neuroepitelialne ektodermy zaczynają się szybko namnażać i fałdować, tworząc płytkę nerwową , która wrasta w czwartym tygodniu rozwoju embrionalnego i tworzy cewę nerwową . Utworzenie cewy nerwowej polaryzuje komórki neuroepitelialne, kierując wierzchołkową stronę komórki do wewnątrz, co później staje się strefą komorową, a strona podstawna jest zorientowana na zewnątrz, co styka się z miednicą lub zewnętrzną powierzchnię rozwijającego się mózgu . W ramach tej polaryzacji komórki neuroepitelialne wyrażają promininę-1 w wierzchołkowej błonie plazmatycznej, jak również ścisłe połączenia w celu utrzymania polaryzacji komórek. Integryna alfa 6 zakotwicza komórki neuroepitelialne w blaszce podstawnej . Cewa nerwowa zaczyna się jako pojedyncza warstwa pseudostratyfikowanych komórek nabłonkowych , ale szybka proliferacja komórek neuroepitelialnych tworzy dodatkowe warstwy i ostatecznie trzy odrębne regiony wzrostu. Ponieważ te dodatkowe warstwy tworzą polaryzację wierzchołkowo-podstawną, należy obniżyć regulację. Dalsza proliferacja komórek w tych regionach prowadzi do powstania trzech odrębnych obszarów mózgu: przodomózgowia , śródmózgowia i tyłomózgowia . Z cewy nerwowej powstaje również rdzeń kręgowy .
Proliferacja komórek neuroepitelialnych
Komórki neuroepitelialne są klasą komórek macierzystych i mają zdolność do samoodnawiania. Podczas tworzenia cewy nerwowej komórki neuroepitelialne przechodzą symetryczne podziały proliferacyjne, w wyniku których powstają dwie nowe komórki neuroepitelialne. Na późniejszym etapie rozwoju mózgu komórki neuroepitelialne zaczynają się samoodnawiać i dają początek progenitorom komórek innych niż macierzyste, takim jak promieniste komórki glejowe, jednocześnie przechodząc asymetryczny podział. Ekspresja Tis21 , gen antyproliferacyjny, powoduje przejście komórki neuroepitelialnej z podziału proliferacyjnego do podziału neuronowego. Wiele komórek neuroepitelialnych dzieli się również na promieniste komórki glejowe, podobne, ale bardziej ograniczone przez los. Będąc komórką bardziej ograniczoną przez los, radialna komórka glejowa będzie generować neurony postmitotyczne, pośrednie komórki progenitorowe lub astrocyty w gliogenezie . Podczas podziału komórek neuroepitelialnych interkinetyczna migracja jądra umożliwia komórkom nieograniczony podział przy zachowaniu gęstego upakowania. Podczas G1 jądro komórkowe migruje do podstawnej strony komórki i pozostaje tam przez fazę S i migruje do wierzchołkowej strony w fazie G2 . Ta migracja wymaga pomocy mikrotubul i włókien aktynowych .
Promieniowe przejście komórek glejowych
Komórki neuroepitelialne dają początek promieniowym komórkom progenitorowym gleju we wczesnym rozwoju embrionalnym. Aby dokonać tej zmiany, komórki neuroepitelialne zaczynają zmniejszać swoje cechy nabłonkowe, zatrzymując ekspresję okludyny , białka ścisłego połączenia. Utrata okludyny powoduje utratę dotychczasowych szczelnych połączeń, które są wymagane do generowania neuroblastów . Inne białko ścisłego połączenia , PARD3 , pozostaje po wierzchołkowej stronie komórki, kolokując się z N-kadheryną i utrzymuje wierzchołkową powierzchnię komórki neuroepitelialnej w stanie nienaruszonym. W przypadku braku okludyny pewna polaryzacja jest nadal tracona, a komórka neuroepitelialna daje początek promieniowej komórce glejowej.
Neurogeneza dorosłych
Geneza komórek neuroepitelialnych w OUN dorosłego człowieka
W ośrodkowym układzie nerwowym dorosłych komórki neuroepitelialne powstają w kilku różnych obszarach mózgu: strefie podkomorowej (SVZ), opuszce węchowej i zakręcie zębatym hipokampu . Komórki te nie występują w żadnym z obwodowego układu nerwowego . Komórki neuroepitelialne, często klasyfikowane jako nerwowe komórki macierzyste, dają początek tylko kilku odmianom komórek nerwowych, co czyni je multipotencjalnymi – co stanowi wyraźną różnicę między komórkami pluripotencjalnymi komórki macierzyste występujące w rozwoju embrionalnym. Komórki neuroepitelialne przechodzą mitozę, generując więcej komórek neuroepitelialnych, radialnych komórek glejowych lub komórek progenitorowych , przy czym te dwie ostatnie różnicują się w neurony lub komórki glejowe. Komórki neuroepitelialne przechodzą dwie różne formy mitozy: asymetryczny podział różnicujący i symetryczny podział płodny. Asymetryczny podział komórkowy skutkuje powstaniem dwóch różnych odmian komórek potomnych (tj. komórka neuroepitelialna dzieli się na komórkę glejową radialną i inną komórkę neuroepitelialną), podczas gdy wersja symetryczna daje identyczne komórki potomne. Efekt ten jest spowodowany orientacją wrzeciona mitotycznego , które znajduje się w tylnej lub przedniej części komórki mitotycznej, a nie w centrum, w którym znajduje się podczas podziału symetrycznego. Komórki progenitorowe i komórki gleju promienistego reagują na zewnątrzkomórkowe czynniki troficzne - takie jak rzęskowy czynnik neurotroficzny (CNTF), cytokiny lub neuregulina 1 (NRG1) – który może określić, czy komórki będą się różnicować w neurony czy glej. Ogólnie rzecz biorąc, neurogeneza jest regulowana zarówno przez wiele różnych szlaków regulacyjnych w OUN, jak i kilka innych czynników, od genów po bodźce zewnętrzne, takie jak indywidualne zachowanie człowieka. Duża, wzajemnie połączona sieć odpowiedzi regulacyjnych działa w celu precyzyjnego dostrojenia odpowiedzi zapewnianych przez nowo utworzone neurony.
Neurogeneza w naprawie neuronów
Neurogeneza w dorosłym mózgu jest często związana z chorobami pogarszającymi OUN, takimi jak choroba Huntingtona , choroba Alzheimera i choroba Parkinsona . Podczas gdy neurogeneza dorosłych jest zwiększona w hipokampie u pacjentów z tymi chorobami, to, czy jej skutki są regeneracyjne, czy niejednoznaczne, dopiero się okaże. Osoby z tymi chorobami również często wykazują zmniejszone zdolności węchowe, a także zmniejszoną aktywność poznawczą w hipokampie, obszarach specyficznych dla neurogenezy. Geny związane z tymi chorobami, takie jak α-synukleina , presenilina 1 , MAPT (białko tau związane z mikrotubulami) i huntingtyna są również często związane z plastycznością mózgu i jego modyfikacją. Neuroplastyczność jest związana z neurogenezą w sposób komplementarny. Nowe neurony generowane przez komórki neuroepitelialne, komórki progenitorowe i komórki glejowe radialne nie przetrwają, jeśli nie będą w stanie zintegrować się z systemem poprzez nawiązanie połączeń z nowymi sąsiadami. Prowadzi to również do wielu kontrowersyjnych koncepcji, takich jak terapia neurogenna polegająca na przeszczepianiu miejscowych komórek progenitorowych do uszkodzonego obszaru.
Choroby towarzyszące
Dysembrioplastyczny guz neuroepitelialny (DNT)
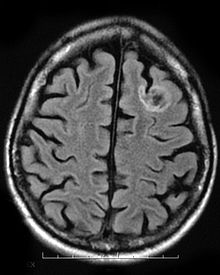
guz neuroepitelialny jest rzadkim, łagodnym nowotworem , który dotyka dzieci i młodzież w wieku poniżej dwudziestu lat. Guz występuje w tkance pokrywającej mózg i rdzeń kręgowy. Objawy guza zależą od jego lokalizacji, ale większość dzieci doświadcza napadów , których nie można kontrolować za pomocą leków. DNT jest zwykle leczony inwazyjną operacją , a pacjenci są zwykle zdolni do pełnego wyzdrowienia, z niewielkimi lub zerowymi skutkami długoterminowymi.
Torbiele neuroepitelialne
Torbiele neuroepitelialne, znane również jako cysty koloidowe , rozwijają się u osób w wieku od 20 do 50 lat i są stosunkowo rzadkie u osób poniżej dwudziestego roku życia. Torbiele to łagodne guzy, które zwykle pojawiają się w przedniej komorze trzeciej . Torbiele występują w nabłonku narażając ich pacjentów na wodogłowie obturacyjne , zwiększone ciśnienie śródczaszkowe i rzadko krwotok śródtorbielowaty. Wynika to z powiększania się torbieli, powodując wydzielanie przez nabłonek dodatkowego płynu śluzowego. Torbiele są zwykle wykrywane przypadkowo lub u pacjentów z objawami wodogłowia. Większe torbiele są operowane, podczas gdy mniejsze torbiele, które nie są obturacyjne, można pozostawić w spokoju.
Guzy oligodendroglejowe
Guzy skąpodenroglejowe manifestują się w komórkach glejowych, które są odpowiedzialne za podtrzymywanie i ochronę komórek nerwowych w mózgu. Guz rozwija się na oligodendrocytach i zwykle znajduje się w mózgu wokół płatów czołowych lub skroniowych . Guzy mogą albo rosnąć powoli w dobrze zróżnicowany sposób, opóźniając wystąpienie objawów, albo mogą rosnąć szybko, tworząc skąpodrzewiaka anaplastycznego . Objawy tego typu guza obejmują bóle głowy i problemy ze wzrokiem. Dodatkowo zablokowanie komór może powodować nagromadzenie płyn mózgowo-rdzeniowy powodujący obrzęk wokół guza. Lokalizacja guza może również wpływać na objawy, ponieważ guzy płata czołowego mogą powodować stopniowe zmiany nastroju lub osobowości, podczas gdy guzy płata skroniowego powodują problemy z koordynacją i mową.
Trwają badania
Chimery neuronowe
Naukowcom udało się stworzyć neuronowe chimery , łącząc neurony, które rozwinęły się z embrionalnych komórek macierzystych, z komórkami glejowymi, które również pochodzą z embrionalnych komórek macierzystych . Te chimery nerwowe zapewniają naukowcom wszechstronny sposób badania mechanizmów molekularnych stojących za naprawą i regeneracją komórek za pośrednictwem prekursorowych komórek neuroepitelialnych i, miejmy nadzieję, rzucą światło na możliwą naprawę układu nerwowego w warunkach klinicznych. Próbując zidentyfikować kluczowe cechy, które odróżniają komórki neuroepitelialne od ich komórek progenitorowych , naukowcy zidentyfikowali włókno pośrednie która została wyrażona przez 98% komórek neuroepitelialnych cewy nerwowej, ale żadna z ich komórek progenitorowych. Po tym odkryciu stało się jasne, że wszystkie trzy typy komórek w układzie nerwowym powstały z jednorodnej populacji komórek macierzystych. Aby umożliwić kliniczną naprawę neuronów, naukowcy musieli dalej scharakteryzować regionalną determinację komórek macierzystych podczas rozwoju mózgu, określając, jakie czynniki powodują, że prekursor staje się jednym lub drugim. Chociaż dokładne czynniki prowadzące do różnicowania nie są znane, naukowcy wykorzystali chimery nerwowe człowieka i szczura do zbadania rozwoju ludzkich neuronów i komórek glejowych w modelu zwierzęcym. Te neuronowe chimery pozwoliły naukowcom przyjrzeć się chorobom neurologicznym w modelu zwierzęcym, w którym można kontrolować traumatyczne i reaktywne zmiany. Ostatecznie naukowcy mają nadzieję, że będą w stanie wykorzystać informacje uzyskane z tych eksperymentów z chimerami neuronowymi do naprawy obszarów mózgu dotkniętych zaburzeniami ośrodkowego układu nerwowego. Jednak problem porodu nadal nie został rozwiązany, ponieważ wykazano, że chimery nerwowe krążą w komorach i włączają się do wszystkich części OUN. Dzięki znalezieniu środowiskowych wskazówek różnicowania przeszczep prekursorów neuroepitelialnych mógłby być stosowany w leczeniu wielu chorób, w tym stwardnienie rozsiane , choroba Huntingtona i choroba Parkinsona. Dalsze badania neuronalnych komórek chimerowych i chimerycznych mózgów dostarczą dowodów na manipulowanie właściwymi genami i zwiększenie skuteczności naprawy przeszczepów nerwowych.
Depresja
Badania nad depresją wskazują, że jeden z głównych czynników przyczynowych depresji, stres, również wpływa na neurogenezę. To powiązanie doprowadziło naukowców do postulowania, że depresja może być wynikiem zmian poziomu neurogenezy w dorosłym mózgu, szczególnie w zakręcie zębatym . Badania wskazują, że stres wpływa na neurogenezę poprzez zwiększenie stężenia glukokortykoidów i zmniejszenie neuroprzekaźników, takich jak serotonina . Efekty te zostały dodatkowo zweryfikowane poprzez wywołanie stresu u zwierząt laboratoryjnych, co skutkowało obniżeniem poziomu neurogenezy. Dodatkowo, nowoczesne terapie, które leczą depresję, również promują neurogenezę. Trwające badania mają na celu dalszą weryfikację tego związku i zdefiniowanie mechanizmu, dzięki któremu zachodzi. Może to potencjalnie prowadzić do lepszego zrozumienia rozwoju depresji, a także przyszłych metod leczenia.
Zobacz też
Linki zewnętrzne
- komórki neuroepitelialne + w amerykańskiej National Library of Medicine Medical Subject Headings (MeSH)