Gastrulacja
| Gastrulacja | |
|---|---|
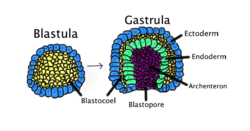 Gastrulacja występuje, gdy blastula , złożona z jednej warstwy, zagina się do wewnątrz i powiększa, tworząc gastrulę. Ten schemat jest oznaczony kolorami: ektoderma , niebieski; endoderma , zielona; blastocoel (woreczek żółtkowy), żółty; i archenteron (jelito pierwotne), fioletowy.
| |
| Identyfikatory | |
| Siatka | D054262 |
| Terminologia anatomiczna | |
Gastrulacja jest etapem we wczesnym rozwoju embrionalnym większości zwierząt , podczas którego blastula (jednowarstwowa pusta kula komórek ) lub u ssaków blastocysta jest reorganizowana w wielowarstwową strukturę znaną jako gastrula . Przed gastrulacją zarodek jest ciągłą nabłonkową warstwą komórek; pod koniec gastrulacji zarodek rozpoczął różnicowanie w celu ustanowienia odrębnych linii komórkowych , ustalenia podstawowych osi ciała (np. grzbietowo-brzusznej , przednio-tylnej ) i zinternalizował jeden lub więcej typów komórek, w tym prospektywne jelito .
W organizmach triploblastycznych gastrula jest trójwarstwowa (trójwarstwowa). Te trzy listki zarodkowe to ektoderma (warstwa zewnętrzna), mezoderma (warstwa środkowa) i endoderma (warstwa wewnętrzna). W diploblastycznych , takich jak Cnidaria i Ctenophora , gastrula ma tylko ektodermę i endodermę. Te dwie warstwy są czasami nazywane hipoblastem i epiblastem . Gąbki nie przechodzą przez stadium gastruli, dlatego wśród wszystkich zwierząt są podstawowe.
Gastrulacja ma miejsce po rozszczepieniu i utworzeniu blastuli lub blastocysty. Po gastrulacji następuje organogeneza , kiedy poszczególne narządy rozwijają się w nowo utworzonych listkach zarodkowych. Każda warstwa daje początek określonym tkankom i narządom w rozwijającym się zarodku.
- Z ektodermy powstaje naskórek , układ nerwowy i grzebień nerwowy u kręgowców.
- Z endodermy powstaje nabłonek układu pokarmowego i oddechowego oraz narządy związane z układem pokarmowym , takie jak wątroba i trzustka .
- Mezoderma daje początek wielu typom komórek, takich jak mięśnie , kości i tkanka łączna . U kręgowców pochodne mezodermy obejmują strunę grzbietową , serce , krew i naczynia krwionośne , chrząstkę żeber i kręgów oraz skórę właściwą .
Po gastrulacji komórki w ciele są albo zorganizowane w arkusze połączonych komórek (jak w nabłonku ), albo w siatkę izolowanych komórek, takich jak mezenchym .
Chociaż wzorce gastrulacji wykazują ogromne zróżnicowanie w całym królestwie zwierząt, są one ujednolicone przez pięć podstawowych typów ruchów komórek, które występują podczas gastrulacji:
Terminy „gastrula” i „gastrulacja” zostały ukute przez Ernsta Haeckela w jego pracy „Biologia gąbek wapiennych” z 1872 roku . Lewisowi Wolpertowi , pionierowi biologii rozwojowej w tej dziedzinie, przypisuje się uwagę, że „to nie narodziny, małżeństwo czy śmierć, ale gastrulacja jest naprawdę najważniejszym okresem w twoim życiu”.
Systemy modelowe
Gastrulacja jest bardzo zmienna w całym królestwie zwierząt, ale ma podstawowe podobieństwa. Gastrulacja była badana na wielu zwierzętach, ale niektóre modele były używane dłużej niż inne. Ponadto łatwiej jest badać rozwój zwierząt, które rozwijają się poza matką. organizmów modelowych , których gastrulacja została poznana najdokładniej, należą mięczaki , jeżowce , żaby i kurczaki . Układem modelowym człowieka jest gastruloid .
Protostomy kontra deuterostomy
Rozróżnienie między protostomami i deuterostomami opiera się na kierunku, w którym rozwija się ujście (stomia) w stosunku do blastoporu . Protostom pochodzi od greckiego słowa protostoma oznaczającego „pierwsze usta” (πρῶτος + στόμα), podczas gdy etymologia Deuterostome to „drugie usta” od słów drugie i usta (δεύτερος + στόμα). [ potrzebne źródło ]
Główne różnice między deuterostomami i protostomami można znaleźć w rozwoju embrionalnym :
- Usta/odbyt
- W rozwoju protostomu pierwszy otwór w rozwoju, blastopor, staje się pyskiem zwierzęcia .
- W rozwoju deuterostomu blastopor staje się odbytem zwierzęcia .
-
Łupliwość
- Protostomy mają tak zwane rozszczepienie spiralne , które jest zdeterminowane , co oznacza, że los komórek jest określany podczas ich tworzenia.
- Deuterostomy mają tak zwane rozszczepienie promieniowe , które jest nieokreślone .
Jeżowce
Jeżowce są ważnymi organizmami modelowymi w biologii rozwojowej od XIX wieku. Ich gastrulacja jest często uważana za archetyp deuterostomów bezkręgowców. Eksperymenty wraz z symulacjami komputerowymi posłużyły do zdobycia wiedzy na temat gastrulacji u jeżowca. Niedawne symulacje wykazały, że polaryzacja płaskich komórek jest wystarczająca do napędzania gastrulacji jeżowca.
Oznaczanie listka zarodkowego
Jeżowce wykazują wysoce stereotypowe wzorce rozszczepienia i losy komórek. MRNA zdeponowane przez matkę ustanawiają centrum organizacyjne zarodka jeżowca. Kanoniczna Wnt i Delta-Notch stopniowo oddziela progresywną endodermę i mezodermę.
Internalizacja komórki
U jeżowców pierwszymi komórkami, które ulegają internalizacji, są pierwotne komórki mezenchymalne (PMC), które mają los szkieletogenny i wnikają na etapie blastuli. Gastrulacja - internalizacja przyszłej endodermy i mezodermy nieszkieletogennej - rozpoczyna się wkrótce potem wraz z inwaginacją i innymi przegrupowaniami komórek bieguna wegetatywnego , które stanowią około 30% ostatecznej długości archenteronu . Ostateczna długość jelita zależy od rearanżacji komórek w archenteronie.
płazy
Rodzaj żaby Xenopus został wykorzystany jako organizm modelowy do badania gastrulacji .
Łamanie symetrii
Plemniki dostarczają jednego z dwóch astrów mitotycznych potrzebnych do zakończenia pierwszego rozszczepienia. Plemnik może dostać się w dowolne miejsce zwierzęcej połowy jaja, ale jego dokładny punkt wejścia złamie promieniową symetrię jaja, organizując cytoszkielet . Przed pierwszym rozszczepieniem kora jaja obraca się względem wewnętrznej cytoplazmy dzięki skoordynowanemu działaniu mikrotubul w procesie znanym jako rotacja korowa. To przemieszczenie powoduje kontakt obciążonych przez matkę determinantów losu komórki z cytoplazmy równikowej i kory roślinnej, a razem te determinanty tworzą organizatora . W ten sposób organizatorem stanie się obszar po stronie roślinnej naprzeciw punktu wejścia nasienia. Hilde Mangold , pracująca w laboratorium Hansa Spemanna , wykazała, że ten specjalny „organizator” zarodka jest niezbędny i wystarczający do wywołania gastrulacji.
Oznaczanie listka zarodkowego
Specyfikacja endodermy zależy od przegrupowania determinant zdeponowanych u matki, co prowadzi do nuklearyzacji beta-kateniny . Mezoderma jest indukowana przez sygnalizację z domniemanej endodermy do komórek, które w przeciwnym razie stałyby się ektodermą.
Internalizacja komórki
Warga grzbietowa blastoporu jest mechanicznym motorem gastrulacji. Pierwszą oznaką wgłobienia widzianą u żaby jest warga grzbietowa. [ potrzebne źródło ]
Sygnalizacja komórkowa
U żaby Xenopus jednym z sygnałów jest kwas retinowy (RA). Sygnalizacja RA w tym organizmie może wpływać na tworzenie endodermy iw zależności od czasu sygnalizacji może decydować o losie trzustki, jelit lub układu oddechowego. Inne sygnały, takie jak Wnt i BMP, również odgrywają rolę w losach układu oddechowego Xenopus poprzez aktywację znaczników linii komórkowej.
owodniowce
Przegląd
U owodniowców (gadów, ptaków i ssaków) gastrulacja obejmuje tworzenie blastoporu, otworu do archenteronu . Należy zauważyć, że blastopor nie jest otworem do blastocelu , przestrzeni wewnątrz blastuli , ale reprezentuje nowe zagłębienie, które popycha istniejące powierzchnie blastuli razem. W owodniowcach gastrulacja zachodzi w następującej kolejności: (1) zarodek staje się asymetryczny ; (2) prymitywna smuga ; (3) komórki z epiblastu w prążku pierwotnym przechodzą przemianę nabłonkową w mezenchymalną i wnikają do prążka pierwotnego , tworząc listki zarodkowe .
Łamanie symetrii
W ramach przygotowań do gastrulacji zarodek musi stać się asymetryczny zarówno wzdłuż osi bliższej i dalszej, jak i osi przednio-tylnej . Oś bliższa-dystalna powstaje, gdy komórki zarodka tworzą „cylinder jajowy”, który składa się z tkanek pozazarodkowych, z których powstają struktury takie jak łożysko na bliższym końcu i epiblast na dalszym końcu. Wiele szlaków sygnałowych przyczynia się do tej reorganizacji, w tym BMP , FGF , węzłowe i Wnt . Endoderma trzewna otacza epiblast . Dalsza trzewna (DVE) migruje do przedniej części zarodka, tworząc przednią endodermę trzewną (AVE). To łamie symetrię przednio-tylną i jest regulowane przez sygnalizację węzłową .

Oznaczanie listka zarodkowego
Prymitywna smuga powstaje na początku gastrulacji i znajduje się na styku tkanki pozazarodkowej z epiblastem na tylnej stronie zarodka iw miejscu ingresji . Tworzenie prymitywnej smugi zależy od sygnalizacji węzłowej w sierpie Kollera w komórkach przyczyniających się do prymitywnej smugi i sygnalizacji BMP4 z tkanki pozazarodkowej. Ponadto Cer1 i Lefty1 ograniczają prymitywną smugę do odpowiedniej lokalizacji poprzez antagonizowanie sygnalizacji węzłowej . Region zdefiniowany jako prymitywna smuga nadal rośnie w kierunku dystalnej końcówki.
We wczesnych stadiach rozwoju prymitywna smuga jest strukturą, która ustanowi dwustronną symetrię , określi miejsce gastrulacji i zainicjuje tworzenie listka zarodkowego. Aby utworzyć smugę, gady, ptaki i ssaki układają komórki mezenchymalne wzdłuż przyszłej linii środkowej, ustanawiając pierwszą oś embrionalną, a także miejsce, w którym komórki będą wnikać i migrować podczas procesu gastrulacji i tworzenia listka zarodkowego. Prymitywna smuga rozciąga się przez tę linię środkową i tworzy przednio-tylną oś ciała, stając się pierwszym zdarzeniem naruszającym symetrię w zarodku i wyznaczającym początek gastrulacji. Proces ten obejmuje wnikanie prekursorów mezodermy i endodermy oraz ich migrację do ich ostatecznej pozycji, gdzie różnicują się w trzy listki zarodkowe. Lokalizacja adhezji komórkowej i cząsteczki sygnałowej beta-kateniny ma kluczowe znaczenie dla prawidłowego tworzenia regionu organizatora, który jest odpowiedzialny za inicjowanie gastrulacji.
Internalizacja komórki
Aby komórki mogły przejść z nabłonka epiblastu przez pierwotną smugę , aby utworzyć nową warstwę, komórki muszą przejść przemianę nabłonkową w mezenchymalną (EMT), aby utracić swoje cechy nabłonkowe, takie jak adhezja komórka-komórka . Sygnalizacja FGF jest niezbędna do prawidłowego działania EMT. FGFR1 jest potrzebny do regulacji w górę SNAI1 , która reguluje w dół E-kadherynę , powodując utratę adhezji komórek. Po EMT komórki wnikają przez prymitywną smugę i rozprzestrzeniają się, tworząc nową warstwę komórek lub łącząc istniejące warstwy. FGF8 bierze udział w procesie tego rozprzestrzeniania się z prymitywnej smugi .
Sygnalizacja komórkowa
Istnieją pewne sygnały, które odgrywają rolę w określaniu i tworzeniu trzech listków zarodkowych, takie jak FGF, RA i Wnt. U ssaków, takich jak myszy, sygnalizacja RA może odgrywać rolę w tworzeniu płuc. Jeśli nie ma wystarczającej ilości RA, wystąpi błąd w produkcji płuc. RA reguluje również wydolność oddechową w tym modelu myszy. [ potrzebne źródło ]
Sygnalizacja komórkowa napędzająca gastrulację
Podczas gastrulacji komórki różnicują się w ektodermę lub mesendodermę , która następnie rozdziela się na mezodermę i endodermę. Endoderma i mezoderma tworzą się z powodu sygnalizacji węzłowej . Sygnalizacja węzłowa wykorzystuje ligandy należące do TGFβ . Te ligandy będą sygnalizować transbłonowe receptory kinazy serynowo/treoninowej, a to z kolei będzie fosforylować Smad2 i Smad3 . Białko to przyłączy się następnie do Smad4 i przeniesie do jądra, gdzie geny mesendodermy zaczną być transkrybowane. Szlak Wnt wraz z β-kateniną odgrywa kluczową rolę w sygnalizacji węzłowej i tworzeniu endodermy. Czynniki wzrostu fibroblastów (FGF), kanoniczny szlak Wnt, białko morfogenetyczne kości (BMP) i kwas retinowy (RA) są ważne w tworzeniu i rozwoju endodermy. FGF są ważne w produkcji homeoboksu , który reguluje wczesny rozwój anatomiczny. Sygnalizacja BMP odgrywa rolę w wątrobie i promuje los wątroby. Sygnalizacja RA indukuje również geny homeoboksów, takie jak Hoxb1 i Hoxa5. U myszy, jeśli brakuje sygnalizacji RA, mysz nie rozwinie płuc. Sygnalizacja RA ma również wiele zastosowań w tworzeniu narządów łuków gardłowych, jelita przedniego i jelita grubego.
Gastrulacja in vitro
Podejmowano szereg prób zrozumienia procesów gastrulacji przy użyciu technik in vitro , równolegle i uzupełniająco badania na zarodkach, zwykle poprzez wykorzystanie technik hodowli komórek 2D i 3D ( organoidy embrionalne ) z wykorzystaniem embrionalnych komórek macierzystych (ESC) lub indukowanych pluripotencjalne komórki macierzyste (iPSC). Wiąże się to z wieloma wyraźnymi zaletami stosowania protokołów opartych na kulturach tkankowych, z których niektóre obejmują zmniejszenie kosztów związanych z nimi in vivo (a tym samym ograniczenie, zastąpienie i udoskonalenie wykorzystywania zwierząt w doświadczeniach; zasada 3R ), możliwość dokładnego stosować agonistów/antagonistów w określony przestrzennie i czasowo sposób, co może być technicznie trudne do wykonania podczas Gastrulacji. Jednak ważne jest, aby odnieść obserwacje w hodowli do procesów zachodzących w zarodku dla kontekstu.
Aby to zilustrować, kierowane różnicowanie mysich ESC zaowocowało wygenerowaniem prymitywnych komórek przypominających smugi, które wykazują wiele cech komórek epiblastów, które przechodzą przez prymitywną smugę ( np . przejście ), a ludzkie ESC hodowane na mikrowzorach, traktowane BMP4 , mogą generować przestrzenny wzór różnicowania podobny do ułożenia listków zarodkowych w ludzkim zarodku. Wreszcie, stosując techniki 3D zarodków i organoidów , małe agregaty mysich ESC ( organoidy embrionalne lub gastruloidy ) są w stanie pokazać szereg procesów wczesnego rozwoju zarodków ssaków, takich jak łamanie symetrii, polaryzacja ekspresji genów, gastrulacja ruchy podobne do ruchów, wydłużenie osiowe i generowanie wszystkich trzech osi embrionalnych (oś przednio-tylna, grzbietowo-brzuszna i lewa-prawa).
in vitro odbywa się w laboratorium. Proces zapłodnienia in vitro polega na usunięciu dojrzałych komórek jajowych z jajników i umieszczeniu ich w pożywce hodowlanej, gdzie zostają zapłodnione plemnikami. W hodowli powstanie zarodek. 14 dni po zapłodnieniu tworzy się prymitywna smuga. Tworzenie prymitywnej passy było znane w niektórych krajach jako „indywidualność człowieka”. Oznacza to, że embrion jest teraz bytem samym w sobie, jest własną jednostką. Kraje, które w to wierzą, stworzyły 14-dniową regułę, zgodnie z którą nielegalne jest badanie lub eksperymentowanie na embrionie ludzkim po upływie 14 dni in vitro . Badania przeprowadzono na pierwszych 14 dniach zarodka, ale żadne znane badania nie zostały przeprowadzone po 14 dniach. Przy obowiązującej regule, zarodki myszy są wykorzystywane do zrozumienia rozwoju po 14 dniach, jednak istnieją różnice w rozwoju między myszami a ludźmi.
Zobacz też
- blastocysta
- Deuterostom
- Mapowanie losu
- Prymitywny węzeł
- inwazja
- neurulacja
- Protostom
- Rotacja roślinna
Notatki
Bibliografia
-
Arnold, Sebastian J.; Robertson, Elizabeth J. (2009). „Zobowiązanie: alokacja linii komórkowych i modelowanie osi we wczesnym zarodku myszy”. Nat. Wielebny Mol. Biol komórkowy. 10 (2): 91–103. doi : 10.1038/nrm2618 . PMID 19129791 . S2CID 94174 .

- Catala, Martin (2005). „Embriologia kręgosłupa i rdzenia kręgowego” . W Tortori-Donati, Paolo; i in. (red.). Neuroradiologia dziecięca: Mózg . Skoczek. ISBN 978-3-540-41077-5 .
- Ereskovsky, Alexander V. (2010). Embriologia porównawcza gąbek . Skoczek. ISBN 978-90-481-8574-0 .
- Gilbert, Scott F. (2010). Biologia rozwojowa (wyd. Dziewiąte). Współpracownicy Sinauera. ISBN 978-0-87893-558-1 .
- Hall, Brian Keith (1998). „8.3.3 Gastrula i gastrulacja” . Ewolucyjna biologia rozwoju (wyd. 2). Holandia: Kluwer Academic Publishers. ISBN 978-0-412-78580-1 .
- Harrison, Lionel G. (2011). Kształtowanie życia: generowanie wzoru biologicznego . Wydawnictwo Uniwersytetu Cambridge. ISBN 978-0-521-55350-6 .
- McGeady, Thomas A., wyd. (2006). „Gastrulacja”. Embriologia weterynaryjna . Wiley-Blackwell. ISBN 978-1-4051-1147-8 .
- Mundlos, Stefan (2009). „Działanie genów: genetyka rozwojowa”. W Speicher, Michael; i in. (red.). Vogel and Motulsky's Human Genetics: Problems and Approaches (wyd. 4). Skoczek. doi : 10.1007/978-3-540-37654-5 . ISBN 978-3-540-37653-8 .
-
Tam, Patrick PL; Behringer, Richard R. (1997). „Gastrulacja myszy: tworzenie planu budowy ciała ssaków” . Mech. Dev. 68 (1–2): 3–25. doi : 10.1016/S0925-4773(97)00123-8 . PMID 9431800 . S2CID 14052942 .

Dalsza lektura
- Baron, Margaret H. (2001). „Embrionalna indukcja hematopoezy i waskulogenezy u ssaków” . W Zon, Leonard I. (red.). Hematopoeza: podejście rozwojowe . Oxford University Press. ISBN 978-0-19-512450-7 .
- Cullen, KE (2009). „embriologia i wczesny rozwój zwierząt” . Encyklopedia nauk przyrodniczych, tom 2 . Baza informacji. ISBN 978-0-8160-7008-4 .
-
Forgács, G. & Newman, Stuart A. (2005). „Tworzenie łupliwości i blastuli” . Fizyka biologiczna rozwijającego się zarodka . Wydawnictwo Uniwersytetu Cambridge. Bibcode : 2005bpde.book.....F . ISBN 978-0-521-78337-8 .
{{ cite book }}: CS1 maint: używa parametru autorów ( link ) -
Forgács, G. & Newman, Stuart A. (2005). „Morfogeneza nabłonka: gastrulacja i neurulacja” . Fizyka biologiczna rozwijającego się zarodka . Wydawnictwo Uniwersytetu Cambridge. Bibcode : 2005bpde.book.....F . ISBN 978-0-521-78337-8 .
{{ cite book }}: CS1 maint: używa parametru autorów ( link ) -
Hart, Nathan H. & Fluck, Richard A. (1995). „Epibolia i gastrulacja” . W Capco, David (red.). Mechanizmy cytoszkieletu podczas rozwoju zwierząt . Prasa akademicka. ISBN 978-0-12-153131-7 .
{{ cite book }}: CS1 maint: używa parametru autorów ( link ) - Knust, Elżbieta (1999). „Ruchy gastrulacji” . W Birchmeier, Walter; Birchmeier, Carmen (red.). Morfogeneza nabłonka w rozwoju i chorobie . Prasa CRC. s. 152–153. ISBN 978-90-5702-419-1 .
- Kunz, Yvette W. (2004). „Gastrulacja” . Biologia rozwoju ryb Teleost . Skoczek. ISBN 978-1-4020-2996-7 .
- Naród, James L., wyd. (2009). „Gastrulacja” . Fizjologia i biochemia owadów . Prasa CRC. ISBN 978-0-8493-1181-9 .
- Ross, Lawrence M.; Lamperti, Edward D., wyd. (2006). „Ontogeneza człowieka: gastrulacja, neurulacja i tworzenie somitów” . Atlas anatomii: anatomia ogólna i układ mięśniowo-szkieletowy . Thieme. ISBN 978-3-13-142081-7 .
-
Sanes, Dan H. i in. (2006). „Wczesna embriologia metazoanów” . Rozwój układu nerwowego (wyd. 2). Prasa akademicka. s. 1–2. ISBN 978-0-12-618621-5 .
{{ cite book }}: CS1 maint: używa parametru autorów ( link ) -
Stanger, Ben Z. & Melton, Douglas A. (2004). „Rozwój pochodnych endodermalnych w płucach, wątrobie, trzustce i jelitach” . W Epstein, Charles J.; i in. (red.). Wrodzone wady rozwojowe: molekularne podstawy klinicznych zaburzeń morfogenezy . Oxford University Press. ISBN 978-0-19-514502-1 .
{{ cite book }}: CS1 maint: używa parametru autorów ( link )
Linki zewnętrzne
- Animacje gastrulacji zarchiwizowane 20.10.2015 w Wayback Machine
- Ilustracje i filmy gastrulacji z Gastrulation: From Cells To Embryo pod redakcją Claudio Sterna
- Film przedstawiający gastrulację żaby
- )
