Wysokosprawna chromatografia cieczowa
 Konfiguracja HPLC; Od lewej do prawej: Urządzenie pompujące generujące gradient dwóch różnych rozpuszczalników – wzmocniona stalą kolumna i detektor do pomiaru absorbancji.
| |
| Akronim | HPLC |
|---|---|
| Klasyfikacja | Chromatografia |
| Anality |
cząsteczki organiczne biomolekuły jony polimery |
| Inne techniki | |
| Powiązany |
Chromatografia Wodna chromatografia normalnofazowa Chromatografia oddziaływań hydrofilowych Chromatografia jonowymienna Chromatografia wykluczania wielkości Micelarna chromatografia cieczowa |
| Pisany z łącznikiem | Chromatografia cieczowa-spektrometria mas |
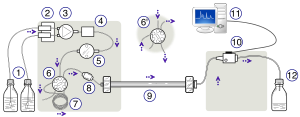
Wysokosprawna chromatografia cieczowa ( HPLC ), wcześniej nazywana wysokociśnieniową chromatografią cieczową , jest techniką stosowaną w chemii analitycznej do rozdzielania, identyfikacji i oznaczania ilościowego każdego składnika mieszaniny. Opiera się na pompach, które przepuszczają ciekły rozpuszczalnik pod ciśnieniem zawierający mieszaninę próbek przez kolumnę wypełnioną stałym adsorbentem . Każdy składnik w próbce oddziałuje nieco inaczej z materiałem adsorbującym, powodując różne prędkości przepływu dla różnych składników i prowadząc do rozdzielenia składników podczas ich wypływania z kolumny.
HPLC została wykorzystana do produkcji ( np . podczas procesu produkcji produktów farmaceutycznych i biologicznych), prawnej ( np . wykrywanie leków poprawiających wydajność w moczu), badawczych ( np . oddzielanie składników złożonej próbki biologicznej lub podobnych syntetycznych substancji chemicznych od siebie) i medycznych ( np . wykrywanie poziomów witaminy D w surowicy krwi).
Chromatografię można opisać jako proces przenoszenia masy obejmujący adsorpcję . HPLC opiera się na pompach, które przepuszczają ciecz pod ciśnieniem i mieszaninę próbek przez kolumnę wypełnioną adsorbentem, co prowadzi do rozdzielenia składników próbki. Aktywny składnik kolumny, adsorbent, jest zwykle materiałem ziarnistym wykonanym z cząstek stałych ( np . krzemionka , polimery itp.), o wielkości 2–50 μm. Składniki mieszaniny próbek są oddzielone od siebie ze względu na różne stopnie oddziaływania z cząstkami adsorbentu. Ciecz pod ciśnieniem jest zazwyczaj mieszaniną rozpuszczalników ( np . wody, acetonitrylu i/lub metanolu) i jest określana jako „faza ruchoma”. Jego skład i temperatura odgrywają główną rolę w procesie separacji, wpływając na interakcje zachodzące między składnikami próbki a adsorbentem. Oddziaływania te mają charakter fizyczny, na przykład hydrofobowe (dyspersyjne), dipolowo-dipolowe i jonowe, najczęściej kombinowane.
HPLC różni się od tradycyjnej („niskociśnieniowej”) chromatografii cieczowej ponieważ ciśnienia operacyjne są znacznie wyższe (50–350 barów), podczas gdy zwykła chromatografia cieczowa zazwyczaj opiera się na sile grawitacji w celu przepuszczenia fazy ruchomej przez kolumnę. Ze względu na niewielką ilość próbki rozdzielanej w analitycznej HPLC, typowe wymiary kolumny to 2,1–4,6 mm średnicy i 30–250 mm długości. Również kolumny HPLC są wykonane z mniejszych cząstek adsorbentu (2–50 μm średniej wielkości cząstek). Daje to HPLC doskonałą zdolność rozdzielczą (zdolność do rozróżniania związków) podczas rozdzielania mieszanin, co czyni ją popularną techniką chromatograficzną.
Schemat instrumentu HPLC zazwyczaj zawiera odgazowywacz, próbnik, pompy i detektor. Próbnik wprowadza mieszaninę próbek do strumienia fazy ruchomej, który przenosi ją do kolumny. Pompy zapewniają pożądany przepływ i skład fazy ruchomej przez kolumnę. Detektor generuje sygnał proporcjonalny do ilości składnika próbki wychodzącego z kolumny, co pozwala na ilościową analizę składników próbki. Cyfrowy mikroprocesor i oprogramowanie użytkownika sterują urządzeniem HPLC i zapewniają analizę danych. Niektóre modele pomp mechanicznych w instrumencie HPLC mogą mieszać ze sobą wiele rozpuszczalników w proporcjach zmieniających się w czasie, generując gradient składu w fazie ruchomej. W powszechnym użyciu są różne detektory, takie jak UV/Vis , matryca fotodiodowa (PDA) lub oparte na spektrometrii mas . Większość urządzeń HPLC ma również piec kolumnowy, który umożliwia regulację temperatury, w której przeprowadza się rozdział.
Operacja
Mieszanina próbek do rozdzielenia i analizy jest wprowadzana w dyskretnej małej objętości (zwykle w mikrolitrach) do strumienia fazy ruchomej przesączającej się przez kolumnę. Składniki próbki przemieszczają się przez kolumnę z różnymi prędkościami, które są funkcją specyficznych oddziaływań fizycznych z adsorbentem (zwanym też fazą stacjonarną). Szybkość każdego składnika zależy od jego natury chemicznej, rodzaju fazy stacjonarnej (kolumny) oraz składu fazy ruchomej. Czas, w którym określony analit jest eluowany (wychodzi z kolumny) nazywany jest czasem jego retencji. Czas retencji mierzony w określonych warunkach jest cechą identyfikującą dany analit.
Dostępnych jest wiele różnych typów kolumn wypełnionych adsorbentami o różnej wielkości cząstek, porowatości i chemii powierzchni. Użycie materiałów wypełniających o mniejszym rozmiarze cząstek wymaga zastosowania wyższego ciśnienia roboczego („przeciwciśnienia”) i zazwyczaj poprawia rozdzielczość chromatograficzną (stopień rozdzielenia pików między kolejnymi analitami wychodzącymi z kolumny). Cząsteczki sorbentu mogą mieć charakter hydrofobowy lub polarny.
Powszechnie stosowane fazy ruchome obejmują dowolne mieszające się kombinacje wody z różnymi rozpuszczalnikami organicznymi (najczęstsze to acetonitryl i metanol ). Niektóre techniki HPLC wykorzystują bezwodne fazy ruchome (patrz chromatografia z normalną fazą poniżej). Wodny składnik fazy ruchomej może zawierać kwasy (takie jak kwas mrówkowy, fosforowy lub trifluorooctowy). ) lub sole ułatwiające rozdzielanie składników próbki. Skład fazy ruchomej można utrzymywać na stałym poziomie („tryb elucji izokratycznej”) lub zmieniać („tryb elucji gradientowej”) podczas analizy chromatograficznej. Elucja izokratyczna jest zazwyczaj skuteczna w rozdzielaniu składników próbki, które bardzo różnią się pod względem powinowactwa do fazy stacjonarnej. W elucji gradientowej skład fazy ruchomej zmienia się typowo od niskiej do wysokiej siły elucji. Siła elucji fazy ruchomej jest odzwierciedlona przez czasy retencji analitu, przy czym wysoka siła elucji powoduje szybką elucję (= krótkie czasy retencji). Typowy profil gradientu w chromatografii z odwróconymi fazami może zaczynać się od 5% acetonitrylu (w wodzie lub buforze wodnym) i przechodzić liniowo do 95% acetonitrylu w ciągu 5–25 minut. Okresy stałego składu fazy ruchomej mogą być częścią dowolnego profilu gradientu. Na przykład skład fazy ruchomej można utrzymywać na stałym poziomie 5% acetonitrylu przez 1–3 min, po czym następuje liniowa zmiana do 95% acetonitrylu.

Dobór składu fazy ruchomej zależy od intensywności oddziaływań pomiędzy różnymi składnikami próbki („analitami”) a fazą stacjonarną ( np . oddziaływania hydrofobowe w HPLC z odwróconymi fazami). W zależności od ich powinowactwa do fazy stacjonarnej i ruchomej, anality rozdzielają się między nimi podczas procesu rozdzielania w kolumnie. Ten proces podziału jest podobny do tego, który zachodzi podczas ekstrakcji ciecz-ciecz, ale jest ciągły, a nie etapowy. W tym przykładzie, stosując gradient woda/acetonitryl, eluuje się więcej składników hydrofobowych (zejście z kolumny) późno, gdy faza ruchoma staje się bardziej zatężona w acetonitrylu ( tj . w fazie ruchomej o większej sile elucji).
Wybór składników fazy ruchomej, dodatków (takich jak sole lub kwasy) oraz warunków gradientu zależy od rodzaju kolumny i składników próbki. Często przeprowadza się serię serii próbnych z próbką w celu znalezienia metody HPLC, która zapewni odpowiedni rozdział.
Historia i rozwój
Przed HPLC naukowcy stosowali standardowe techniki chromatografii cieczowej. Systemy chromatografii cieczowej były w dużej mierze nieefektywne ze względu na zależność natężenia przepływu rozpuszczalników od grawitacji. Separacje trwały wiele godzin, a czasem dni. Chromatografia gazowa (GC) była wówczas mocniejsza niż chromatografia cieczowa (LC), jednak uważano, że rozdzielanie fazy gazowej i analiza bardzo polarnych biopolimerów o dużej masie cząsteczkowej było niemożliwe. GC była nieskuteczna dla wielu biochemików z powodu niestabilności termicznej substancji rozpuszczonych. W rezultacie postawiono hipotezę alternatywnych metod, które wkrótce zaowocują rozwojem HPLC.
Calvin Giddings , Josef Huber i inni przewidzieli w latach 60. XX wieku, że LC może działać w trybie wysokiej wydajności, zmniejszając średnicę cząstek wypełnienia znacznie poniżej typowego LC (i GC) na poziomie 150 μm i przy użyciu ciśnienia w celu zwiększenia prędkości fazy ruchomej. Prognozy te były poddawane szeroko zakrojonym eksperymentom i udoskonalaniu w latach 60. i 70. XX wieku. Wczesne badania rozwojowe zaczęły ulepszać cząstki LC, a wynalezienie Zipax, powierzchownie porowatej cząstki, było obiecujące dla technologii HPLC.
Lata siedemdziesiąte przyniosły wiele zmian w sprzęcie i oprzyrządowaniu. Badacze zaczęli używać pomp i wtryskiwaczy do stworzenia podstawowego projektu systemu HPLC. Pompy wspomagające gaz były idealne, ponieważ działały przy stałym ciśnieniu i nie wymagały szczelnych uszczelek ani zaworów zwrotnych, aby zapewnić stały przepływ i dobrą ocenę ilościową. W Dupont IPD (Industrial Polymers Division) dokonano kamieni milowych w zakresie sprzętu, takich jak zastosowanie urządzenia gradientowego o małej objętości spoczynkowej, a także zastąpienie wtryskiwacza z przegrodą pętlowym zaworem wtryskowym.
Chociaż rozwój oprzyrządowania był ważny, historia HPLC to przede wszystkim historia i ewolucja technologii cząstek . Po wprowadzeniu cząstek warstwy porowatej istnieje stała tendencja do zmniejszania wielkości cząstek w celu poprawy wydajności. Jednak zmniejszenie rozmiaru cząstek spowodowało pojawienie się nowych problemów. Praktyczne wady wynikają z nadmiernego spadku ciśnienia potrzebnego do przepchnięcia ruchomego płynu przez kolumnę oraz trudności w przygotowaniu jednolitego wypełnienia z bardzo drobnych materiałów. Za każdym razem, gdy rozmiar cząstek ulega znacznemu zmniejszeniu, zwykle musi nastąpić kolejna runda rozwoju instrumentu, aby poradzić sobie z ciśnieniem.
typy
Chromatografia podziałowa

Chromatografia podziałowa była jednym z pierwszych rodzajów chromatografii opracowanych przez chemików. Zasada współczynnika podziału została zastosowana w chromatografii bibułowej , chromatografii cienkowarstwowej , fazie gazowej i separacji ciecz-ciecz . Nagrodę Nobla w dziedzinie chemii w 1952 roku otrzymali Archer John Porter Martin i Richard Laurence Millington Synge za opracowanie techniki, która została wykorzystana do rozdzielania aminokwasów . Chromatografia podziałowa wykorzystuje zatrzymany rozpuszczalnik na powierzchni lub w obrębie ziaren lub włókien „obojętnej” stałej matrycy nośnej, tak jak w przypadku chromatografii bibułowej ; lub wykorzystuje pewne kulombowskie i/lub donorowe wodoru z fazą stacjonarną. Cząsteczki analitu rozdzielają się pomiędzy ciekłą fazę stacjonarną a eluent. Podobnie jak w przypadku chromatografii oddziaływań hydrofilowych (HILIC; technika podrzędna w ramach HPLC), metoda ta rozdziela anality na podstawie różnic w ich polarności. HILIC najczęściej wykorzystuje związaną polarną fazę stacjonarną oraz fazę ruchomą wykonaną głównie z acetonitrylu z wodą jako silnym składnikiem. HPLC z podziałem stosowano w przeszłości na niezwiązanych nośnikach z krzemionki lub tlenku glinu. Każdy działa skutecznie do rozdzielania analitów za pomocą względnych różnic biegunowych. Fazy związane HILIC mają tę zaletę, że rozdzielają kwaśne , zasadowe i obojętne substancje rozpuszczone w jednym cyklu chromatograficznym.
Anality polarne dyfundują do stacjonarnej warstwy wody związanej z polarną fazą stacjonarną i w ten sposób są zatrzymywane. Im silniejsze są oddziaływania polarnego analitu z polarną fazą stacjonarną (w stosunku do fazy ruchomej), tym dłuższy jest czas elucji. Siła oddziaływania zależy od grup funkcyjnych będących częścią struktury cząsteczkowej analitu, przy czym grupy bardziej spolaryzowane ( np . hydroksyl-) i grupy zdolne do tworzenia wiązań wodorowych indukują większą retencję. kulombowski (elektrostatyczne) interakcje mogą również zwiększyć retencję. Zastosowanie bardziej polarnych rozpuszczalników w fazie ruchomej zmniejszy czas retencji analitów, podczas gdy bardziej hydrofobowe rozpuszczalniki mają tendencję do wydłużania czasu retencji.
Chromatografia w normalnych fazach
Chromatografia w fazie normalnej była jednym z pierwszych rodzajów HPLC opracowanych przez chemików. Metoda ta, znana również jako HPLC w fazie normalnej (NP-HPLC), rozdziela anality na podstawie ich powinowactwa do polarnej powierzchni stacjonarnej, takiej jak krzemionka, stąd opiera się na zdolności analitów do angażowania się w interakcje polarne (takie jak wiązanie wodorowe lub dipol- oddziaływania typu dipolowego ) z powierzchnią sorbentu. NP-HPLC wykorzystuje niepolarną, niewodną fazę ruchomą ( np . Chloroform ) i działa skutecznie do rozdzielania analitów łatwo rozpuszczalnych w rozpuszczalnikach niepolarnych. Analit wiąże się z polarną fazą stacjonarną i jest przez nią zatrzymywany. Siły adsorpcji rosną wraz ze wzrostem polarności analitu. Siła oddziaływania zależy nie tylko od grup funkcyjnych obecnych w strukturze cząsteczki analitu, ale również od czynników sterycznych . Wpływ zawady przestrzennej na siłę oddziaływania pozwala tej metodzie na rozdzielanie (oddzielnych) izomerów strukturalnych .
Zastosowanie bardziej polarnych rozpuszczalników w fazie ruchomej zmniejszy czas retencji analitów, podczas gdy bardziej hydrofobowe rozpuszczalniki mają tendencję do indukowania wolniejszej elucji (dłuższy czas retencji). Bardzo polarne rozpuszczalniki, takie jak śladowe ilości wody w fazie ruchomej, mają tendencję do adsorpcji na powierzchni stałej fazy stacjonarnej, tworząc nieruchomą warstwę związaną (wodę), która odgrywa aktywną rolę w retencji. To zachowanie jest nieco charakterystyczne dla chromatografii z normalną fazą, ponieważ jest regulowane prawie wyłącznie przez mechanizm adsorpcyjny ( tj , anality oddziałują raczej z powierzchnią stałą niż z solwatowaną warstwą ligandu przyczepioną do powierzchni sorbentu; patrz także HPLC z odwróconą fazą poniżej). Chromatografia adsorpcyjna jest nadal szeroko stosowana do rozdzielania izomerów strukturalnych zarówno w formatach chromatografii kolumnowej, jak i cienkowarstwowej na nośnikach z aktywowanej (suszonej) krzemionki lub tlenku glinu.
HPLC z podziałem i NP-HPLC wypadły z łask w latach siedemdziesiątych XX wieku wraz z rozwojem HPLC z odwróconą fazą z powodu słabej odtwarzalności czasów retencji z powodu obecności warstwy wody lub protonowego rozpuszczalnika organicznego na powierzchni krzemionki lub podłoża chromatograficzne z tlenku glinu . Warstwa ta zmienia się wraz ze zmianami składu fazy ruchomej ( np . poziomu wilgoci), powodując dryfowanie czasów retencji.
Ostatnio chromatografia podziałowa stała się ponownie popularna wraz z rozwojem faz związanych Hilic , które wykazują lepszą odtwarzalność, oraz dzięki lepszemu zrozumieniu zakresu przydatności tej techniki.
Chromatografia wypierania
Podstawowa zasada chromatografii z wypieraniem jest następująca: Cząsteczka o wysokim powinowactwie do matrycy chromatograficznej (wypieracz) będzie skutecznie konkurować o miejsca wiązania, a tym samym wyprze wszystkie cząsteczki o mniejszym powinowactwie. Istnieją wyraźne różnice między chromatografią wypierania i elucji. W trybie elucji substancje zwykle wyłaniają się z kolumny w postaci wąskich pików gaussowskich. Szerokie rozdzielenie pików, korzystnie od linii podstawowej, jest pożądane w celu osiągnięcia maksymalnego oczyszczenia. Szybkość, z jaką dowolny składnik mieszaniny przemieszcza się w dół kolumny w trybie elucji, zależy od wielu czynników. Ale aby dwie substancje poruszały się z różnymi prędkościami, a tym samym zostały rozdzielone, muszą istnieć znaczne różnice w niektórych interakcjach między biomolekułami a matrycą chromatograficzną. Parametry pracy są dostosowywane tak, aby zmaksymalizować efekt tej różnicy. W wielu przypadkach rozdzielenie pików na linii podstawowej można osiągnąć tylko przy elucji gradientowej i niskim obciążeniu kolumny. Zatem dwie wady chromatografii w trybie elucji, zwłaszcza w skali preparatywnej, to złożoność operacyjna, spowodowana gradientowym pompowaniem rozpuszczalnika, oraz niska przepustowość, spowodowana niskim obciążeniem kolumny. Chromatografia wypierania ma przewagę nad chromatografią elucyjną, ponieważ składniki są rozdzielane na kolejne strefy czystych substancji, a nie na „piki”. Ponieważ proces wykorzystuje nieliniowość izoterm, większy wsad do kolumny można oddzielić na danej kolumnie z oczyszczonymi składnikami odzyskanymi w znacznie wyższym stężeniu.
Chromatografia z odwróconą fazą (RPC)
HPLC z odwróconymi fazami (RP-HPLC) ma niepolarną fazę stacjonarną i wodną, umiarkowanie polarną fazę ruchomą. Jedną typową fazą stacjonarną jest krzemionka, która została zmodyfikowana powierzchniowo za pomocą RMe2SiCl , gdzie R oznacza prostołańcuchową grupę alkilową, taką jak C18H37 lub C8H17 . Przy takich fazach stacjonarnych czas retencji jest dłuższy dla cząsteczek, które są mniej polarne, podczas gdy cząsteczki polarne eluują łatwiej (na wczesnym etapie analizy). Analityk może wydłużyć czas retencji, dodając więcej wody do fazy ruchomej; w ten sposób powinowactwo hydrofobowego analitu do hydrofobowej fazy stacjonarnej jest silniejsze w stosunku do obecnie bardziej hydrofilowej fazy ruchomej. Podobnie badacz może skrócić czas retencji, dodając więcej rozpuszczalnika organicznego do eluentu. RP-HPLC jest tak powszechnie stosowana, że często jest błędnie określana jako „HPLC” bez dalszych specyfikacji. Przemysł farmaceutyczny regularnie wykorzystuje RP-HPLC do kwalifikowania leków przed ich wypuszczeniem na rynek.
RP-HPLC działa na zasadzie oddziaływań hydrofobowych, co wynika z wysokiej symetrii dipolarnej struktury wody i odgrywa najważniejszą rolę we wszystkich procesach zachodzących w naukach przyrodniczych. RP-HPLC umożliwia pomiar tych sił interakcji. Wiązanie analitu z fazą stacjonarną jest proporcjonalne do pola powierzchni kontaktu wokół niepolarnego segmentu cząsteczki analitu po połączeniu z ligandem w fazie stacjonarnej. Ten solwofobowy jest zdominowany przez siłę wody do „redukcji ubytków” wokół analitu i C18 -łańcuch kontra kompleks obu. Energia uwalniana w tym procesie jest proporcjonalna do napięcia powierzchniowego eluentu (woda: 7,3 × 10-6 J / cm 2 , metanol: 2,2 × 10-6 J /cm 2 ) oraz hydrofobowej powierzchni analitu i odpowiednio ligand. Retencję można zmniejszyć, dodając do fazy ruchomej mniej polarny rozpuszczalnik (metanol, acetonitryl ) w celu zmniejszenia napięcia powierzchniowego wody. Elucja gradientowa wykorzystuje ten efekt, automatycznie zmniejszając polarność i napięcie powierzchniowe wodnej fazy ruchomej w trakcie analizy.
Właściwości strukturalne cząsteczki analitu odgrywają ważną rolę w jego charakterystyce retencyjnej. Ogólnie rzecz biorąc, analit o większej powierzchni hydrofobowej (C-H, C-C i ogólnie niepolarne wiązania atomowe, takie jak SS i inne) jest zatrzymywany dłużej, ponieważ nie oddziałuje ze strukturą wody. Z drugiej strony anality o większej powierzchni polarnej (nadawanej przez obecność w ich strukturze grup polarnych, takich jak -OH, -NH 2 , COO - lub -NH 3 + ) są mniej zatrzymywane, ponieważ lepiej integrują się z wodą . Oddziaływania takie podlegają efektom sterycznym, ponieważ bardzo duże cząsteczki mogą mieć jedynie ograniczony dostęp do porów fazy stacjonarnej, w których zachodzą oddziaływania z ligandami powierzchniowymi (łańcuchami alkilowymi). Taka przeszkoda powierzchniowa zwykle skutkuje mniejszą retencją.
Czas retencji wzrasta wraz z powierzchnią hydrofobową (niepolarną). Związki o rozgałęzionych łańcuchach eluują szybciej niż odpowiadające im izomery liniowe, ponieważ całkowita powierzchnia jest zmniejszona. Podobnie związki organiczne z pojedynczymi wiązaniami C-C eluują później niż związki z potrójnym wiązaniem C=C lub C-C, ponieważ wiązanie podwójne lub potrójne jest krótsze niż pojedyncze wiązanie C-C.
Oprócz napięcia powierzchniowego fazy ruchomej (siła organizacyjna w strukturze eluentu), inne modyfikatory fazy ruchomej mogą wpływać na retencję analitu. Na przykład dodatek soli nieorganicznych powoduje umiarkowany liniowy wzrost napięcia powierzchniowego roztworów wodnych (ok. 1,5 × 10-7 J/cm 2 na mol dla NaCl, 2,5 × 10-7 J / cm 2 na mol dla ( NH 4 ) 2 SO 4 ) i ponieważ entropia rozdziału faz analit-rozpuszczalnik jest kontrolowany przez napięcie powierzchniowe, dodatek soli ma tendencję do wydłużania czasu retencji. Technika ta stosowana jest do łagodnej separacji i odzyskiwania białek oraz ochrony ich aktywności biologicznej w analizie białek (chromatografia oddziaływań hydrofobowych, HIC).
pH fazy ruchomej, ponieważ może ono zmienić hydrofobowy charakter analitu. Z tego powodu większość metod wykorzystuje środek buforujący , taki jak fosforan sodu , do kontrolowania pH. Bufory służą wielu celom: kontrolują pH, neutralizują ładunek na powierzchni krzemionki fazy stacjonarnej i działają jako środki parowania jonów w celu zneutralizowania ładunku analitu. Mrówczan amonu jest powszechnie dodawany w spektrometrii masowej w celu poprawy wykrywania niektórych analitów poprzez tworzenie adduktów analit-amon . Lotny kwas organiczny, np kwas octowy lub najczęściej kwas mrówkowy jest często dodawany do fazy ruchomej, jeśli do analizy eluentu z kolumny stosuje się spektrometrię mas. Kwas trifluorooctowy jest rzadko używany w zastosowaniach spektrometrii mas ze względu na jego trwałość w detektorze i systemie dostarczania rozpuszczalnika, ale może być skuteczny w poprawie retencji analitów, takich jak kwasy karboksylowe , w zastosowaniach wykorzystujących inne detektory, ponieważ jest dość silnym kwasem organicznym. Wpływ kwasów i buforów różni się w zależności od zastosowania, ale generalnie poprawia rozdzielczość chromatograficzną.
Kolumny z odwróconą fazą są dość trudne do uszkodzenia w porównaniu ze zwykłymi kolumnami krzemionkowymi; jednak wiele kolumn z fazą odwróconą składa się z cząstek krzemionki derywatyzowanej alkilem i nigdy nie powinno się ich używać z wodnymi zasadami ponieważ zniszczą one leżącą pod spodem cząstkę krzemionki. Można ich używać z wodnym roztworem kwasu, ale kolumny nie należy wystawiać na działanie kwasu zbyt długo, ponieważ może to spowodować korozję metalowych części sprzętu HPLC. Kolumny RP-HPLC należy po użyciu przepłukać czystym rozpuszczalnikiem w celu usunięcia resztek kwasów lub buforów i przechowywać w odpowiednim składzie rozpuszczalnika. Zawartość metalu w kolumnach HPLC musi być utrzymywana na niskim poziomie, jeśli ma być zachowana najlepsza możliwa zdolność oddzielania substancji. Dobrym testem na zawartość metalu w kolumnie jest wstrzyknięcie próbki będącej mieszaniną 2,2'- i 4,4'- bipirydyny . Ponieważ 2,2'-bipy może chelatować metal, kształt piku dla 2,2'-bipy będzie zniekształcony (ogoniasty), gdy jony metalu są obecne na powierzchni krzemionki . [ potrzebne źródło ] ..
Chromatografia wykluczania ze względu na wielkość
Chromatografia wykluczania (SEC), znana również jako chromatografia żelowo-permeacyjna lub chromatografia żelowo-filtracyjna , rozdziela cząstki na podstawie wielkości cząsteczek (właściwie według promienia Stokesa ) . Jest to na ogół chromatografia o niskiej rozdzielczości i dlatego często jest zarezerwowana dla końcowego, „polerującego” etapu oczyszczania. Jest również przydatny do określania struktury trzeciorzędowej i struktury czwartorzędowej oczyszczonych białek. SEC jest używany głównie do analizy dużych cząsteczek, takich jak białka lub polimery. SEC działa poprzez uwięzienie tych mniejszych cząsteczek w porach cząsteczki. Większe cząsteczki po prostu przechodzą przez pory, ponieważ są zbyt duże, aby do nich wejść. Większe cząsteczki przepływają zatem przez kolumnę szybciej niż mniejsze cząsteczki, to znaczy im mniejsza cząsteczka, tym dłuższy czas retencji.
Ta technika jest szeroko stosowana do oznaczania masy cząsteczkowej polisacharydów. SEC to oficjalna technika (zalecana przez farmakopeę europejską) służąca do porównywania mas cząsteczkowych różnych dostępnych na rynku heparyn drobnocząsteczkowych .
Chromatografia jonowymienna
W chromatografii jonowymiennej (IC) retencja opiera się na przyciąganiu między jonami substancji rozpuszczonej a naładowanymi miejscami związanymi z fazą stacjonarną. Jony rozpuszczone o takim samym ładunku jak naładowane miejsca na kolumnie są wyłączone z wiązania, podczas gdy jony rozpuszczone o przeciwnym ładunku naładowanych miejsc na kolumnie są zatrzymywane na kolumnie. Jony rozpuszczone, które są zatrzymane na kolumnie, można wymyć z kolumny poprzez zmianę warunków rozpuszczalnika ( np . zwiększenie efektu jonowego układu rozpuszczalników poprzez zwiększenie stężenia soli w roztworze, zwiększenie temperatury kolumny, zmianę pH rozpuszczalnika itp.).
Rodzaje wymieniaczy jonowych obejmują żywice polistyrenowe, celulozowe i dekstranowe wymieniacze jonowe (żele) oraz szkło o kontrolowanych porach lub porowatą krzemionkę. Żywice polistyrenowe umożliwiają sieciowanie, co zwiększa stabilność łańcucha. Wyższe usieciowanie zmniejsza odchylanie, co wydłuża czas równoważenia i ostatecznie poprawia selektywność. Wymieniacze jonowe celulozy i dekstranu mają większe rozmiary porów i niską gęstość ładunku, dzięki czemu nadają się do separacji białek
Ogólnie rzecz biorąc, wymieniacze jonowe sprzyjają wiązaniu jonów o większym ładunku i mniejszym promieniu.
Wzrost stężenia przeciwjonu (w odniesieniu do grup funkcyjnych w żywicach) skraca czas retencji. Spadek pH skraca czas retencji w wymianie kationowej, podczas gdy wzrost pH skraca czas retencji w wymianie anionowej. Obniżając pH rozpuszczalnika w kolumnie kationowymiennej, na przykład, dostępnych jest więcej jonów wodoru, które konkurują o pozycje na anionowej fazie stacjonarnej, eluując w ten sposób słabo związane kationy.
Ta forma chromatografii znajduje szerokie zastosowanie w następujących zastosowaniach: oczyszczanie wody, wstępne zatężanie składników śladowych, chromatografia ligandowymienna, chromatografia jonowymienna białek, wysokopH chromatografia anionowymienna węglowodanów i oligosacharydów i inne.
Chromatografia biopowinowactwa
Ten proces chromatograficzny opiera się na właściwości substancji biologicznie czynnych do tworzenia stabilnych, specyficznych i odwracalnych kompleksów. W tworzeniu tych kompleksów biorą udział wspólne siły molekularne, takie jak oddziaływanie Van der Waalsa , oddziaływanie elektrostatyczne, oddziaływanie dipol-dipol, oddziaływanie hydrofobowe oraz wiązanie wodorowe. Wydajne, biospecyficzne wiązanie jest tworzone przez jednoczesne i skoordynowane działanie kilku z tych sił w komplementarnych miejscach wiązania.
Wodna chromatografia w normalnej fazie
Wodna chromatografia w normalnych fazach (ANP) to technika chromatograficzna, która obejmuje obszar fazy ruchomej między chromatografią w fazach odwróconych (RP) a chromatografią w normalnych fazach organicznych (ONP). Technikę tę stosuje się w celu uzyskania wyjątkowej selektywności dla związków hydrofilowych, wykazując elucję w normalnej fazie przy użyciu rozpuszczalników z odwróconą fazą. [ potrzebne źródło ]
Elucja izokratyczna i gradientowa
Separacja, w której skład fazy ruchomej pozostaje stały podczas całej procedury, nazywana jest izokratyczną (co oznacza stały skład ). (Na przykład procent metanolu w całej procedurze pozostanie stały, tj. 10%) Słowo to zostało ukute przez Csaba Horvatha , który był jednym z pionierów HPLC. [ potrzebne źródło ] ,
Skład fazy ruchomej nie musi być stały. Separacja, w której podczas procesu separacji zmienia się skład fazy ruchomej, jest określana jako elucja gradientowa . Jednym z przykładów jest gradient rozpoczynający się od 10% metanolu i kończący się na 90% metanolu po 20 minutach. Dwa składniki fazy ruchomej są zwykle określane jako „A” i „B”; A jest „słabym” rozpuszczalnikiem, który umożliwia powolną elucję substancji rozpuszczonej, podczas gdy B jest „silnym” rozpuszczalnikiem, który szybko eluuje substancje rozpuszczone z kolumny. W W chromatografii z odwróconymi fazami rozpuszczalnik A to często woda lub wodny bufor, podczas gdy B to rozpuszczalnik organiczny mieszający się z wodą, taki jak acetonitryl , metanol, THF lub izopropanol .
W elucji izokratycznej szerokość piku wzrasta liniowo wraz z czasem retencji, zgodnie z równaniem na N, liczbę półek teoretycznych. Prowadzi to do niedogodności polegającej na tym, że późno eluujące piki stają się bardzo płaskie i szerokie. Ich kształt i szerokość mogą uniemożliwić rozpoznanie ich jako szczytów.
Elucja gradientowa zmniejsza retencję składników wymywanych później, dzięki czemu eluują one szybciej, dając węższe (i wyższe) piki dla większości składników. Poprawia to również kształt piku dla pików z ogonami, ponieważ rosnące stężenie eluentu organicznego popycha część ogonową piku do przodu. Zwiększa to również wysokość piku (pik wygląda na „ostrzejszy”), co jest ważne w analizie śladów. Program gradientu może obejmować nagłe „skokowe” wzrosty procentowej zawartości składnika organicznego lub różne nachylenia w różnym czasie – wszystko zgodnie z pragnieniem optymalnego rozdzielenia w jak najkrótszym czasie.
W elucji izokratycznej selektywność nie zmienia się, jeśli zmieniają się wymiary kolumny (długość i średnica wewnętrzna) – to znaczy piki eluują w tej samej kolejności. W elucji gradientowej kolejność elucji może się zmieniać wraz ze zmianą wymiarów lub szybkości przepływu. [ potrzebne źródło ]
Siła napędowa w chromatografii z odwróconymi fazami pochodzi z wyższego rzędu struktury wody. Rolą składnika organicznego fazy ruchomej jest zmniejszenie tego wysokiego rzędu, a tym samym zmniejszenie siły opóźniającej składnika wodnego.
Parametry
Teoretyczny
Rozdzielenia HPLC mają teoretyczne parametry i równania opisujące rozdzielanie składników na piki sygnału po wykryciu za pomocą oprzyrządowania, takiego jak detektor UV lub spektrometr masowy. Parametry w dużej mierze pochodzą z dwóch zestawów teorii chromatografii: teorii płytek (jako część chromatografii z podziałem ) i teorii szybkości chromatografii / równania Van Deemtera . Oczywiście można je zastosować w praktyce poprzez analizę chromatogramów HPLC, chociaż teoria szybkości jest uważana za dokładniejszą.
Są one analogiczne do obliczania współczynnika retencji dla rozdziału metodą chromatografii bibułowej , ale opisują, jak dobrze HPLC rozdziela mieszaninę na dwa lub więcej składników, które są wykrywane jako piki (pasma) na chromatogramie. Parametrami HPLC są: współczynnik wydajności ( N ), współczynnik retencji (kappa prim) i współczynnik separacji (alfa). Razem czynniki te są zmiennymi w równaniu rozdzielczości, które opisuje, jak dobrze piki dwóch składników oddzielają się lub nakładają na siebie. Parametry te są przeważnie używane tylko do opisywania rozdzielania faz odwróconych HPLC i normalnych faz HPLC, ponieważ te rozdzielania są zwykle bardziej subtelne niż inne tryby HPLC ( np . wymiana jonowa i wykluczanie wielkości).
Objętość pustki to ilość miejsca w kolumnie zajmowanego przez rozpuszczalnik. Jest to przestrzeń w kolumnie, która znajduje się poza wewnętrznym materiałem wypełniającym kolumny. Objętość pustych przestrzeni mierzy się na chromatogramie jako pierwszy wykryty pik składnika, którym zwykle jest rozpuszczalnik obecny w mieszaninie próbki; w idealnym przypadku rozpuszczalnik próbki przepływa przez kolumnę bez interakcji z kolumną, ale nadal jest wykrywalny w odróżnieniu od rozpuszczalnika HPLC. Objętość pustki jest używana jako współczynnik korygujący.
Współczynnik wydajności ( N ) praktycznie mierzy, jak ostre są piki składowych na chromatogramie, jako stosunek powierzchni pików składowych („czas retencji”) do szerokości pików w ich najszerszym punkcie (na linii podstawowej). Piki, które są wysokie, ostre i stosunkowo wąskie, wskazują, że metoda separacji skutecznie usuwa składnik z mieszaniny; wysoka wydajność. Wydajność jest bardzo zależna od kolumny HPLC i zastosowanej metody HPLC. Współczynnik wydajności jest równoznaczny z numerem rejestracyjnym i „liczbą półek teoretycznych”.
Współczynnik retencji ( kappa prim ) mierzy, jak długo składnik mieszaniny przywierał do kolumny, mierzony jako pole powierzchni pod krzywą jego piku na chromatogramie (ponieważ chromatogramy HPLC są funkcją czasu). Każdy pik chromatogramu będzie miał swój własny współczynnik retencji ( np . kappa 1 dla współczynnika retencji pierwszego piku). Współczynnik ten można skorygować o pustą objętość kolumny.
Współczynnik rozdziału ( alfa ) jest względnym porównaniem tego, jak dobrze rozdzielono dwa sąsiednie składniki mieszaniny ( tj . dwa sąsiednie prążki na chromatogramie). Współczynnik ten definiuje się jako stosunek współczynników retencji pary sąsiednich pików chromatogramu i można go również skorygować o pustą objętość kolumny. Im większa wartość współczynnika rozdziału jest większa niż 1,0, tym lepszy rozdział, aż do około 2,0, powyżej którego metoda HPLC prawdopodobnie nie jest potrzebna do rozdziału. Równania rozdzielczości odnoszą się do trzech czynników, tak że wysoka wydajność i współczynniki rozdzielania poprawiają rozdzielczość pików składowych w rozdzielaniu HPLC.
Wewnętrzna średnica
Średnica wewnętrzna (ID) kolumny HPLC jest ważnym parametrem wpływającym na czułość detekcji i selektywność rozdzielania w elucji gradientowej. Określa również ilość analitu, którą można załadować na kolumnę. Większe kolumny są zwykle spotykane w zastosowaniach przemysłowych, takich jak oczyszczanie produktu leczniczego do późniejszego wykorzystania. Kolumny o niskim ID mają lepszą czułość i mniejsze zużycie rozpuszczalnika kosztem ładowności.
Większe kolumny ID (powyżej 10 mm) służą do oczyszczania użytecznych ilości materiału ze względu na ich dużą ładowność.
Kolumny ze skalą analityczną (4,6 mm) były najpopularniejszym typem kolumn, chociaż mniejsze kolumny szybko zyskują na popularności. Znajdują zastosowanie w tradycyjnej analizie ilościowej próbek i często wykorzystują detektor absorbancji UV-Vis .
Kolumny o wąskim otworze (1–2 mm) są używane do zastosowań, w których wymagana jest większa czułość, albo ze specjalnymi detektorami UV-Vis, detekcją fluorescencyjną lub innymi metodami wykrywania, takimi jak chromatografia cieczowa-spektrometria mas
Kolumny kapilarne (poniżej 0,3 mm) są używane prawie wyłącznie z alternatywnymi metodami wykrywania, takimi jak spektrometria mas . Zwykle są wykonane z ze stopionej krzemionki , a nie z rur ze stali nierdzewnej, które są stosowane w większych kolumnach.
Rozmiar cząsteczki
Większość tradycyjnych metod HPLC przeprowadza się z fazą stacjonarną przyczepioną na zewnątrz małych kulistych cząstek krzemionki (bardzo małych kulek). Cząsteczki te występują w różnych rozmiarach, przy czym najczęstsze są kulki 5 µm. Mniejsze cząstki na ogół zapewniają większą powierzchnię i lepszą separację, ale ciśnienie wymagane do uzyskania optymalnej prędkości liniowej wzrasta o odwrotność kwadratu średnicy cząstek.
Zgodnie z równaniami prędkości kolumny, wydajności i przeciwciśnienia , zmniejszenie średnicy cząstek o połowę i utrzymanie tego samego rozmiaru kolumny podwoi prędkość i wydajność kolumny; ale czterokrotnie zwiększyć przeciwciśnienie. A małe cząstki HPLC mogą również zmniejszać poszerzenie szerokości. Większe cząstki są używane w preparatywnej HPLC (średnica kolumny od 5 cm do >30 cm) oraz w zastosowaniach innych niż HPLC, takich jak ekstrakcja do fazy stałej .
Rozmiar porów
Wiele faz stacjonarnych jest porowatych, aby zapewnić większą powierzchnię. Małe pory zapewniają większą powierzchnię, podczas gdy większy rozmiar porów ma lepszą kinetykę, szczególnie w przypadku większych analitów. Na przykład białko, które jest tylko trochę mniejsze niż por, może wejść do poru, ale nie jest łatwo z niego wyjść.
Ciśnienie pompy
Pompy różnią się wydajnością ciśnieniową, ale ich wydajność jest mierzona na podstawie ich zdolności do uzyskiwania stałego i powtarzalnego natężenia przepływu objętościowego . Ciśnienie może sięgać nawet 60 MPa (6000 funtów siły/cal2 ) lub około 600 atmosfer. Nowoczesne systemy HPLC zostały udoskonalone do pracy przy znacznie wyższych ciśnieniach, dzięki czemu są w stanie wykorzystywać w kolumnach cząstki o znacznie mniejszych rozmiarach (<2 μm). Te systemy „ultrawysokosprawnej chromatografii cieczowej” lub UHPLC, które mogą być również znane jako systemy chromatografii ultrawysokociśnieniowej, mogą pracować przy ciśnieniu do 120 MPa (17 405 funtów siły/cal 2 ) lub około 1200 atmosfer. Termin „UPLC” jest znakiem towarowym firmy Waters Corporation , ale czasami jest używany w odniesieniu do bardziej ogólnej techniki UHPLC.
Detektory
Detektory HPLC dzielą się na dwie główne kategorie: uniwersalne i selektywne. Detektory uniwersalne zazwyczaj mierzą właściwości objętościowe ( np . współczynnik załamania światła ) poprzez pomiar różnicy właściwości fizycznych między fazą ruchomą a fazą ruchomą z substancją rozpuszczoną, podczas gdy detektory selektywne mierzą właściwości substancji rozpuszczonej ( np . absorbancję UV-Vis ) po prostu reagując na właściwości fizyczne lub chemiczne substancji rozpuszczonej. HPLC najczęściej wykorzystuje detektor absorbancji UV-Vis , jednak szeroka gama innych można zastosować detektory chromatograficzne . Uniwersalnym detektorem uzupełniającym detekcję absorbancji UV-Vis jest naładowany detektor aerozolowy (CAD). Rodzaj powszechnie stosowanego detektora obejmuje detektory współczynnika załamania światła, które dostarczają odczyty poprzez pomiar zmian współczynnika załamania eluentu podczas jego przemieszczania się przez komorę przepływową. W niektórych przypadkach możliwe jest użycie wielu detektorów, na przykład LCMS zwykle łączy UV-Vis ze spektrometrem masowym.
W połączeniu z detektorem elektrochemicznym (ECD) HPLC-ECD selektywnie wykrywa neuroprzekaźniki , takie jak: norepinefryna , dopamina , serotonina , glutaminian , GABA, acetylocholina i inne w zastosowaniach badawczych do analizy neurochemicznej. HPLC-ECD wykrywa neuroprzekaźniki w femtomolowym . Inne metody wykrywania neuroprzekaźników obejmują chromatografię cieczową ze spektrometrią mas, test ELISA lub testy radioimmunologiczne.
Autosamplery
Duża liczba próbek może być automatycznie wstrzykiwana do systemu HPLC za pomocą autosamplerów HPLC. Ponadto autosamplery HPLC mają objętość iniekcji i technikę, która jest dokładnie taka sama dla każdego wstrzyknięcia, w konsekwencji zapewniają wysoki stopień precyzji objętości wstrzyknięcia. Możliwe jest umożliwienie mieszania próbek w komorze próbkowania, co sprzyja jednorodności.
Aplikacje
Produkcja
HPLC ma wiele zastosowań zarówno w badaniach laboratoryjnych, jak i klinicznych. Jest to powszechna technika stosowana w rozwoju farmaceutycznym, ponieważ jest niezawodnym sposobem na uzyskanie i zapewnienie czystości produktu. Chociaż HPLC może wytwarzać bardzo wysokiej jakości (czyste) produkty, nie zawsze jest to podstawowa metoda stosowana w produkcji materiałów leków luzem. Według Farmakopei Europejskiej HPLC jest stosowana tylko w 15,5% syntez. Odgrywa jednak rolę w 44% syntez w farmakopei Stanów Zjednoczonych. Może to być prawdopodobnie spowodowane różnicami w ograniczeniach finansowych i czasowych, ponieważ HPLC na dużą skalę może być kosztowną techniką. Wzrost specyficzności, precyzji i dokładności, który występuje w przypadku HPLC, niestety odpowiada wzrostowi kosztów.
Prawny
Ta technika jest również wykorzystywana do wykrywania nielegalnych narkotyków w moczu. Najpopularniejszą metodą wykrywania narkotyków jest test immunologiczny. Ta metoda jest znacznie wygodniejsza. Jednak wygoda odbywa się kosztem specyficzności i zasięgu szerokiej gamy leków. Ponieważ HPLC jest metodą określania (i ewentualnie zwiększania) czystości, stosowanie samej HPLC do oceny stężeń leków jest nieco niewystarczające. Dzięki temu HPLC w tym kontekście jest często przeprowadzana w połączeniu ze spektrometrią mas . Stosowanie chromatografii cieczowej zamiast chromatografii gazowej w połączeniu z MS pozwala uniknąć konieczności derywatyzacji za pomocą czynników acetylujących lub alkilujących, co może być uciążliwym dodatkowym etapem. Ta technika została wykorzystana do wykrywania różnych środków, takich jak środki dopingujące, metabolity narkotyków, koniugaty glukuronidów, amfetaminy, opioidy, kokaina, BZD, ketamina, LSD, konopie indyjskie i pestycydy. Wykonywanie HPLC w połączeniu ze spektrometrią mas zmniejsza bezwzględną potrzebę standaryzacji serii eksperymentalnych HPLC.
Badania
Podobne testy można przeprowadzić do celów badawczych, wykrywając stężenia potencjalnych kandydatów klinicznych, takich jak leki przeciwgrzybicze i leki na astmę. Technika ta jest oczywiście przydatna również w obserwacji wielu gatunków w zebranych próbkach, ale wymaga zastosowania standardowych rozwiązań, gdy poszukuje się informacji o tożsamości gatunku. Stosowany jest jako metoda potwierdzania wyników reakcji syntezy, ponieważ czystość jest niezbędna w tego typu badaniach. Jednak spektrometria mas jest nadal bardziej niezawodnym sposobem identyfikacji gatunków.
Medyczny
Medyczne zastosowanie HPLC może obejmować analizę leków, ale bardziej pasuje do kategorii analizy składników odżywczych. Podczas gdy mocz jest najczęstszym medium do analizy stężeń leków, surowica krwi jest próbką pobieraną do większości analiz medycznych za pomocą HPLC. Inne metody wykrywania cząsteczek, które są przydatne w badaniach klinicznych, zostały przetestowane na HPLC, a mianowicie testy immunologiczne. W jednym z przykładów porównano konkurencyjne testy wiązania białek (CPBA) i HPLC pod kątem czułości w wykrywaniu witaminy D. Przydatne do diagnozowania niedoborów witaminy D u dzieci, stwierdzono, że czułość i swoistość tego CPBA osiągnęła tylko 40% i 60 odpowiednio % pojemności HPLC. Chociaż jest to drogie narzędzie, dokładność HPLC jest prawie niezrównana.
Zobacz też
- Historia chromatografii
- Elektrochromatografia kapilarna
- Chromatografia kolumnowa
- Csaba Horvath
- Chromatografia jonowa
- Micelarna chromatografia cieczowa
Dalsza lektura
- LR Snyder, JJ Kirkland i JW Dolan, Wprowadzenie do nowoczesnej chromatografii cieczowej, John Wiley & Sons, Nowy Jork, 2009.
- MW Dong, Nowoczesna HPLC dla praktykujących naukowców. Wiley, 2006.
- LR Snyder, JJ Kirkland i JL Glajch, Practical HPLC Method Development, John Wiley & Sons, Nowy Jork, 1997.
- S. Ahuja i HT Rasmussen (red.), HPLC Method Development for Pharmaceuticals, Academic Press, 2007.
- S. Ahuja i MW Dong (red.), Handbook of Pharmaceutical Analysis by HPLC, Elsevier/Academic Press, 2005.
- YV Kazakevich i R. LoBrutto (red.), HPLC dla naukowców farmaceutycznych, Wiley, 2007.
- UD Neue, Kolumny HPLC: teoria, technologia i praktyka, Wiley-VCH, Nowy Jork, 1997.
- MC McMaster, HPLC, praktyczny podręcznik użytkownika, Wiley, 2007.
Linki zewnętrzne
- Zasada chromatografii HPLC , zastosowanie [Uwaga podstawowa] – 2020. na Rxlalit.com [ stały martwy link ]
- Chromatografia cieczowa w Curlie




