Dekapentaplegia
| Dekapentaplegiczne | |||||||
|---|---|---|---|---|---|---|---|
| identyfikatory | |||||||
| Organizm | |||||||
| Symbol | Dpp | ||||||
| UniProt | P07713 | ||||||
| |||||||
Decapentaplegic (Dpp) jest kluczowym morfogenem biorącym udział w rozwoju muszki owocowej Drosophila melanogaster i jest pierwszym zatwierdzonym morfogenem sekrecyjnym. Wiadomo, że jest to konieczne do prawidłowego ukształtowania i rozwoju wczesnego Drosophila i piętnastu wyobrażeniowych dysków , które są tkankami, które staną się kończynami oraz innymi narządami i strukturami dorosłej muchy. Sugerowano również, że Dpp odgrywa rolę w regulowaniu wzrostu i wielkości tkanek. Muchy z mutacjami dekapentaplegicznymi nie tworzą prawidłowo tych struktur, stąd nazwa ( decapenta- , piętnaście, - plegic , paraliż). Dpp jest homologiem Drosophila białek morfogenetycznych kości kręgowców (BMP), które są członkami nadrodziny TGF-β , klasy białek, które często są związane z własnym specyficznym szlakiem sygnałowym. Badania Dpp u Drosophila doprowadziły do lepszego zrozumienia funkcji i znaczenia ich homologów u kręgowców, takich jak ludzie.
Funkcja u Drosophila
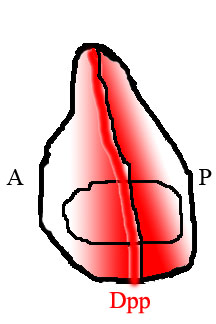
Dpp jest klasycznym morfogenem, co oznacza, że występuje w przestrzennym gradiencie stężeń w tkankach, w których się znajduje, a jego obecność jako gradient nadaje mu funkcjonalne znaczenie w sposobie, w jaki wpływa na rozwój. Najlepiej przebadanymi tkankami, w których znaleziono Dpp, są wczesny zarodek i wyobrażone dyski skrzydeł, które później tworzą skrzydła muchy. Podczas rozwoju embrionalnego Dpp ulega jednolitej ekspresji na grzbietowej stronie zarodka, tworząc ostry gradient stężeń. W dyskach wyobrażeniowych Dpp jest silnie wyrażane w wąskim pasku komórek pośrodku dysku, gdzie tkanka wyznacza granicę między przednią i tylną stroną. Dpp dyfunduje z tego paska w kierunku krawędzi tkanki, tworząc gradient zgodnie z oczekiwaniami morfogenu. Jednakże, chociaż komórki w domenie Dpp w zarodku nie namnażają się, komórki w imaginowym krążku skrzydłowym namnażają się intensywnie, powodując wzrost tkanki. Chociaż tworzenie gradientu we wczesnym zarodku jest dobrze poznane, to, w jaki sposób gradient morfogenu Dpp tworzy się w imaginalnym dysku skrzydła, pozostaje kontrowersyjne.
Rola i formacja w rozwoju embrionalnym
We wczesnym stadium blastodermy sygnalizacja Dpp jest jednolita i niska wzdłuż strony grzbietowej. Ostry profil sygnalizacji pojawia się na grzbietowej linii środkowej zarodka podczas komórkyzacji, z wysokimi poziomami Dpp określającymi pozazarodkową amnioserosa i niskimi poziomami określającymi grzbietową ektodermę . Sygnalizacja Dpp obejmuje również pozytywnego sprzężenia zwrotnego , który promuje przyszłe wiązanie Dpp. Gradient morfogenu w zarodkach jest ustalany za pomocą znanego mechanizmu aktywnego transportu. Tworzenie gradientu zależy od inhibitorów BMP Gastrulacja krótka (Sog) i gastrulacja skręcona (Tsg) oraz inne białka zewnątrzkomórkowe, takie jak Tolloid (Tld) i Screw (Scw). Sog jest wytwarzany w brzuszno-bocznym obszarze zarodka (prostopadle do gradientu Dpp) i tworzy gradient hamujący BMP, który zapobiega wiązaniu Dpp z jego receptorem. Sog i Tsg tworzą kompleks z Dpp i są aktywnie transportowane w kierunku grzbietowej linii środkowej (środek zarodka), zgodnie z gradientem stężenia Sog. Tld, metaloproteaza , uwalnia Dpp z kompleksu pośrednicząc w przetwarzaniu Sog, aktywując sygnalizację Dpp w linii środkowej. Po gastrulacji zarodka gradient Dpp indukuje tworzenie mezodermy sercowej i trzewnej .
Szlak sygnałowy
Dpp, podobnie jak jego homologi u kręgowców, jest cząsteczką sygnałową. U Drosophila receptor dla Dpp jest tworzony przez dwa białka, żyły grube (Tkv) i Punt. Podobnie jak sam Dpp, Tkv i Punt są bardzo podobne do homologów innych gatunków. Kiedy komórka odbiera sygnał Dpp, receptory są w stanie aktywować wewnątrzkomórkowe białko zwane matkami przeciwko Dpp (szalone) poprzez fosforylację. Początkowe odkrycie szaleństwa u Drosophila utorowało drogę późniejszym eksperymentom, które zidentyfikowały odpowiedź na sygnalizację TGF-β u kręgowców, zwaną SMAD . Activated Mad jest w stanie wiązać się z DNA i działać jako czynnik transkrypcyjny wpływający na ekspresję różnych genów w odpowiedzi na sygnalizację Dpp. Geny aktywowane przez sygnalizację Dpp obejmują ślepotę optomotoryczną (omb) i spalt, a aktywność tych genów jest często wykorzystywana jako wskaźniki sygnalizacji Dpp w eksperymentach. Innym genem o bardziej skomplikowanej interakcji regulacyjnej z Dpp jest gen bricker. Brinker jest czynnikiem transkrypcyjnym, który tłumi cele aktywacji Dpp, więc aby włączyć te geny, Dpp musi tłumić brinker, jak również aktywować inne cele.
Rola w wyobrażonym dysku skrzydłowym
W skrzydle muchy tylna i przednia połowa tkanki są wypełnione różnymi rodzajami komórek, które wyrażają różne geny. Komórki z tyłu, ale nie z przodu, wyrażają czynnik transkrypcyjny Engrailed (En). Jednym z genów aktywowanych przez En jest jeż (hh), czynnik sygnalizacyjny. Sygnalizacja Hedgehog instruuje sąsiednie komórki, aby wyrażały Dpp, ale ekspresja Dpp jest również tłumiona przez En. W rezultacie Dpp jest wytwarzane tylko w wąskim pasku komórek bezpośrednio sąsiadujących z tylną połową tkanki, ale nie w jej tylnej części. Dpp wytwarzane na tej przedniej/tylnej granicy dyfunduje następnie na brzegi tkanki, tworząc przestrzenny gradient stężeń.
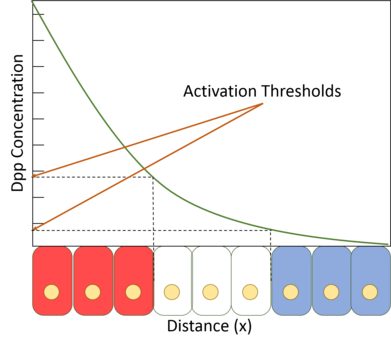
Odczytując swoje położenie wzdłuż gradientu Dpp, komórki w skrzydle są w stanie określić swoje położenie względem przedniej/tylnej granicy i odpowiednio się zachowują i rozwijają.
Możliwe, że tak naprawdę to nie dyfuzja i gradient Dpp kształtują tkanki, ale zamiast tego komórki, które otrzymują sygnał Dpp, instruują swoich sąsiadów, co mają być, a te komórki z kolei sygnalizują swoim sąsiadom w kaskadzie przez tkankę. Przeprowadzono kilka eksperymentów, aby obalić tę hipotezę i ustalić, że w rzeczywistości to gradient rzeczywistych cząsteczek Dpp jest odpowiedzialny za tworzenie wzorców.
Istnieją zmutowane formy receptora Dpp Tkv, które zachowują się tak, jakby odbierały duże ilości sygnału Dpp, nawet przy braku Dpp. Komórki zawierające ten zmutowany receptor zachowują się tak, jakby znajdowały się w środowisku o wysokim Dpp, takim jak obszar w pobliżu paska komórek wytwarzających Dpp. Tworząc małe płaty tych komórek w różnych częściach tkanki skrzydła, badacze byli w stanie rozróżnić, w jaki sposób Dpp działa na wzór tkanki. Jeśli komórki, które otrzymują sygnał Dpp, instruują swoich sąsiadów w kaskadzie, wówczas w miejscach zmutowanych komórek, które wydają się odbierać wysoką sygnalizację Dpp, ale same nie wytwarzają żadnej Dpp, powinny pojawić się dodatkowe centra modelowania tkanek. Jednakże, jeśli fizyczna obecność Dpp jest konieczna, komórki w pobliżu mutantów nie powinny być w ogóle dotknięte. Eksperymenty wykazały, że drugi przypadek jest prawdziwy, wskazując, że Dpp działa jak morfogen.
Powszechnym sposobem oceny różnic we wzornictwie tkanek w skrzydle muchy jest przyjrzenie się układowi żył w skrzydle. U much, u których upośledzona jest zdolność Dpp do dyfuzji przez tkankę, położenie żył jest przesunięte w porównaniu z normalnymi muchami, a skrzydło jest ogólnie mniejsze.
Dpp zaproponowano również jako regulator wzrostu i wielkości tkanki, klasyczny problem w rozwoju. Problemem powszechnym dla organizmów z narządami wielokomórkowymi, które muszą rosnąć od początkowego rozmiaru, jest to, jak wiedzieć, kiedy przestać rosnąć po osiągnięciu odpowiedniego rozmiaru. Ponieważ Dpp występuje w gradiencie, można sobie wyobrazić, że nachylenie gradientu może być miarą, za pomocą której tkanka określa, jak duża jest. Jeśli ilość Dpp w źródle jest stała, a ilość na krawędzi tkanki wynosi zero, wówczas stromość gradientu będzie się zmniejszać wraz ze wzrostem rozmiaru tkanki i odległości między źródłem a krawędzią. Eksperymenty, w których indukowano sztucznie stromy gradient Dpp w tkance skrzydeł, skutkowały znacznie zwiększoną proliferacją komórek, co potwierdza hipotezę stromości.
Tworzenie gradientu Dpp w imaginalnym dysku skrzydła
Kształt gradientu Dpp jest określony przez cztery parametry kinetyczne liganda, na które wpływają parametry biologiczne:
- Efektywny współczynnik dyfuzji , który zależy od dyfuzji pozakomórkowej, szybkości transportu wewnątrzkomórkowego i kinetyki wiązania/rozwijania receptora .
- Efektywne szybkości degradacji zewnątrzkomórkowej i wewnątrzkomórkowej.
- Szybkość produkcji zależna od ścieżki produkcji Dpp.
- Frakcja nieruchoma (parametr związany z metodą stosowaną do pomiaru kinetyki Dpp, FRAP ).
Należy zauważyć, że pojedynczy parametr biologiczny może wpływać na wiele parametrów kinetycznych. Na przykład poziomy receptorów będą wpływać zarówno na współczynnik dyfuzji, jak i na szybkość degradacji.
Jednak mechanizm tworzenia gradientu Dpp jest nadal kontrowersyjny i nie zaproponowano ani nie udowodniono pełnego wyjaśnienia. Cztery główne kategorie teorii stojących za tworzeniem się gradientu to dyfuzja swobodna, dyfuzja ograniczona, transcytoza i transport wspomagany cytonemami .
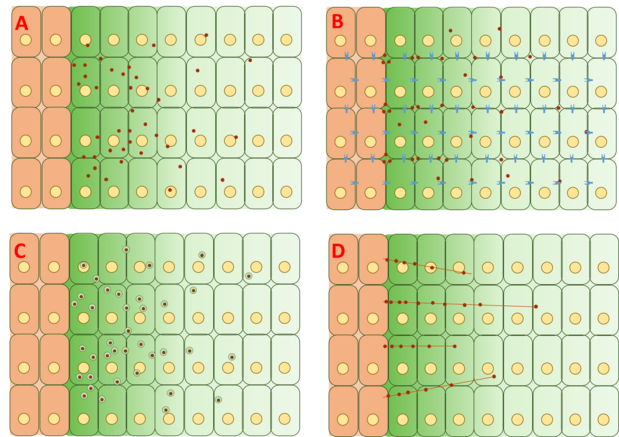
Model swobodnej/ograniczonej dyfuzji
Model swobodnej dyfuzji zakłada, że Dpp swobodnie dyfunduje przez macierz zewnątrzkomórkową, degradując się poprzez zdarzenia degradacji za pośrednictwem receptora. Testy FRAP argumentowały przeciwko temu modelowi, zauważając, że dyfuzja GFP-Dpp nie odpowiada oczekiwanej dla cząsteczki o podobnej wielkości. Jednak inni argumentowali, że ograniczający szybkość powolny krok dalej w dół procesu, taki jak powolne unieruchomienie i / lub powolna degradacja samego Dpp, może wyjaśniać obserwowane różnice w dyfuzji. Pojedyncze cząsteczki Dpp śledzono za pomocą spektroskopii korelacji fluorescencyjnej (FCS), wykazując, że 65% cząsteczek Dpp dyfunduje szybko (zgodnie z modelem swobodnej dyfuzji), a 35% dyfunduje powoli (zgodnie z Dpp związanym z receptorami lub glipikanami ).
Model ograniczonej dyfuzji obejmuje wpływ geometrii upakowania komórek i interakcji z macierzą zewnątrzkomórkową poprzez zdarzenia wiązania z receptorami, takimi jak Tkv i proteoglikany siarczanu heparyny dally i dally -podobne .
Model transcytozy
Model transcytozy zakłada, że Dpp jest transportowany przez powtarzające się rundy endocytozy, w której pośredniczy receptor wewnątrzkomórkowy, z nasileniem gradientu określonym przez endocytotyczne sortowanie Dpp w kierunku recyklingu przez komórki w stosunku do degradacji. Model ten był początkowo oparty na wstępnej obserwacji, że Dpp nie może gromadzić się w klonach, w których krytyczne białko zwane dynaminą , niezbędne do endocytozy, zostało zmutowane do fenotypu shibire ( shi ). Jednak inne eksperymenty wykazały, że Dpp był w stanie gromadzić się na klonach shi , kwestionując model transcytozy. Rewizja teorii stojącej za modelem sugeruje, że endocytoza nie jest niezbędna dla ruchu Dpp, ale bierze udział w sygnalizacji Dpp. Dpp nie porusza się przez komórki ze zmutowanym dally i dally-like , dwoma proteoglikanami siarczanu heparyny (HSPG), powszechnie występującymi w macierzy pozakomórkowej. W rezultacie wyniki te sugerują, że Dpp porusza się wzdłuż powierzchni komórki poprzez ograniczoną dyfuzję pozakomórkową obejmującą dally i dally-like , ale sam transport Dpp nie opiera się na transcytozie.
Model transportu za pośrednictwem cytonemu
Model , w którym pośredniczy cytonem, sugeruje, że Dpp jest bezpośrednio transportowany do komórek docelowych przez oparte na aktynie filopodia zwane cytonemami, które rozciągają się od wierzchołkowej powierzchni komórek reagujących na Dpp do komórek źródłowych wytwarzających Dpp. Zaobserwowano te cytonemy, ale zależność gradientu Dpp od cytonemów nie została ostatecznie udowodniona w wyimaginowanych dyskach skrzydłowych. Wiadomo jednak, że Dpp jest wymagane i wystarczające do rozszerzenia i utrzymania cytonemów. Eksperymenty analizujące dynamikę między Dpp a cytonemami przeprowadzono w zawiązku worka powietrznego, gdzie stwierdzono, że sygnalizacja Dpp ma funkcjonalne powiązanie z cytonemami. Jednak eksperymenty te nie zostały powtórzone w wyimaginowanych dyskach skrzydłowych.
Rola u mięczaków
Dpp występuje również w mięczakach, gdzie odgrywa kluczową rolę w tworzeniu muszli poprzez kontrolowanie kształtu muszli. U małży jest wyrażany, dopóki protokoncha nie przybierze wymaganego kształtu, po czym jego ekspresja ustaje. Jest to również związane z tworzeniem skorupy u ślimaków, z asymetrycznym rozkładem, który może być związany z ich zwijaniem: wydaje się, że wzrost skorupy jest zahamowany, gdy wyraża się Dpp .
Linki zewnętrzne
- Drosophila decapentaplegic - Interaktywna mucha
- dekapentaplegiczny + białko, + Drosophila w US National Library of Medicine Medical Subject Headings (MeSH)