dipeptyd
Dipeptyd jest związkiem organicznym pochodzącym z dwóch aminokwasów . Składowe aminokwasy mogą być takie same lub różne. Gdy są różne, możliwe są dwa izomery dipeptydu, w zależności od sekwencji. Kilka dipeptydów ma znaczenie fizjologiczne, a niektóre mają znaczenie zarówno fizjologiczne, jak i handlowe. Dobrze znanym dipeptydem jest aspartam , sztuczny słodzik .
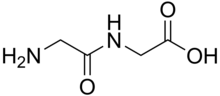
Dipeptydy są białymi ciałami stałymi. Wiele z nich jest znacznie lepiej rozpuszczalnych w wodzie niż macierzyste aminokwasy. Na przykład dipeptyd Ala-Gln ma rozpuszczalność 586 g/l ponad 10-krotnie większą niż rozpuszczalność Gln (35 g/l). Dipeptydy mogą również wykazywać różną stabilność, np. w odniesieniu do hydrolizy. Gln nie wytrzymuje procedur sterylizacji, podczas gdy ten dipeptyd tak. Ponieważ dipeptydy są podatne na hydrolizę, wysoka rozpuszczalność jest wykorzystywana w naparach, czyli do odżywiania.
Przykłady

Wartość handlowa
Około sześciu dipeptydów ma znaczenie komercyjne.
- Aspartam ( N - L -α-aspartylo- L -fenyloalaniny 1-metylowy ester) jest sztucznym słodzikiem .
- Karnozyna ( beta -alanylo- L -histydyna) i anseryna ( beta -alanylo- N -metylohistydyna) są silnie skoncentrowane w tkankach mięśniowych i mózgowych . Stosowane są w medycynie sportowej.
- Acetylokarnozyna , profilaktyka zaćmy
- Ala-Gln i Gly-Tyr, napar
- Val-Tyr, przeciwnadciśnieniowy
Inne dipeptydy
- Homoanseryna ( N- (4-aminobutyryl)-L - histydyna) to kolejny dipeptyd zidentyfikowany w mózgu i mięśniach ssaków.
- Difenyloalanina jest najlepiej zbadanym budulcem w nanotechnologii peptydów
- Kyotorfina ( L -tyrozylo- L -arginina) jest neuroaktywnym dipeptydem , który odgrywa rolę w regulacji bólu w mózgu.
- Balenina (lub ofidyna) ( beta -alanylo- N - tau -metylohistydyna) została zidentyfikowana w mięśniach kilku gatunków ssaków (w tym człowieka) oraz kurczaka .
- Glorin ( ester etylowy N -propionylo-γ- L -glutamylo - L -ornityny-δ-lac) jest dipeptydem chemotaktycznym dla śluzowca Polysphondylium violaceum .
- Barettyna (cyklo-[(6-bromo-8-en-tryptofan)-arginina]) to cykliczny dipeptyd z gąbki morskiej Geodia barretti .
- Pseudoprolina
- Dialanina jest powszechnie stosowana jako model w dynamice molekularnej .
- Xenortides , wyizolowany z bakterii Xenorhabdus nematophila
Produkcja
Syntetyczne dipeptydy
Dipeptydy są wytwarzane przez sprzęganie aminokwasów. Grupa aminowa jednego aminokwasu staje się nienukleofilowa (P w eq), a grupa kwasu karboksylowego w drugim aminokwasie jest dezaktywowana jako jego ester metylowy. Dwa zmodyfikowane aminokwasy są następnie łączone w obecności środka sprzęgającego, który ułatwia tworzenie wiązania amidowego:
- RCH(NHP)CO 2 H + R'CH(NH 2 )CO 2 CH 3 → RCH(NHP)C(O) NH(CHR')CO 2 CH 3 + H 2 O
Po tej reakcji sprzęgania grupa zabezpieczająca grupę aminową P i ester są przekształcane odpowiednio w wolną aminę i kwas karboksylowy.
W przypadku wielu aminokwasów pomocnicze grupy funkcyjne są zabezpieczone . Kondensacja aminy i kwasu karboksylowego w celu utworzenia wiązania peptydowego na ogół wykorzystuje środki sprzęgające do aktywacji kwasu karboksylowego.
Synteza peptydów azlaktonowych Bergmanna jest klasyczną syntezą organiczną służącą do wytwarzania dipeptydów.
Biosynteza
Dipeptydy są wytwarzane z polipeptydów w wyniku działania enzymu hydrolazy peptydazy dipeptydylowej . Białka pokarmowe są trawione do dipeptydów i aminokwasów, a dipeptydy są wchłaniane szybciej niż aminokwasy, ponieważ ich wchłanianie obejmuje odrębny mechanizm. Dipeptydy aktywują komórki G znajdujące się w żołądku do wydzielania gastryny .
Diketopiperazyny (cykliczne dipeptydy)
Diketopiperazyny to specjalna klasa dipeptydów, które są cykliczne. Tworzą się jako produkty uboczne w syntezie peptydów. Wiele zostało wyprodukowanych z niekanonicznych aminokwasów.
Linki zewnętrzne
- Wprowadzenie do dipeptydów w PeptideGuide.
