Retosiban
 | |
| Dane kliniczne | |
|---|---|
| Inne nazwy | GSK-221149-A |
| Kod ATC |
|
| Status prawny | |
| Status prawny |
|
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
| Formuła | C27H34N4O5 _ _ _ _ _ _ _ |
| Masa cząsteczkowa | 494,592 g · mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Retosiban znany również jako GSK-221,149-A jest lekiem doustnym , który działa jako antagonista receptora oksytocyny . Jest opracowywany przez GlaxoSmithKline do leczenia porodu przedwczesnego . Retosiban ma wysokie powinowactwo do receptora oksytocyny (K i = 0,65 nM) i ponad 1400-krotnie większą selektywność w porównaniu z pokrewnymi receptorami wazopresyny
Mechanizm akcji
Retosiban jest kompetycyjnym antagonistą receptora oksytocyny, który blokuje pośredniczone przez oksytocynę skurcze mięśni gładkich macicy w kobiecej macicy, które występują na początku porodu przedwczesnego. Zostało to wykorzystane w celu zapobiegania przedwczesnemu porodowi i przedwczesnemu porodowi .
Farmakologia
Wykazano, że retosiban jest skutecznym lekiem tokolitycznym . Podawany dożylnie i doustnie powoduje zależne od dawki zmniejszenie skurczów macicy wywołanych przez oksytocynę u samic szczurów niebędących w ciąży. U szczurów w późnej ciąży znacznie zmniejsza spontaniczne skurcze macicy w sposób zależny od dawki przy podaniu dożylnym. U ludzi retosiban wydłuża ciążę i zmniejsza liczbę przedwczesnych porodów. Dożylne podanie retosybanu kobietom z samoistnym porodem przedwczesnym wiązało się z większym niż 1-tygodniowym wydłużeniem czasu do porodu w porównaniu z placebo, istotnym zmniejszeniem częstości porodów przedwczesnych, nieistotnym zwiększeniem stanu spoczynku macicy i korzystnym profilem bezpieczeństwa. Wyniki potwierdzają słuszność koncepcji leczenia zagrażającego spontanicznego porodu przedwczesnego
Farmakokinetyka
Biodostępność retosybanu po podaniu doustnym u szczurów jest rzędu 100%, a okres półtrwania wynosi 1,4 godziny. Ma niski do umiarkowanego klirens samoistny w mikrosomach trzech gatunków przedklinicznych (szczur, pies, makak jawajski) oraz niski klirens samoistny w mikrosomach ludzkich. Ma dobry cytochromu P450 (Cyp450) bez znaczącego hamowania, z IC50 > 100 μM, niskim wiązaniem z białkami (<80%) i niską przewidywaną penetracją OUN.
Fizyczne i chemiczne właściwości
W fizjologicznym pH retosiban istnieje w stanie nienaładowanym. Ma dobrą rozpuszczalność (> 0,22 mg/ml), z log 2,2.

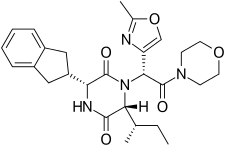
Retosiban składa się z centralnego pierścienia 2,5-diketopiperazyny z grupą R - indanylową w pozycji 3 i R ( S -secButyl) w pozycji 6, oba cis względem siebie, oraz z pierścieniem R -2-metylooksazolowym w pozycji pozycja 7 w amidie acyklicznym przyłączona do pozycji N1. Retosiban jest izomerem (3 R , 6 R , 7 R ) i jest subnanomolowym (Ki = 0,65 nM) antagonistą receptora oksytocyny , podczas gdy (3 R ,6R , 7S ) -izomer, w którym stereochemia w amidowym łańcuchu bocznym przy C-7 jest odwrócona, jest 10-krotnie słabszy. Zazwyczaj w tej serii 2,5 diketopiperazynowych antagonistów oksytocyny izomer (3S , 6S , 7S ) jest >500 mniej aktywny niż izomer (3R , 6R , 7R ) . Oprócz podstawowego rdzenia 2,5-diketopiperazyny, retosiban zawiera również kilka cech strukturalnych, które poprawiają jego skuteczność i bezpieczeństwo. Indanyl _ grupa w pozycji 3 jest najlepszym wyborem pod względem siły działania antagonisty receptora oksytocyny, jej zastąpienie grupami fenetylową i benzylową prowadziło do postępującego osłabienia aktywności. Wykazano, że przy C-3 preferowany jest 4-węglowy rozgałęziony alkil, przy czym R ( S -secButyl) jest najlepszy; mniejsze grupy alkilowe skutkują zmniejszoną aktywnością antagonisty. Pierścień 2-metylooksazolowy w pozycji 7 zapewnia dobrą rozpuszczalność w wodzie, niskie wiązanie z białkami i minimalne oddziaływanie Cyp450. Ta relacja struktura-aktywność (SAR) wspierana jest przez strukturę krystaliczną ludzkiego receptora oksytocyny w kompleksie z retosibanem, gdzie lipofilowy podstawnik indanylowy wnika w głęboką, głównie hydrofobową szczelinę na dnie kieszeni wiążącej, podczas gdy ugrupowanie oksazolowo-morfolinoamidowe jest najbliżej powierzchnię zewnątrzkomórkową. Pierścień oksazolowy jest najbardziej eksponowanym na rozpuszczalnik podstawnikiem, a pierścień morfolinowy nie ma bezpośrednich interakcji z receptorem. Rdzeń 2,5-diketopiperazyny specyficznie oddziałuje z receptorem poprzez polarny interfejs interakcji.
Synteza
Retosiban jest cyklicznym dipeptydem lub 2,5-diketopiperazyną , które powstają w wyniku cyklizacji odpowiedniego liniowego dipeptydu. W krótkiej skali laboratoryjnej i wysoce stereoselektywnej syntezie Retosibanu 8 liniowy peptyd 5 jest tworzony przez czteroskładnikową reakcję Ugi karboksybenzylu (Cbz) chronionego R-indanyloglicyny 1 , D-alloizoleucyny chlorowodorku estru metylowego 2 , 2-metyloksazolo- 4-karboksyaldehyd 3 i 2-benzyloksyfenyloizonitryl 4 . Uwodornienie w celu usunięcia zabezpieczających grup Cbz i benzylu umożliwiło zajście cyklizacji liniowego peptydu 5 z wytworzeniem cyklicznego dipeptydu fenolowego 6 . Hydroliza amidu fenolowego w reakcji z karbonylodiimidazolem (CDI), a następnie dodanie wodnego roztworu kwasu chlorowodorowego dała kwas 7 , który został przekształcony w amid Retosiban 8 przez aktywację kwasu odczynnikiem sprzęgającym peptydy PyBOP (heksafluorofosforan benzotriazol-1-iloksytripirolidynofosfoniowy ), a następnie dodanie morfoliny . Chociaż liniowy peptyd 5 i cykliczny dipeptyd 6 są mieszaniną diastereoizomerów (7 RS ) w egzocyklicznym amidzie, hydroliza kwasem chlorowodorowym aktywowanego fenoloamidu spowodowała epimeryzację w pozycji egzocyklicznej i dała kwas 7 o wymaganym (7 R )-stereochemia jako główny produkt.
![A synthetic scheme for the production of Retosiban via the Ugi reaction.[4]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Synthesis_of_Retosiban.svg/750px-Synthesis_of_Retosiban.svg.png)