karbonylodiimidazol

|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Di(1H - imidazol-1-ilo)metanon |
|
| Inne nazwy N,N'-karbonylodiimidazolu CDI Staab |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.007.718 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C7H6N4O _ _ _ _ _ _ | |
| Masa cząsteczkowa | 162,152 g·mol -1 |
| Wygląd | Biały drobny proszek |
| Temperatura topnienia | 119 ° C (246 ° F; 392 K) |
| Reaguje z wodą | |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Działa żrąco na niektóre metale, powoduje poważne oparzenia chemiczne w kontakcie ze skórą lub oczami. |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H302 , H314 , H315 , H319 | |
| P260 , P264 , P270 , P280 , P301 + P312 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P330 , P332 + P313 , P337+ P313 , P362 , P363 , P405 , P501 | |
| Karta charakterystyki (SDS) | Zewnętrzna karta charakterystyki |
| Związki pokrewne | |
|
Związki pokrewne
|
fosgen , imidazol |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
1,1'-karbonylodiimidazol ( CDI ) jest związkiem organicznym o wzorze cząsteczkowym (C 3 H 3 N 2 ) 2 CO. Jest białą krystaliczną substancją stałą . Jest często używany do sprzęgania aminokwasów w syntezie peptydów oraz jako odczynnik w syntezie organicznej .
Przygotowanie
CDI można otrzymać bezpośrednio w reakcji fosgenu z czterema równoważnikami imidazolu w warunkach bezwodnych. Usunięcie produktu ubocznego, chlorku imidazoliowego i rozpuszczalnika daje krystaliczny produkt z ~90% wydajnością.
- 4 C 3 H 4 N 2 + C(O)Cl 2 → (C 3 H 3 N 2 ) 2 CO + 2 [C 3 H 3 N 2 H 2 ] Cl
W tej konwersji imidazol służy zarówno jako nukleofil, jak i zasada. Alternatywny prekursor 1-(trimetylosililo)imidazol wymaga większego nakładu pracy przygotowawczej z tą zaletą, że produkt uboczny chlorku trimetylosililu jest lotny.
CDI łatwo hydrolizuje, dając z powrotem imidazol:
- (C 3 H 3 N 2 ) 2 CO + H 2 O → 2 C 3 H 4 N 2 + CO 2
Czystość CDI można określić na podstawie ilości CO2 , który powstaje podczas hydrolizy.
Użyj w syntezie
CDI stosuje się głównie do konwersji amin w amidy , karbaminiany , moczniki . Może być również używany do przekształcania alkoholi w estry .
Pochodne kwasu
Tworzenie amidu jest promowane przez CDI. Chociaż reaktywność CDI jest mniejsza niż chlorków kwasowych , jest łatwiejsza w obsłudze i pozwala uniknąć stosowania chlorku tionylu w tworzeniu chlorków kwasowych, co może powodować reakcje uboczne. Wczesne zastosowanie tego typu reakcji odnotowano w tworzeniu wiązań peptydowych (z tworzeniem CO 2 jako siłą napędową). Proponowany mechanizm reakcji kwasu karboksylowego z CDI przedstawiono poniżej.
W dziedzinie syntezy peptydów produkt ten można potraktować aminą, taką jak ta występująca w aminokwasie, w celu uwolnienia grupy imidazolowej i połączenia peptydów. Produkty uboczne, dwutlenek węgla i imidazol, są stosunkowo nieszkodliwe. Racemizacja aminokwasów również wydaje się być minimalna, co odzwierciedla łagodne warunki reakcji.
CDI można również stosować do estryfikacji , chociaż alkoholiza wymaga ciepła lub obecności silnych nukleofili, takich jak etanolan sodu lub inne mocne zasady, takie jak NaH. Ta reakcja ma ogólnie dobrą wydajność i szeroki zakres, chociaż tworzenie estru z trzeciorzędowych alkoholi, gdy odczynnik kwasowy ma stosunkowo kwaśny α-proton, jest kłopotliwe, ponieważ mogą wystąpić kondensacje CC , chociaż sama w sobie może być pożądaną reakcją. Podobna reakcja z udziałem tioli i selenoli może dać odpowiednie estry. Reakcję alkoholową można również wykorzystać do utworzenia wiązań glikozydowych.
Podobnie zamiast alkoholu można użyć kwasu, aby utworzyć bezwodnik , chociaż bardziej typowym odczynnikiem jest dicykloheksylokarbodiimid . Równowagę można przesunąć na korzyść bezwodnika, stosując kwas w stosunku 2:1, który tworzy nierozpuszczalną sól z imidazolem . Typowymi kwasami są kwasy trifluoro- i trichlorooctowe . W ten sposób można utworzyć symetryczne bezwodniki, zastępując tę grupę trifluoro- lub trichloroacetylową kwasem, który został użyty do utworzenia pierwotnego odczynnika.
Inną pokrewną reakcją jest reakcja kwasu mrówkowego z CDI, w wyniku której powstaje formylizowany imidazol. Odczynnik ten jest dobrym środkiem formylującym i może regenerować niepodstawiony imidazol (z tworzeniem tlenku węgla) po podgrzaniu.
Jeszcze inna reakcja obejmuje acylowanie trifenyloalkelynofosforanów.
-
(C 6 H 5 ) 3 P=CHR + R'-CO-Im → (C 6 H 5 ) 3 P + -CHR-COR' + Im − (C 6 H 5 ) 3 P + -CHR-COR' + (C 6 H 5 ) 3 P=CHR → (C 6 H 5 ) 3 P=CR-COR' + (C 6 H 5 ) 3 P + -CH 2 R
-
Mogą one ulegać reakcji Wittiga , tworząc α,β nienasycone ketony lub aldehydy.
Odczynnik może nawet przejść reakcję z nadtlenkiem , tworząc kwas peroksykarboksylowy , który może dalej reagować, tworząc nadtlenki diacylu. Grupa imidazolowa jest również redukowana przez LiAlH4 , tworząc aldehydy z kwasu karboksylowego (raczej niż aminy lub alkohole). Odczynnik można również poddać reakcji z odczynnikami Grignarda z wytworzeniem ketonów.
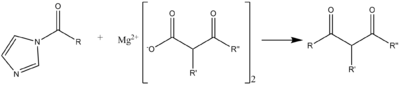
Reakcja acylowania CC może zachodzić ze związkiem typu estru malonowego , na poniższym schemacie przydatnym do syntez antybiotyków makrolidowych.
Inne reakcje
N-fenyloimino pochodną CDI można utworzyć w reakcji podobnej do Wittiga z fenyloimidem trifenylofosfiny .
- OCIm 2 + Ph 3 P=NPh → PhN=CIm 2 + Ph 3 PO
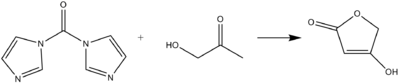
CDI może działać jako równoważnik karbonylu w tworzeniu kwasów tetronowych lub pulwinonów z hydroksyketonów i diketonów w warunkach zasadowych.
Alkohol traktowany co najmniej 3 równoważnikami aktywowanego halogenku (takiego jak bromek allilu lub jodometan) i CDI daje odpowiedni halogenek z dobrą wydajnością. Bromowanie i jodowanie działają najlepiej, chociaż ta reakcja nie zachowuje stereochemii alkoholu. W podobnym kontekście CDI jest często używany w reakcjach odwodnienia.
Ponieważ CDI jest odpowiednikiem fosgenu , może być stosowany w podobnej reakcji, jednak z podwyższoną selektywnością: pozwala na syntezę asymetrycznych węglanów bis-alkilowych
Zobacz też
- Tiokarbonylodiimidazol (TCDI) analog tiomocznika
- ^ a b c d e f HA Staab (1962). „Syntezy z użyciem heterocyklicznych amidów (azolidków)”. Angewandte Chemie International Edition w języku angielskim . 1 (7): 351–367. doi : 10.1002/anie.196203511 .
- ^ HA Staab i K. Wendel (1973). „1,1'-karbonylodiimidazol” . Syntezy organiczne . ; Tom zbiorowy , obj. 5, str. 201
- ^ a b c d A. Armstrong; Wenju Li (2007). „N, N'-karbonylodiimidazol”. Encyklopedia odczynników do syntezy organicznej . doi : 10.1002/9780470842898.rc024.pub2 .
- ^ Staab, Heinz A.; Maleck, Gerhard (1966). "Über den Mechanismus der Reaktion von N.N'-Carbonyl-di-azolen mit Carbonsäuren zu Carbonsäure-azoliden" . Chemische Berichte (w języku niemieckim). 99 (9): 2955–2961. doi : 10.1002/cber.19660990931 .
- ^ R. Paul i GW Anderson (1960). „N, N'-karbonylodiimidazol, nowy odczynnik tworzący peptyd ”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 82 (17): 4596–4600. doi : 10.1021/ja01502a038 .
- Bibliografia _ Gais (1977). „Synteza estrów tiolu i selenolu z odpowiednio kwasów karboksylowych i tioli lub selenoli”. Angewandte Chemie International Edition w języku angielskim . 16 (4): 244–246. doi : 10.1002/anie.197702441 .
- ^ MJ Ford i SV Ley (1990). „Prosta, jednonaczyniowa procedura glikozydacji poprzez (1-imidazolilokaronylo) glikozydy i bromek cynku”. Synlett . 1990 (5): 255–256. doi : 10.1055/s-1990-21053 .
- Bibliografia _ i in. (1979). „C-Acylowanie w warunkach praktycznie neutralnych”. Angewandte Chemie International Edition w języku angielskim . 18 : 72–74. doi : 10.1002/anie.197900722 .
- Bibliografia _ i in. (1979). „Łatwa synteza prostych kwasów tetronowych i pulwinonów”. Litery czworościanu . 20 (47): 4517–4520. doi : 10.1016/S0040-4039(01)86637-5 .
- ^ Steve P. Rannard, Nicola J. Davis (1999). „Kontrolowana synteza asymetrycznych węglanów dialkilu i cyklicznych przy użyciu wysoce selektywnych reakcji estrów karboksylowych imidazolu”. Listy organiczne . 1 (6): 933–936. doi : 10.1021/ol9908528 .