kalcytonina
| CALCA | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , CT, CGRP-I, CGRP-alfa, KC, PCT, polipeptyd alfa związany z kalcytoniną, CGRP, CGRP1, CALC1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
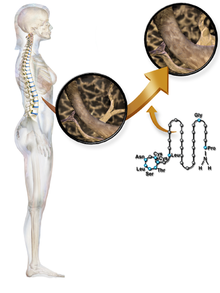
Kalcytonina jest hormonem peptydowym składającym się z 32 aminokwasów, wydzielanym przez komórki okołopęcherzykowe (znane również jako komórki C) tarczycy ( lub endostylu ) u ludzi i innych akordów ciała ultimopharyngeal . Działa redukująco wapń we krwi (Ca 2+ ), przeciwstawiając się działaniu hormonu przytarczyc (PTH).
Jego znaczenie dla ludzi nie zostało tak dobrze ustalone, jak jego znaczenie dla innych zwierząt, ponieważ jego funkcja zwykle nie jest istotna w regulacji normalnej homeostazy wapnia . Należy do rodziny białek podobnych do kalcytoniny .
Historycznie kalcytonina była również nazywana tyrokalcytoniną. [ potrzebne źródło ]
Biosynteza i regulacja
Kalcytonina powstaje w wyniku proteolitycznego rozszczepienia większego prepropeptydu , który jest produktem genu CALC1 ( CALCA ). Funkcjonalnie jest antagonistą PTH i witaminy D3. Gen CALC1 należy do nadrodziny pokrewnych prekursorów hormonów białkowych, w tym białka prekursorowego amyloidu wysepek , peptydu związanego z genem kalcytoniny i prekursora adrenomeduliny .
Wydzielanie kalcytoniny jest stymulowane przez:
- wzrost stężenia [Ca 2+ ] w surowicy
- gastryna i pentagastryna .
Funkcjonować
Hormon uczestniczy w metabolizmie wapnia (Ca 2+ ). Pod wieloma względami kalcytonina przeciwdziała parathormonowi (PTH) i witaminie D.
Mówiąc dokładniej, kalcytonina obniża poziom Ca 2+ we krwi na dwa sposoby:
- Główny efekt: Hamuje aktywność osteoklastów w kościach , które rozkładają kość
- Niewielkie działanie: hamuje reabsorpcję Ca 2+ i fosforanów w komórkach kanalików nerkowych , umożliwiając ich wydalanie z moczem
Wysokie stężenia kalcytoniny mogą zwiększać wydalanie wapnia i fosforanów z moczem przez kanaliki nerkowe . prowadząc do wyraźnej hipokalcemii. Jest to jednak niewielki efekt bez znaczenia fizjologicznego u ludzi. Jest to również efekt krótkotrwały, ponieważ nerki stają się oporne na kalcytoninę, o czym świadczy niezakłócone wydalanie wapnia przez nerki u pacjentów z guzami tarczycy, które wydzielają nadmiar kalcytoniny.
W swoich działaniach chroniących szkielet, kalcytonina chroni przed utratą wapnia z kośćca w okresach mobilizacji wapnia, takich jak ciąża , a zwłaszcza laktacja . Mechanizmy ochronne obejmują bezpośrednie hamowanie resorpcji kości oraz działanie pośrednie poprzez hamowanie uwalniania prolaktyny z przysadki mózgowej. Podany powód jest taki, że prolaktyna indukuje uwalnianie peptydu związanego z PTH, który zwiększa resorpcję kości, ale jest to nadal przedmiotem badań.
Inne skutki to zapobieganie hiperkalcemii poposiłkowej wynikającej z wchłaniania Ca2 + . Ponadto kalcytonina hamuje przyjmowanie pokarmu u szczurów i małp i może działać na ośrodkowy układ nerwowy , obejmujący regulację łaknienia i apetytu.
Kalcytonina obniża stężenie wapnia i fosforu we krwi głównie poprzez hamowanie osteoklastów. Osteoblasty nie mają receptorów kalcytoniny i dlatego poziom kalcytoniny nie ma na nie bezpośredniego wpływu. Jednakże, ponieważ resorpcja kości i tworzenie kości są procesami sprzężonymi, ostatecznie hamowanie aktywności osteoklastów przez kalcytoninę prowadzi do zwiększonej osteoblastów (jako efekt pośredni).
Chwytnik
Receptor kalcytoniny jest receptorem sprzężonym z białkiem G zlokalizowanym w osteoklastach , a także w komórkach nerek i mózgu. Jest sprzężony z przez Gs α , stymulując w ten sposób produkcję cAMP cyklazę adenylanową w komórkach docelowych. Może również wpływać na jajniki u kobiet i jądra u mężczyzn. [ potrzebne źródło ]
Odkrycie
Kalcytonina została po raz pierwszy oczyszczona w 1962 roku przez Douglasa Harolda Coppa i B. Cheneya na Uniwersytecie Kolumbii Brytyjskiej w Kanadzie. Początkowo sądzono, że jest wydzielany przez przytarczyce , ale Iain Macintyre i jego zespół z Royal Postgraduate Medical School w Londynie wykazali , że jest wydzielany przez komórki okołopęcherzykowe tarczycy . Dr Copp nazwał odkryty hormon kalcytoniną ze względu na jego rolę w „utrzymywaniu prawidłowego tonu wapnia”.
Znaczenie medyczne
Oznaczenie kalcytoniny służy do identyfikacji pacjentów z guzkowatymi chorobami tarczycy. Jest pomocny we wczesnym rozpoznaniu raka rdzeniastego tarczycy. Nowotwór złośliwy komórek okołopęcherzykowych, tj. rak rdzeniasty tarczycy, zazwyczaj powoduje podwyższenie poziomu kalcytoniny w surowicy. Rokowanie w RRT zależy od wczesnego wykrycia i leczenia.
Kalcytonina wywarła również znaczący wpływ na biologię molekularną , ponieważ gen kodujący kalcytoninę był pierwszym genem odkrytym w komórkach ssaków , który uległ alternatywnemu splicingowi , a obecnie wiadomo , że jest to wszechobecny mechanizm u eukariontów .
Farmakologia
Kalcytonina jest klinicznie stosowana w metabolicznych zaburzeniach kości od ponad 50 lat. Kalcytonina łososiowa jest stosowana w leczeniu:
Został zbadany jako możliwe nieoperacyjne leczenie zwężenia kanału kręgowego .
Poniższe informacje pochodzą z brytyjskiego Electronic Medicines Compendium
Ogólna charakterystyka substancji czynnej
Kalcytonina łososiowa jest szybko wchłaniana i wydalana. Maksymalne stężenie w osoczu osiągane jest w ciągu pierwszej godziny po podaniu.
Badania na zwierzętach wykazały, że po podaniu pozajelitowym kalcytonina jest metabolizowana głównie w procesie proteolizy w nerkach. Metabolity nie mają specyficznej aktywności biologicznej kalcytoniny. Biodostępność po wstrzyknięciu podskórnym i domięśniowym u ludzi jest wysoka i podobna dla obu dróg podania (odpowiednio 71% i 66%).
Kalcytonina ma krótkie okresy półtrwania wchłaniania i eliminacji, odpowiednio 10–15 minut i 50–80 minut. Kalcytonina łososiowa jest głównie i prawie wyłącznie rozkładana w nerkach, tworząc farmakologicznie nieaktywne fragmenty cząsteczki. Dlatego klirens metaboliczny jest znacznie niższy u pacjentów ze schyłkową niewydolnością nerek niż u osób zdrowych. Jednak znaczenie kliniczne tego odkrycia nie jest znane. Wiązanie z białkami osocza wynosi od 30% do 40%.
Charakterystyka u pacjentów
Istnieje związek między podskórną dawką kalcytoniny a maksymalnym stężeniem w osoczu. Po pozajelitowym podaniu 100 j.m. kalcytoniny maksymalne stężenie w osoczu wynosi od około 200 do 400 pg/ml. Wyższe poziomy we krwi mogą być związane ze zwiększoną częstością występowania nudności, wymiotów i biegunki sekrecyjnej.
Przedkliniczne dane dotyczące bezpieczeństwa
Konwencjonalne długoterminowe badania toksyczności, reprodukcji, mutagenności i rakotwórczości przeprowadzono na zwierzętach laboratoryjnych. Kalcytonina łososiowa jest pozbawiona potencjału embriotoksycznego, teratogennego i mutagennego.
U szczurów, którym podawano syntetyczną kalcytoninę łososiową przez 1 rok, zgłaszano zwiększoną częstość występowania gruczolaków przysadki. Uważa się, że jest to działanie specyficzne dla gatunku i niemające znaczenia klinicznego. Kalcytonina łososiowa nie przenika przez barierę łożyskową.
U zwierząt w okresie laktacji, którym podawano kalcytoninę, obserwowano zahamowanie produkcji mleka. Kalcytonina jest wydzielana do mleka.
Produkcja farmaceutyczna
Kalcytoninę ekstrahowano z gruczołów ultimobranchialnych (gruczołów tarczopodobnych) ryb, zwłaszcza łososia. Kalcytonina łososiowa przypomina ludzką kalcytoninę, ale jest bardziej aktywna. Obecnie jest wytwarzany za pomocą rekombinacji DNA lub chemicznej syntezy peptydów . Wykazano, że właściwości farmakologiczne syntetycznych i rekombinowanych peptydów są jakościowo i ilościowo równoważne.
Zastosowania kalcytoniny
Zabiegi
Kalcytoninę można stosować terapeutycznie w leczeniu hiperkalcemii lub osteoporozy . W niedawnym badaniu klinicznym podskórne wstrzyknięcia kalcytoniny zmniejszyły częstość złamań i zmniejszyły spadek masy kostnej u kobiet z cukrzycą typu 2 powikłaną osteoporozą.
Podskórne wstrzyknięcia kalcytoniny u pacjentów z manią spowodowały znaczne zmniejszenie drażliwości, euforii i nadpobudliwości, a zatem kalcytonina jest obiecująca w leczeniu choroby afektywnej dwubiegunowej . Jednak nie zgłoszono żadnych dalszych prac nad tym potencjalnym zastosowaniem kalcytoniny.
Diagnostyka
Może być stosowany diagnostycznie jako marker nowotworowy raka rdzeniastego tarczycy , w którym może występować wysoki poziom kalcytoniny, a podwyższony poziom po operacji może wskazywać na wznowę. Można go nawet stosować w przypadku biopsji próbek podejrzanych zmian (np. obrzękniętych węzłów chłonnych ) w celu ustalenia, czy są to przerzuty pierwotnego nowotworu.
że wartości odcięcia dla kalcytoniny w celu rozróżnienia przypadków raka rdzeniastego tarczycy są następujące, przy czym wyższa wartość zwiększa podejrzenie raka rdzeniastego tarczycy:
- kobiety: 5 ng/L lub pg/ml
- mężczyźni: 12 ng/L lub pg/ml
- dzieci poniżej 6 miesiąca życia: 40 ng/L lub pg/ml
- dzieci w wieku od 6 miesięcy do 3 lat: 15 ng/L lub pg/ml
W wieku powyżej 3 lat można stosować odcięcia dla dorosłych
W przeglądzie systematycznym Cochrane'a oceniono dokładność diagnostyczną podstawowej i stymulowanej kalcytoniny w przypadku raka rdzeniastego tarczycy. Chociaż zarówno podstawowe, jak i łączone podstawowe i stymulowane oznaczanie kalcytoniny charakteryzowało się wysoką dokładnością ( czułość : od 82% do 100%; specyficzność : od 97,2% do 100%), wyniki te wiązały się z dużym ryzykiem błędu systematycznego z powodu błędów projektowych włączonych badań. Ogólnie rzecz biorąc, wartość rutynowego oznaczania kalcytoniny w diagnostyce i prognozowaniu raka rdzeniastego tarczycy pozostaje niepewna i wątpliwa.
Podwyższone poziomy kalcytoniny zgłaszano również w przypadku różnych innych schorzeń. Należą do nich: rozrost komórek C, rak pozatarczycowy z komórek owsa, rak pozatarczycowy i inne nowotwory niezwiązane z tarczycą, ostre uszkodzenie nerek i przewlekła niewydolność nerek , hiperkalcemia , hipergastrynemia i inne zaburzenia żołądkowo-jelitowe oraz choroby płuc .
Struktura
Kalcytonina jest hormonem polipeptydowym złożonym z 32 aminokwasów, o masie cząsteczkowej 3454,93 daltonów. Jego struktura obejmuje pojedynczą helisę alfa. Alternatywny splicing genu kodującego kalcytoninę daje daleko spokrewniony peptyd o długości 37 aminokwasów, zwany peptydem związanym z genem kalcytoniny (CGRP), typu beta.
Poniżej przedstawiono sekwencje aminokwasowe kalcytoniny łososiowej i ludzkiej: [ potrzebne źródło ]
- łosoś:
Cys-Ser-Asn-Leu-Ser-Thr-Cys-Val-Leu-Gly-Lys-Leu-Ser-Gln-Glu-Leu-His-Lys-Leu-Gln-Thr-Tyr-Pro-Arg-Thr- Asn-Thr-Gly-Ser-Gly-Thr-Pro
- człowiek:
Cys-Gly-Asn-Leu-Ser-Thr-Cys-Met-Leu-Gly-Thr-Tyr-Thr-Gln-Asp-Phe-Asn-Lys-Phe-His-Thr-Phe-Pro-Gln-Thr- Ala-Ile-Gly-Val-Gly-Ala-Pro
W porównaniu z kalcytoniną łososiową kalcytonina ludzka różni się 16 resztami.
Badania
Oprócz postaci dawkowania kalcytoniny łososiowej do wstrzykiwania i aerozolu do nosa, trwają obecnie badania kliniczne nieinwazyjnych preparatów doustnych peptydu. Krótki okres półtrwania tego peptydu w surowicy spowodował kilka prób zwiększenia jego stężenia w osoczu. Peptyd jest skompleksowany z makrocząsteczką, która działa jak wzmacniacz wchłaniania przez szlak transkomórkowy i dodatkowo chroni peptyd przed ostrym pH i warunkami enzymatycznymi przewodu pokarmowego. To kompleksowanie jest słabe, niekowalencyjne i odwracalne, a lek pozostaje niezmodyfikowany chemicznie. Po przejściu przez jelito środek dostarczający dysocjuje od peptydu. Jednym z szeroko przebadanych preparatów doustnych są sole disodowe kalcytoniny doustnej 5-CNAC. Ta nowatorska platforma doustna w wielu badaniach klinicznych w różnych fazach wykazała obiecujący ulepszony profil farmakokinetyczny, wysoką biodostępność, ugruntowane bezpieczeństwo i porównywalną skuteczność do kalcytoniny podawanej donosowo, zwłaszcza w leczeniu postmenopauzalnej utraty masy kostnej.
Zobacz też
Dalsza lektura
- MacIntyre I, Alevizaki M, Bevis PJ, Zaidi M (kwiecień 1987). „Kalcytonina i peptydy z genu kalcytoniny”. Ortopedia kliniczna i pokrewne badania . 217 (217): 45–55. doi : 10.1097/00003086-198704000-00007 . PMID 3549095 .
- Di Angelantonio S, Giniatullin R, Costa V, Sokolova E, Nistri A (lipiec 2003). „Modulacja funkcji neuronalnego receptora nikotynowego przez neuropeptydy CGRP i substancję P na autonomiczne komórki nerwowe” . Brytyjski Dziennik Farmakologii . 139 (6): 1061–1073. doi : 10.1038/sj.bjp.0705337 . PMC 1573932 . PMID 12871824 .
- Findlay DM, Sexton PM (grudzień 2004). „Kalcytonina”. Czynniki wzrostu . 22 (4): 217–224. doi : 10.1080/08977190410001728033 . PMID 15621724 . S2CID 218910711 .
- Sponholz C, Sakr Y, Reinhart K, Brunkhorst F (2007). „Wartość diagnostyczna i implikacje prognostyczne prokalcytoniny w surowicy po operacji kardiochirurgicznej: systematyczny przegląd literatury” . Intensywna opieka . 10 (5): 145 zł. doi : 10.1186/cc5067 . PMC 1751067 . PMID 17038199 .
- Schneider HG, Lam QT (sierpień 2007). „Prokalcytonina dla laboratorium klinicznego: przegląd”. Patologia . 39 (4): 383–390. doi : 10.1080/00313020701444564 . PMID 17676478 . S2CID 28018130 .
- Grani G, Nesca A, Del Sordo M, Calvanese A, Carbotta G, Bianchini M, Fumarola A (czerwiec 2012). „Interpretacja kalcytoniny w surowicy u pacjentów z przewlekłym autoimmunologicznym zapaleniem tarczycy” . Rak pochodzenia endokrynologicznego . Nauka biologiczna . 19 (3): 345–349. doi : 10.1530/ERC-12-0013 . PMID 22399011 .
Linki zewnętrzne
- Białko kalcytoniny
- Kalcytonina w US National Library of Medicine Medical Subject Headings (MeSH)