neurotensyna
| NTS | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , NMN-125, NN, NT, NT/N, NTS1, neurotensyna | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| prekursorów neurotensyny/neuromedyny N | |||||||||
| Symbol | Pro-NT_NN | ||||||||
| Pfam | PF07421 | ||||||||
| InterPro | IPR008055 | ||||||||
| Nadrodzina OPM | 257 | ||||||||
| Białko OPM | 2oyv | ||||||||
| |||||||||

|
|
| Identyfikatory | |
|---|---|
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
|
|
|
| Nieruchomości | |
| C 78 H 121 N 21 O 20 | |
| Masa cząsteczkowa | 1672,92 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
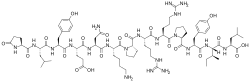
Neurotensyna jest neuropeptydem składającym się z 13 aminokwasów , który bierze udział w regulacji uwalniania hormonu luteinizującego i prolaktyny oraz ma istotne interakcje z układem dopaminergicznym . Neurotensyna została po raz pierwszy wyizolowana z ekstraktów z podwzgórza bydlęcego w oparciu o jej zdolność do powodowania widocznego rozszerzenia naczyń krwionośnych w odsłoniętych obszarach skóry znieczulonych szczurów.
Neurotensyna jest rozprowadzana po całym ośrodkowym układzie nerwowym, z najwyższymi stężeniami w podwzgórzu , ciele migdałowatym i jądrze półleżącym . Wywołuje różnorodne efekty, w tym działanie przeciwbólowe, hipotermię i zwiększoną aktywność lokomotoryczną. Bierze również udział w regulacji szlaków dopaminergicznych. Na obwodzie neurotensyna znajduje się w komórkach enteroendokrynnych jelita cienkiego, gdzie prowadzi do wydzielania i skurczu mięśni gładkich .
Sekwencja i biosynteza
Neurotensyna ma znaczące podobieństwo sekwencji w swoich 6 C-końcowych aminokwasach z kilkoma innymi neuropeptydami, w tym neuromedyną N (która pochodzi z tego samego prekursora). Ten region C-końcowy jest odpowiedzialny za pełną aktywność biologiczną , część N-końcowa pełni rolę modulującą. Prekursor neurotensyny / neuromedyny N można również przetwarzać w celu wytworzenia dużych peptydów o długości 125–138 aminokwasów z sekwencją N neurotensyny lub neuromedyny na ich C-końcu. Te duże peptydy wydają się być słabsze niż ich mniejsze odpowiedniki, ale są również mniej wrażliwe na degradację i mogą stanowić endogenne, długotrwałe aktywatory w wielu sytuacjach patofizjologicznych.
Sekwencję neurotensyny bydlęcej określono jako piroGlu-Leu-Tyr-Glu-Asn-Lys-Pro-Arg-Arg-Pro-Tyr-Ile-Leu-OH. Neurotensyna jest syntetyzowana jako część białka prekursorowego o długości 169 lub 170 aminokwasów, które zawiera również pokrewny neuropeptyd neuromedynę N. Domeny kodujące peptydy są zlokalizowane w tandemie w pobliżu końca karboksylowego prekursora i są ograniczone i oddzielone miejscami przetwarzania sparowanych aminokwasów zasadowych (lizyna-arginina).
Znaczenie kliniczne
Neurotensyna jest silnym mitogenem raka jelita grubego .
Neurotensyna jest zaangażowana w modulację sygnalizacji dopaminowej i wywołuje spektrum efektów farmakologicznych przypominających działanie leków przeciwpsychotycznych , co prowadzi do sugestii, że neurotensyna może być endogennym neuroleptykiem . Myszy z niedoborem neurotensyny wykazują defekty w odpowiedzi na kilka leków przeciwpsychotycznych, co jest zgodne z ideą, że sygnalizacja neurotensyny jest kluczowym elementem leżącym u podstaw przynajmniej niektórych działań leków przeciwpsychotycznych. Myszy te wykazują niewielkie defekty w hamowaniu przedimpulsowym (PPI) odruchu przestrachu , model, który był szeroko stosowany do badania działania leków przeciwpsychotycznych u zwierząt. Podawanie leków przeciwpsychotycznych zwiększa PPI w pewnych warunkach. Porównania między myszami normalnymi i myszami z niedoborem neurotensyny ujawniły uderzające różnice w zdolności różnych leków przeciwpsychotycznych do zwiększania PPI. Podczas gdy atypowy lek przeciwpsychotyczny klozapina zwiększał PPI normalnie u myszy z niedoborem neurotensyny, konwencjonalny przeciwpsychotyczny haloperidol i nowszy atypowy przeciwpsychotyczny kwetiapina były nieskuteczne u tych myszy, w przeciwieństwie do normalnych myszy, u których leki te znacznie zwiększały PPI. Wyniki te sugerują, że niektóre leki przeciwpsychotyczne wymagają neurotensyny do przynajmniej części swoich efektów. Myszy z niedoborem neurotensyny wykazują również defekty w aktywacji prążkowia po haloperidolu, ale nie klozapiny w porównaniu z normalnymi myszami typu dzikiego, co wskazuje, że neurotensyna prążkowia jest wymagana do pełnego spektrum odpowiedzi neuronalnych na podzbiór leków przeciwpsychotycznych.
Neurotensyna jest endogennym neuropeptydem zaangażowanym w termoregulację , który może wywoływać hipotermię i neuroprotekcję w eksperymentalnych modelach niedokrwienia mózgu .
Ekspresja genu
Wykazano, że ekspresja genu neurotensyny jest modulowana przez estrogen zarówno w hodowlach ludzkich komórek nerwiaka niedojrzałego SK-N-SH , jak iu myszy poprzez interakcje z sygnalizacją cyklicznego AMP (cAMP). Konkretnie, estrogen zwiększył aktywność cAMP i fosforylację białka wiążącego element odpowiedzi cAMP w komórkach nerwiaka niedojrzałego przed indukcją transkrypcji genu neurotensyny . Dodatkowo transkrypcja genu neurotensyny została zablokowana u myszy pozbawionych podjednostki RIIβ kinazy białkowej A holoenzym. Odkrycia te mogą wskazywać na mechanizmy sygnalizacji przesłuchowej w aktywności hormonów mózgowych i ekspresji genów związanych z hormonami. Inne zmiany związane z hormonami płciowymi w ekspresji neurotensyny były związane z aktywnością w obszarze preoptycznym . Wykazano, że u samic szczurów ekspresja neurotensyny była najwyższa w przyśrodkowej okolicy przedwzrokowej (mPOA) podczas fazy przedrujowej cyklu rujowego .
U samic myszy po porodzie wykazano zmienioną ekspresję genów neurotensyny, jak również genów receptora neurotensyny. Podczas gdy receptora neurotensyny 1 (Ntsr1) w jądrze przykomorowym podwzgórza (PVN) było obniżone, wykazano, że mRNA neurotensyny, ale nie neurotensyny, jest wyższe w PVN. MRNA neurotensyny, jak również sam peptyd, były również wyrażane wyżej w przyśrodkowym obszarze przedwzrokowym (mPOA). Te wzorce ekspresji nie zostały pokazane w grupie kontrolnej dziewiczych samic i są zgodne z innymi badaniami implikującymi zmienność ekspresji genów neurotensyny w regulacji zachowań matek.
Inne wzorce ekspresji neurotensyny związane z przyśrodkowym obszarem przedoptycznym wykazują związek z modulacją nagrody społecznej. Analiza neuronów znakowanych genem neurotensyny ujawniła, że projekcje neuronalne zawierające neurotensynę z mPOA do brzusznego obszaru nakrywkowego (VTA) u myszy były związane z kodowaniem sygnałów zapachowych, jak również z atrakcyjnością społeczną, co dodatkowo implikuje neurotensynę zarówno w hormonach, jak i nagrodach sygnalizacja.
Neurotensyna jest również zaangażowana w procesy uczenia się. Badanie dotyczące rozwoju śpiewu u samców zięb zebry wykazało różnice w ekspresji genów neurotensyny i receptora neurotensyny na różnych etapach rozwoju śpiewu. Wczesny etap przejścia między okresami czuciowymi i sensomotorycznymi charakteryzował się spadkiem ekspresji mRNA zarówno neurotensyny, jak i receptora neurotensyny, co może wskazywać na rolę neurotensyny w inicjowaniu uczenia się sensomotorycznego. Podczas etapu subsong czuciowo-ruchowego ekspresja genu neurotensyny i ekspresja genu receptora neurotensyny 1 (Ntsr1) wykazywały komplementarne wzorce ekspresji w obszarach mózgu związanych z piosenką, co może wskazywać na zmiany w odpowiedziach neuronalnych na neurotensynę w trakcie rozwoju.
Neurotensyna odgrywa również rolę w tkankach obwodowych poza układem nerwowym, głównie w przewodzie pokarmowym, i jest zaangażowana w rozwój raka. Wykazano, że metylacja promotora DNA jest głównym regulatorem ekspresji genów receptora neurotensyny 1 i 2 w komórkach raka jelita grubego. Ponadto wyłączenie genu NTSR1 oraz leczenie antagonistą NTSR1 hamowało proliferację i migrację komórek raka jelita grubego. Mięśniaki gładkokomórkowe lub guzy włókniste w tkance macicy są również związane z wyższą ekspresją neurotensyny i NTSR1.
Zobacz też
Linki zewnętrzne
- Neurotensyna w US National Library of Medicine Medical Subject Headings (MeSH)
- Saplakoglu, Yasemin (2022-09-07). „Dobra pamięć czy zła? Decyduje jedna cząsteczka mózgu” . Magazyn Quanta .




