Słowniczek terminów chemicznych
| Część serii o |
| chemii |
|---|

|
Ten glosariusz terminów chemicznych to lista terminów i definicji związanych z chemią , w tym praw chemicznych, schematów i wzorów, narzędzi laboratoryjnych, wyrobów szklanych i sprzętu. Chemia jest nauką fizyczną zajmującą się składem, strukturą i właściwościami materii , a także zmianami, jakim podlega ona podczas reakcji chemicznych ; zawiera bogate słownictwo i znaczną ilość żargonu.
Uwaga: Wszystkie odniesienia do układu okresowego odnoszą się do stylu IUPAC układu okresowego.
A
- zero absolutne
- Warunek teoretyczny dotyczący układu w najniższej granicy termodynamicznej skali temperatur, czyli w zerowych stopniach kelwinów , przy którym układ nie emituje ani nie pochłania energii (tzn. wszystkie atomy są w spoczynku). Ekstrapolując równanie stanu gazu doskonałego , ustalono międzynarodowo uzgodnioną wartość zera bezwzględnego na -273,15 ° C (-459,67 ° F; 0,00 K).
- absorbancja
- absorpcja
- 1. Fizyczny lub chemiczny proces, w wyniku którego substancja przechodzi w jeden stan zostaje włączona i zatrzymana przez inną substancję w innym stanie. Absorpcja różni się od adsorpcji tym, że pierwsza substancja przenika całą masę drugiej substancji, a nie tylko przylega do powierzchni.
- 2. Proces , w którym materia (zwykle elektrony związane w atomach) pobiera energię promieniowania elektromagnetycznego i przekształca ją w dowolny rodzaj energii wewnętrznej, np. energię cieplną . Ten rodzaj absorpcji jest zasadą, na której opiera się spektrofotometria .
- dokładność
- obfitości
- Jak blisko jest zmierzona wartość do rzeczywistej lub prawdziwej wartości. Porównaj precyzję .
- achiralny
- (cząsteczki ) Posiadający geometryczną symetrię nie do odróżnienia od własnego lustrzanego odbicia; brak chiralności .
- kwas
- Związek, który po rozpuszczeniu w wodzie daje pH mniejsze niż 7,0 lub oddaje jon wodoru.
- bezwodnik kwasowy
- Każdy związek chemiczny powstały w wyniku usunięcia cząsteczek wody z kwasu . Kontrastowy bezwodnik zasadowy .
- stała dysocjacji kwasu ( Ka )
- Ilościowa miara mocy kwasu w roztworze wyrażona jako stała równowagi chemicznej reakcji dysocjacji w kontekście reakcji kwasowo-zasadowych . Często podaje się go jako koloarytm o podstawie 10, p Ka .
- ekstrakcja kwasowo-zasadowa
- Związek, który po rozpuszczeniu w wodzie daje pH poniżej 7,0 lub oddaje jon wodoru.
- aktynowce
- Okresowe serie pierwiastków metalicznych o liczbach atomowych od 89 do 103, od aktynu do lawrenu .
- aktywowany kompleks
- Struktura, która powstaje w wyniku kolizji między cząsteczkami podczas tworzenia nowych wiązań.
- energia aktywacji
- Minimalna energia , która musi być dostępna dla układu chemicznego z potencjalnymi reagentami , aby spowodować określoną reakcję chemiczną .
- serie aktywności
- Zobacz serie reaktywności .
- rzeczywista wydajność
- acykliczne
- Zawierające tylko liniowe struktury atomów (szczególnie w węglowodorach ).
- reakcja addycji
- W chemii organicznej rodzaj reakcji chemicznej, w której dwie lub więcej cząsteczek łączy się, tworząc większą.
- adhezja
- Tendencja różnych cząstek lub powierzchni do przylegania do siebie w wyniku sił międzycząsteczkowych . Spójność kontrastu .
- adsorpcja
- Adhezja chemiczna atomów, jonów lub cząsteczek jednej substancji (gazu , cieczy lub rozpuszczonej ciała stałego ) do powierzchni innej substancji, w wyniku czego warstewka pierwszej substancji jest słabo związana z powierzchnią międzyfazową między dwiema substancjami. Adsorpcja różni się od absorpcji tym, że jest zjawiskiem wyłącznie powierzchniowym, podczas gdy absorpcja obejmuje całe objętości materiałów.
- napowietrzanie
- Mieszanie powietrza w ciecz lub ciało stałe .
- alkohol
- Dowolny związek organiczny składający się z co najmniej jednej grupy hydroksylowej przyłączonej do nasyconego atomu węgla.
- aldehyd
- Grupa funkcyjna i klasa związków organicznych składająca się z grupy karbonylowej przyłączonej do atomu wodoru i dowolnej innej grupy R. Aldehydy mają wzór ogólny R–C(H)=O.
- alifatyczny
- metal alkaliczny
- Dowolny pierwiastek metaliczny należący do grupy 1 układu okresowego pierwiastków : lit (Li), sód (Na), potas (K), rubid (Rb), cez (Cs) i frank (Fr).
- metal ziem alkalicznych
- Dowolny pierwiastek metaliczny należący do grupy 2 układu okresowego pierwiastków : beryl (Be), magnez (Mg), wapń (Ca), stront (Sr), bar (Ba) i rad (Ra).
- alkan
- Dowolny w pełni nasycony węglowodór acykliczny , tj. taki, w którym wszystkie wiązania węgiel-węgiel są wiązaniami pojedynczymi .
- alken
- Każdy nienasycony węglowodór zawierający co najmniej jedno wiązanie podwójne węgiel-węgiel .
- grupa alkilowa
- Podstawnikowa postać alkanu , tj . dowolny alkan pozbawiony atomu wodoru. Termin ten może odnosić się do wielu różnych grup funkcyjnych, np. metylowej lub etylowej .
- alkin
- Każdy nienasycony węglowodór zawierający co najmniej jedno potrójne wiązanie węgiel-węgiel .
- allomer
- Substancja, która różni się składem chemicznym, ale ma taką samą strukturę krystaliczną jak inna substancja.
- alotrop
- Dowolna z wielu różnych form strukturalnych tego samego pierwiastka, jak węgiel , którego allotropy obejmują diamenty , grafit i fuleren .
- stop
- Mieszanina metali lub metalu i innego metalu element , który w połączeniu wykazuje metaliczny charakter wiążący . Typowe przykłady to brąz , mosiądz i cyna .
- amalgamat
- Dowolny stop rtęci z innym metalem .
- amoniakalny
- Opisanie roztworu , w którym rozpuszczalnikiem jest wodny roztwór amoniaku .
- ilość substancji
- Liczba odrębnych cząstek (takich jak cząsteczki , atomy , jony , elektrony lub dowolna inna jednostka w skali atomowej) w danej próbce materii podzielona przez stałą Avogadro . Jednostką SI określającą ilość substancji jest mol (mol).
- amfoteryczny
- (o gatunku chemicznym ) Z tendencją do zachowywania się zarówno jako kwas , jak i zasada , w zależności od ośrodka, w którym znajduje się gatunek; np. kwas siarkowy (H 2 SO 4 ) jest silnym kwasem w wodzie , ale zachowuje się bardziej jak zasada w nadkwasach .
- amfipatyczny
- (cząsteczki ) Złożony zarówno z grup hydrofilowych , jak i hydrofobowych ; np. środki zwilżające i lipidy błonowe.
- amyl
- Powszechna niesystematyczna nazwa grupy pentylowej .
- analit
- Konkretna substancja lub składnik chemiczny będący przedmiotem zainteresowania w analizie chemicznej .
- chemia analityczna
- Dział chemii, który bada i wykorzystuje instrumenty i metody do oddzielania, oznaczania ilościowego i identyfikowania substancji chemicznych, zarówno za pomocą klasycznych technik chemii mokrej , takich jak wytrącanie , ekstrakcja , destylacja i analiza obserwacyjna, jak i nowoczesnych technik instrumentalnych, takich jak chromatografia , spektroskopia i elektrochemia .
- bezwodny
- mający lub niezawierający cząsteczek wody , odnoszący się zwłaszcza do wody hydratacyjnej . Ponieważ obecność wody utrudnia wiele procesów chemicznych, często niezwykle ważne jest stosowanie odczynników i technik bezwodnych. Związki bezwodne mają tendencję do stopniowego wchłaniania wody z atmosfery. Kontrast wodny .
- anion
- Jon o ładunku ujemnym ; tj. atom lub cząsteczka o ujemnym ładunku elektrycznym netto spowodowanym nadmiarem elektronów w porównaniu z protonami .
- anoda
- 1. Elektroda , przez którą konwencjonalny prąd elektryczny (przepływ ładunków dodatnich) wpływa do spolaryzowanego obwodu elektrycznego.
- 2. Drut lub płytka ogniwa elektrochemicznego o nadmiarowym ładunku dodatnim. Ujemnie naładowane aniony zawsze poruszają się w kierunku anody. Kontrastowa katoda .
- woda królewska
- Płyn mieszanina kwasu azotowego (HNO 3 ) i kwasu chlorowodorowego (HCl), optymalnie w stosunku molowym 1:3, nazwana tak przez alchemików historycznych, ponieważ jest w stanie rozpuszczać metale szlachetne , złoto i platynę .
- uwodnienie
- Proces, w którym cząsteczki wody solwatują lub tworzą kompleksy koordynacyjne z jonami .
- wodny
- Roztwór roztwór w którym rozpuszczalnikiem jest woda . W równaniach chemicznych oznacza się ją przez dodanie (aq) do wzoru chemicznego .
- aromatyczność
- Właściwość chemiczna sprzężonych pierścieni atomów, takich jak benzen , która powoduje niezwykle wysoką stabilność. O takich pierścieniach mówi się, że są aromatyczne .
- strzałka pchająca
- aryl
- Dowolna grupa funkcyjna lub podstawnik pochodzący od pierścienia aromatycznego , taki jak fenyl lub naftyl . Symbol Ar jest często używany jako symbol zastępczy dla ogólnej grupy arylowej na diagramach strukturalnych.
- atmoliza
- Rozdzielenie mieszaniny gazów poprzez wykorzystanie ich różnych szybkości dyfuzji , zwykle poprzez umożliwienie dyfuzji gazów przez ścianki porowatej przegrody lub membrany.
- atom
- Pierwiastek chemiczny w swojej najmniejszej postaci, składający się z protonów i neutronów w jądrze oraz elektronów krążących wokół jądra.
- masa Masa atomu , zwykle wyrażana w daltonach i prawie równoważna liczbie masowej pomnożonej przez jeden dalton.
- atomowa
- jednostka masy atomowej
- Zobacz dalton .
- liczba atomowa ( Z )
- Liczba protonów znajdujących się w jądrze atomu danego pierwiastka chemicznego . Jest identyczny z liczbą ładunków jądra i jest używany w układzie okresowym do jednoznacznej identyfikacji każdego pierwiastka chemicznego.
- orbital atomowy
- Dowolny obszar, w którym jeden lub więcej elektronów może znajdować się w pojedynczym atomie (w przeciwieństwie do tego w cząsteczce ).
- promień atomowy
- masa atomowa
- Patrz względna masa atomowa .
- atomowość
- Całkowita liczba atomów obecnych w pojedynczej cząsteczce danej substancji; np. ozon (O 3 ) ma atomowość 3, podczas gdy benzen (C 6 H 6 ) ma atomowość 12.
- temperatura samozapłonu
- Najniższa temperatura, w której dana substancja ulegnie samozapłonowi w normalnej atmosferze bez zewnętrznego źródła zapłonu, takiego jak płomień lub iskra, tj. gdy temperatura otoczenia jest wystarczająco wysoka, aby zapewnić energię aktywacji potrzebną do spalania . Substancje, które ulegają samozapłonowi w naturalnie występującej temperaturze, nazywane są piroforycznymi . Porównaj temperaturę zapłonu .
- Prawo Avogadra
- Stała Avogadra ( N A )
- Stosunek liczby odrębnych cząstek składowych (takich jak cząsteczki , atomy lub jony ) do ilości substancji , określony jako dokładnie 6,022 140 76 × 10 23 mol −1 .
- Liczba Avogadra
- Liczba odrębnych cząstek składowych jednego mola substancji, określona jako dokładnie 6,02214076 × 10 23 . Ta bezwymiarowa liczba różni się od stałej Avogadra w tym, że nie ma jednostki.
- azeotrop
- Mieszanina cieczy , których skład chemiczny nie zmienia się w wyniku destylacji .

Wzór szkieletowy ogólnego aldehydu , gdzie R oznacza zmienną grupę podstawnikową zawierającą węgiel
B
- barometr
- Urządzenie służące do pomiaru ciśnienia atmosferycznego.
- zasada
- Substancja, która przyjmuje proton i ma pH powyżej 7,0. Typowym przykładem jest wodorotlenek sodu (NaOH).
- bezwodnik zasadowy
- Tlenek pierwiastka metalu grupy I lub II.
- zlewka
- Cylindryczne naczynie lub pojemnik z płaskim dnem, najczęściej rodzaj szkła , szeroko stosowane w laboratoriach do różnych celów, takich jak przygotowywanie, przechowywanie, przechowywanie, zbieranie lub pomiar objętościowy chemikaliów, próbek lub roztworów, lub jako komora, w której zachodzi reakcja chemiczna . Zlewki różnią się od kolb tym, że mają raczej proste niż pochyłe boki; większość zlewek ma również mały dzióbek na krawędzi, który ułatwia nalewanie.
- Biochemia
- prawa Beera-Lamberta
- Badanie chemii systemów i organizmów biologicznych.
- Wrzenie
- modelu Bohra
- Zobacz parowanie .
- temperatura wrzenia
- Temperatura , w której substancja zmienia stan skupienia z ciekłego na gazowy (lub parę ). Zależy ona od ciśnienia i jest zwykle określana dla danej substancji w warunkach normalnych .
- podwyższenie temperatury wrzenia Proces, w którym
- temperatura wrzenia substancji zostaje podwyższona przez dodanie innej substancji.
- wiązanie
- Każde trwałe przyciąganie między atomami , jonami lub cząsteczkami co umożliwia tworzenie związków chemicznych . Wiązania powstają w wyniku działania różnorodnych sił elektrochemicznych, których siła może się znacznie różnić; załamują się, gdy siły te zostają pokonane przez inne siły. Rodzaje, siły i ilości wiązań łączących substancje chemiczne decydują o strukturze i właściwościach objętościowych materii .
- Prawo Boyle'a
- Dla danej masy gazu w stałej temperaturze objętość zmienia się odwrotnie proporcjonalnie do ciśnienia.
- Prawo Bragga Kwas
- Brønsteda-Lowry'ego
- Dowolny związek chemiczny, który łatwo przekazuje proton .
- Reakcja kwas-zasada Brønsteda-Lowry'ego
- Zasada Brønsteda-Lowry'ego
- Dowolny związek chemiczny, który łatwo przyjmuje proton .
- Roztwór buforowany
- w kolbie Büchnera
- z ruchami Browna
- Roztwór wodny składający się ze słabego kwasu i sprzężonej z nim zasady lub słabej zasady i sprzężonego z nią kwasu , który jest odporny na zmiany pH po dodaniu mocnych kwasów lub zasad.
- zderzenie
- Zjawisko, w którym jednorodna ciecz podniesiona do temperatury wrzenia zostaje przegrzana i po zarodkowaniu , gwałtownie wrze do fazy gazowej, powodując gwałtowne wyrzucenie cieczy z pojemnika; w skrajnych przypadkach sam pojemnik może pęknąć. Częste mieszanie, używanie odpowiedniego pojemnika i gotowanie frytek może pomóc w zapobieganiu obijaniu.
- biureta
- korkowa
- Naczynia szklane używane do dozowania określonych ilości cieczy , gdy wymagana jest precyzja (np. podczas miareczkowania i reakcji zależnych od zasobów ).
C
- wartość kaloryczna
- Miara ciepła na jednostkę masy wytwarzanego przez całkowite spalanie danej substancji, zwykle wyrażana w megadżulach na kilogram (MJ/kg) lub w kilodżulach na gram (kJ/g).
- kalorymetr
- Dowolne z różnych urządzeń służących do pomiaru właściwości termicznych (tj. ciepła ), takich jak wartości kaloryczne lub ciepło reakcji chemicznych.
- calx
- Tlenek metalu powstały w wyniku ogrzewania rudy w powietrzu.
- karbokation
- karboanionu
- karbonyl
- 1. funkcyjna złożona z węgla związanego podwójnie z atomem tlenu , o wzorze Grupy karbonylowe są wspólne dla wielu klas związków organicznych i są również częścią wielu większych grup funkcyjnych.
- 2. Nieorganiczny lub metaloorganiczny kompleks koordynacyjny z tlenkiem węgla jako ligandem (np. karbonyl metalu ).
- kwas karboksylowy
- Klasa kwasów organicznych i grupa funkcyjna składająca się z grupy karboksylowej przyłączonej do grupy podstawnikowej . Kwasy karboksylowe mają ogólny wzór (również zapisywany jako gdzie może być alkilem , alkenylem , arylem lub dowolny inny podstawnik zawierający węgiel.
- Numer rejestru CAS (CAS RN)
- Unikalny numeryczny identyfikator przypisany przez Chemical Abstracts Service (CAS) do każdej substancji chemicznej opisanej w otwartej literaturze naukowej, w tym ponad 182 milionów związków organicznych i nieorganicznych , minerałów , izotopów , stopów , polimerów i mieszanin , a także tzw. „UVCB” (substancje o nieznanym lub zmiennym składzie, złożone produkty reakcji lub pochodzenia biologicznego). Numery CAS to międzynarodowy standard używany przez naukowców, przemysł i organy regulacyjne.
- katalizator
- Każdy pierwiastek lub związek, który umożliwia zwiększenie szybkości reakcji chemicznej , ale który nie jest zużywany ani niszczony podczas reakcji. Jest uważany zarówno za reagent , jak i za produkt reakcji.
- katoda
- Elektroda , z której konwencjonalny prąd elektryczny (przepływ ładunków dodatnich) opuszcza spolaryzowany obwód elektryczny. Dodatnio naładowane kationy zawsze poruszają się w kierunku katody, chociaż biegunowość katody może być dodatnia lub ujemna, w zależności od rodzaju urządzenia elektrycznego i sposobu jego obsługi. Anoda kontrastowa .
- kation
- Dodatnio naładowany jon .
- potencjał ogniwa
- Siła w ogniwie galwanicznym , która przeciąga elektrony przez środek redukujący do środka utleniającego.
- wirowanie
- Technika laboratoryjna polegająca na zastosowaniu siły odśrodkowej w celu oddzielenia cząstek od roztworu na podstawie ich wielkości, kształtu i gęstości. Większe i/lub gęstsze substancje migrują od osi wirówki , podczas gdy mniejsze i/lub mniej gęste substancje migrują w kierunku osi.
- wirówka
- Urządzenie używane do oddzielania substancji na podstawie rozmiaru, kształtu i gęstości poprzez wirowanie lub obracanie naczyń zawierających substancje wokół centralnej osi z bardzo dużą prędkością.
- liczba ładunków
- reakcji łańcuchowej
- A skwantowana wartość ładunku elektrycznego obliczona jako ładunek elektryczny w kulombach podzielony przez elementarną stałą ładunku, czyli z = q / e . Liczby ładunków dla jonów są oznaczane indeksem górnym (np. Na + oznacza jon sodu z liczbą ładunków dodatnią). Liczby atomowe to liczby ładunków jąder atomowych .
- Prawo Karola
- Kiedy ciśnienie na próbce suchego gazu jest utrzymywane na stałym poziomie, temperatura Kelvina jest wprost proporcjonalna do jego objętości.
- środek chelatujący
- chelatowanie
- Rodzaj wiązania polegający na tworzeniu dwóch oddzielnych współrzędnych wiązań kowalencyjnych między polikleszczowym ligandem a pojedynczym centralnym jonem metalu . Ligand jest zwykle związkiem organicznym zwanym środkiem chelatującym lub środkiem chelatującym .
- skład chemiczny
- Tożsamość i względna liczba pierwiastki tworzące związek chemiczny , który często można wyrazić za pomocą wzoru chemicznego .
- rozkład chemiczny
- Rozpad pojedynczej cząstki lub jednostki (takiej jak cząsteczka lub reaktywny produkt pośredni ) na dwa lub więcej fragmentów lub reakcja chemiczna , w której z jednego reagenta powstają dwa lub więcej produktów . Kontrast syntezy chemicznej .
- wzór chemiczny
- Dowolny z różnych sposobów zwięzłego wyświetlania informacji o skład chemiczny związku lub cząsteczki za pomocą liter, cyfr i/lub symboli typograficznych . Wzory chemiczne, takie jak wzory empiryczne i cząsteczkowe , mogą wskazywać jedynie tożsamość i proporcje liczbowe atomów w związku, a zatem mają bardziej ograniczoną moc opisową niż nazwy chemiczne i wzory strukturalne .
- prawo chemiczne
- Prawo natury odnoszące się do chemii , takie jak prawo zachowania masy .
- nomenklatura chemiczna
- proces chemiczny
- 1. Każda metoda lub środek zmiany jednego lub więcej chemikaliów lub związków chemicznych w jakikolwiek sposób, w sposób naturalny lub sztuczny, spontaniczny lub w wyniku działania sił zewnętrznych.
- 2. W inżynierii chemicznej dowolna metoda stosowana na skalę przemysłową (zwłaszcza w produkcji ) w celu zmiany składu jednej lub więcej substancji chemicznych lub materiałów.
- reakcja chemiczna
- Zmiana jednej lub więcej substancji w jedną lub więcej różnych substancji.
- gatunki chemiczne
- Substancja chemiczna lub zespół substancji składający się z chemicznie identycznych jednostek molekularnych , które mogą badać ten sam zestaw poziomów energii cząsteczkowej w charakterystycznej lub określonej skali czasowej.
- substancja chemiczna
- Forma materii o stałym składzie chemicznym i charakterystycznych właściwościach , której nie można rozdzielić na prostsze składniki metodami czysto fizycznymi (tj. bez zerwania wiązań chemicznych ). Często nazywana jest czystą substancją , aby odróżnić ją od mieszaniny .
- synteza chemiczna
- Sztuczne przeprowadzenie jednej lub więcej reakcji chemicznych w celu uzyskania jednego lub więcej produktów . W nowoczesnych warunkach laboratoryjnych określone syntezy chemiczne są zarówno niezawodne, jak i powtarzalne.
- chemia
- Dyscyplina naukowa zajmująca się badaniem substancji chemicznych , związków i cząsteczek złożonych z atomów różnych pierwiastków chemicznych , a także ich składem , strukturą, właściwościami, zachowaniem oraz zmianami, którym ulegają podczas reakcji z innymi substancjami.
- chiralność
- Właściwość asymetrii , w której cząsteczka lub jon jest odróżnialny od swojego lustrzanego odbicia w taki sposób, że nie można go nałożyć na niego przez żadną kombinację obrotów geometrycznych, translacji lub pewnych zmian konformacyjnych . O takiej cząsteczce lub jonie mówi się, że jest chiralna i występuje w dwóch formach, zwanych enancjomerami , które są wzajemnymi stereoizomerami ; formy te są rozróżniane jako „praworęczne” lub „leworęczne” ze względu na ich absolutną konfigurację lub inne kryterium. Kilka różnych typów asymetrii może powodować chiralność, najczęściej gdy cząsteczki posiadają elementy stereogeniczne, takie jak jedno lub więcej stereocentrów ( chiralność centralna ), oś stereogeniczna ( chiralność osiowa ) lub płaszczyzna stereogeniczna ( chiralność planarna ); dodatkowo wrodzona krzywizna cząsteczki może powodować, że ma ona wrodzoną chiralność .
- chromatografia
- izomeria cis-trans
- układ zamknięty
- spójność
- klastrów
- Tendencja podobnych cząstek lub powierzchni do przylegania do siebie w wyniku sił międzycząsteczkowych . Adhezja kontrastowa .
- właściwość koligatywna Właściwość
- roztworu , która zależy od stosunku liczby cząstek substancji rozpuszczonej do liczby cząstek rozpuszczalnika w roztworze, a nie od charakteru obecnych związków chemicznych . Przykłady obejmują ciśnienie osmotyczne , obniżenie temperatury zamarzania i podwyższenie temperatury wrzenia .
- koloid
- Mieszanina równomiernie rozproszonych substancji, takich jak wiele rodzajów mleka .
- wzorzec barwny
- Ciekły roztwór o znanym składzie chemicznym i stężeniu, a zatem o znanej i znormalizowanej barwie, używany jako odniesienie w analizie optycznej próbek o nieznanej mocy.
- test koloru
- Ilościowa analiza substancji polegająca na porównaniu intensywności koloru powstającego, gdy substancja jest wystawiona na działanie a odczynnik o standardowym kolorze wytwarzany podobnie w roztworze o znanym stężeniu.
- kolorymetr
- Każdy przyrząd używany do pomiaru barwy oparty na porównaniu optycznym z barwami wzorcowymi , w szczególności przyrząd stosowany w kolorymetrii , który mierzy absorbancję światła o określonej długości fali przez dany roztwór w celu określenia stężenia znanej substancji rozpuszczonej w roztworze, poprzez zastosowanie zasada, że stężenie substancji rozpuszczonej jest wprost proporcjonalne do absorbancji .
- spalanie
- Reakcja egzotermiczna pomiędzy utleniaczami oraz paliwo, które wytwarza duże ilości ciepła i często światła.
- Kompleks
- Commission on Isotopic Abundances and Atomic Weights (CIAAW)
- Jednostka molekularna utworzona przez luźne połączenie dwóch lub więcej składowych jednostek molekularnych ( jonowych lub nienaładowanych) lub odpowiednich związków chemicznych . Wiązanie między składnikami jest zwykle słabsze niż w przypadku wiązania kowalencyjnego . Zobacz także kompleks koordynacyjny .
- związek
- Substancja , która składa się z dwóch lub więcej chemicznie połączonych pierwiastków .
- Reguła Comptona
- Empiryczne prawo chemii fizycznej , które stwierdza, że ciepło topnienia danego pierwiastka pomnożone przez jego masę atomową , a następnie podzielone przez jego temperaturę topnienia w kelwinach , jest zawsze równe w przybliżeniu 2.
- stężenie
- Ilość lub obfitość składnika danej substancji mieszanka na jednostkę ilości mieszanki; np. ilość rozpuszczonej substancji rozpuszczonej na jednostkę objętości roztworu, miara znana jako molarność . W chemii szeroko stosuje się kilka różnych definicji stężenia, w tym stężenie masowe , stężenie objętościowe i stężenie molowe .
- kondensacja
- Przemiana fazowa substancji z gazu w ciecz .
- kondosytność
- Porównawczy pomiar przewodności elektrycznej roztworu określony jako stężenie molowe chlorku sodu (NaCl), który ma taką samą właściwą przewodność elektryczną jak badany roztwór. Zwykle wyraża się ją w jednostkach moli na litr (lub na inną jednostkę objętości).
- przewodnik
- Każdy przedmiot lub materiał, który umożliwia przepływ prądu elektrycznego w jednym lub kilku kierunkach. Izolator kontrastowy .
- konformacja
- Przestrzenny układ atomów umożliwiający rozróżnienie między stereoizomerami , które mogą ulegać wzajemnej konwersji przez obrót wokół formalnie pojedynczych wiązań .
- kwas sprzężony
- sprzężony Cząsteczka zawierająca wiązania podwójne lub potrójne oddzielone jednym wiązaniem pojedynczym ; np. związek buta-1,3-dien o budowie chemicznej H 2 C=CH-CH=CH 2 ma sprzężone wiązania podwójne. W takich cząsteczkach następuje pewna delokalizacja elektronów na orbitali pi między atomami węgla połączonymi pojedynczym wiązaniem .
- system
- zasad sprzężonych
- izomer konstytucyjny
- Patrz izomer strukturalny . współrzędna
- krzywej chłodzenia współrzędna
- chemiczna
- wiązanie kowalencyjne
- Zobacz wiązanie dipolarne .
- kompleks koordynacyjny
- Związek chemiczny składający się z centralnego atomu lub jonu , zwykle metalicznego i znanego jako centrum koordynacyjne , związanego z otaczającym układem innych grup atomów, np. cząsteczek lub jonów, które są znane jako ligandy lub czynniki kompleksujące . Wiele związków zawierających metale, zwłaszcza te z metali przejściowych , to kompleksy koordynacyjne. Zobacz także złożony .
- korozja
- Nieodwracalna międzyfazowa reakcja chemiczna materiału, zwłaszcza metalu , z otoczeniem, w wyniku której następuje zużycie materiału lub rozpuszczenie się w materiale zewnętrznego składnika środowiska.
- kulomb
- Jednostka ładunku elektrycznego w układzie SI (symbol: C), zdefiniowana jako ładunek przenoszony przez stałą prąd jednego ampera w ciągu jednej sekundy .
- wiązanie kowalencyjne
- Wiązanie polegające na współdzieleniu par elektronów między atomami . Stabilna równowaga sił przyciągania i odpychania, która występuje między atomami, gdy dzielą one elektrony, jest znana jako wiązanie kowalencyjne .
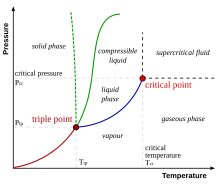
- punkt krytyczny Punkt
- końcowy krzywej równowagi fazowej lub krzywej ciśnienie - temperatura , w którym warunki są takie, że granice faz zanikają i różne fazy substancji, takie jak ciecz i para , mogą współistnieć. Punkt krytyczny jest określony przez przecięcie temperatury krytycznej Tc i ciśnienia krytycznego pc ; powyżej tej temperatury i ciśnienia zanika wszelkie rozróżnienie między fazami i substancja staje się a płyn nadkrytyczny .
- tygiel
- Ceramiczne lub metalowe naczynie lub inne naczynie, w którym substancje mogą być topione lub w inny sposób poddawane działaniu bardzo wysokich temperatur.
- kryształ
- Ciało stałe , którego cząstki składowe (takie jak atomy, jony lub cząsteczki) są ułożone w uporządkowaną, okresową strukturę mikroskopową, tworząc siatkę rozciągającą się we wszystkich kierunkach. Takie materiały są często opisywane jako krystaliczne .
- temperatura krystalizacji
- Patrz temperatura zamarzania .
- krystalografia
- Dziedzina chemii zajmująca się określaniem rozmieszczenia atomów w krystalicznych ciałach stałych.
- kuweta
- Rodzaj szkła używanego w eksperymentach spektroskopowych . Zwykle jest wykonany z tworzywa sztucznego, szkła lub kwarcu i powinien być tak czysty i przejrzysty, jak to tylko możliwe.

Wzór szkieletowy ogólnego kwasu karboksylowego , w którym R oznacza zmienną grupę podstawników zawierających węgiel

Schematy strukturalne dwóch chiralnych cząsteczek, nienakładających się enancjomerów w lustrzanym odbiciu ( S )-alanina (po lewej) i ( R )-alanina (po prawej). Chociaż mają identyczne wzory strukturalne i te same właściwości fizyczne, są jednak różnymi substancjami chemicznymi i inaczej reagują z innymi związkami chiralnymi.

Przykład szybkiego spalania na dużą skalę

Dwuatomowa cząsteczka wodoru, H
2 (po prawej), jest utworzona przez wiązanie kowalencyjne , gdy dwa pojedyncze atomy wodoru dzielą ze sobą dwa elektrony.
2 (po prawej), jest utworzona przez wiązanie kowalencyjne , gdy dwa pojedyncze atomy wodoru dzielą ze sobą dwa elektrony.
D
- blok d
- daltona (Da)
- Jednostka masy zdefiniowana jako 1 ⁄ 12 masy wolnego, niewzbudzonego atomu węgla-12 w spoczynku. Jest w przybliżeniu równa masie jednego nukleonu . Czasami jest utożsamiany z technicznie odrębną i przestarzałą jednostką masy atomowej i skrótem amu .
- Prawo ciśnień cząstkowych Daltona
- Prawo empiryczne, które stwierdza, że w mieszaninie niereagujących gazów całkowite ciśnienie wywierane przez wszystkie połączone gazy jest równe sumie ciśnień cząstkowych wywieranych przez każdy gaz z osobna.
- wiązanie celownika
- Zobacz wiązanie dipolarne .
- debye (D)
- Jednostka miary elektrycznego momentu dipolowego spoza układu SI , zdefiniowana jako 10-18 statkulombo -centymetrów. Zobacz także elektryczny moment dipolowy .
- dejonizacja
- Usuwanie jonów z roztworu dowolną metodą. W przypadku wody zazwyczaj odnosi się to do jonów mineralnych, takich jak sód, żelazo i wapń.
- rozpływanie się
- Powinowactwo substancji do wody , często określane jako jej skłonność do wchłaniania wilgoci z atmosfery w celu tworzenia roztworów wodnych . Substancjami silnie rozpływającymi się są sole , takie jak chlorek wapnia i węglan potasu .
- zdelokalizowany elektron
- Każdy elektron w cząsteczce, jonie lub stałym metalu , który nie jest związany z pojedynczym atomem lub wiązaniem kowalencyjnym . Termin ten może odnosić się do elektronów biorących udział w rezonansie układy sprzężone lub związki aromatyczne ; uwolnić elektrony ułatwiające przewodnictwo elektryczne ; lub do elektronów w zdelokalizowanych orbitali molekularnych obejmujących kilka sąsiednich atomów.
- gęstość
- Intensywna właściwość substancji zdefiniowana jako masa na jednostkę objętości i wyrażona równaniem d = m / V .
- denticity
- Liczba grup donorowych w pojedynczym ligandzie które wiążą się z centralnym atomem w kompleksie koordynacyjnym .
- zależne zmienne
- osadzanie
- Osiadanie cząstek w roztworze lub mieszaninie.
- osuszacz
- Substancja higroskopijna stosowana do wywoływania lub podtrzymywania stanu wysuszenia lub wysuszenia (tj. braku wilgoci) w jej pobliżu poprzez pochłanianie cząsteczek wody z innych substancji. Osuszacze występują w wielu różnych postaciach i działają na wielu różnych zasadach, od prostej absorpcji po chemiczne wiązanie cząsteczek wody.
- Kolba Dewara
- Patrz kolba próżniowa .
- dwuatomowy
- Złożony z dwóch atomów tego samego lub różnych pierwiastków. Kontrast jednoatomowy i wieloatomowy .
- cząsteczka dwuatomowa
- Dowolna cząsteczka złożona tylko z dwóch atomów , takich samych lub różnych pierwiastków .
- dyfuzja
- Ruch netto atomów lub cząsteczek z regionu o wyższym stężeniu do regionu o niższym stężeniu. Dyfuzja jest napędzana gradientem potencjału chemicznego dyfuzyjnych gatunków i zależy od losowego spaceru cząstek; stąd powoduje mieszanie lub transport masy bez wymaganego ukierunkowanego ruchu masowego.
- dylatant
- Substancja posiadająca zdolność zwiększania w objętość , gdy zmienia się jej kształt.
- rozcieńczony
- dimer
- Oligomer składający się z dwóch monomerów połączonych wiązaniami chemicznymi, które mogą być zmiennie silne lub słabe , kowalencyjne lub międzycząsteczkowe . Homodimer z dwóch identycznych cząsteczek; heterodimer składa się z dwóch różnych cząsteczek .
- wiązanie dipolarne
- Rodzaj wiązania kowalencyjnego utworzonego przez koordynację dwóch lub więcej elektrycznie obojętnych ugrupowań , których połączenie daje cząsteczkę z oddzielnymi ładunkami lub kompleks koordynacyjny , w którym dwa elektrony pochodzące z tego samego atomu są wspólne dla atomu donora i akceptora atom, tworząc wewnętrzny dwucentrowy cząsteczkowy moment dipolowy .
- dipol
- Elektryczna lub magnetyczna separacja ładunku elektrycznego na parę ładunków o równej wielkości, ale przeciwnych znakach, jeden naładowany dodatnio, a drugi naładowany ujemnie, oddzielonych zazwyczaj niewielką odległością.
- moment dipolowy
- Zobacz elektryczny moment dipolowy , magnetyczny moment dipolowy , molekularny moment dipolowy , moment dipolowy wiązania , elektronowy elektryczny moment dipolowy , elektronowy magnetyczny moment dipolowy i jądrowy moment magnetyczny .
- dyspersja
- diastereomerów
- Układ, w którym cząstki jednego materiału są rozmieszczone w ciągłej fazie innego materiału; dwie fazy mogą znajdować się w tym samym lub w różnych stanach skupienia . Dyspersje cząstek wystarczająco dużych do sedymentacji nazywane są zawiesinami , podczas gdy mniejsze cząsteczki nazywane są koloidami lub roztworami .
- dysocjacja
- Każdy proces, w wyniku którego cząsteczka wieloatomowa lub jednostka molekularna (np. związek jonowy lub kompleks koordynacyjny ) lub agregat jednostek molekularnych, rozdziela się lub dzieli na dwie lub więcej cząsteczek, atomów, jonów, rodników lub innych składników, zwykle w sposób odwracalny . Przykłady obejmują jednocząsteczkową heterolizę i homolizę , rozpuszczanie soli i dysocjację kwasów . Skojarzenie kontrastowe .
- rozpuszczenie
- Oddziaływanie rozpuszczalnika z cząsteczkami lub jonami substancji rozpuszczonej , obejmujące tworzenie wiązań, wiązania wodorowe i siły van der Waalsa .
- destylacja
- Proces rozdzielania substancji składowych ciekłej mieszaniny poprzez wykorzystanie różnic we względnej lotności składników mieszaniny poprzez selektywne gotowanie i następnie skraplanie . Aparatura używana do destylacji substancji nazywana jest destylatorem , a ponownie skondensowana substancja uzyskana w procesie nazywana jest destylatem .
- wiązanie Wiązanie polegające na kowalencyjnym współdzieleniu dwóch pary elektronów .
- podwójne
- podwójny rozkład
- podwójne wypieranie
- sól podwójna
- 1. Sól złożona z więcej niż jednego różnych kationów lub anionów , lub która w wyniku hydrolizy tworzy dwa różne kationy i aniony.
- 2. Sól będąca molekularną kombinacją dwóch innych soli.
- kroplenia
- reakcji podwójnej wymiany
- temperatura Temperatura , w której smar przechodzi ze stanu półstałego w płynny stan w znormalizowanych warunkach, tj. górna granica, w której smar zachowuje swoją strukturę, ale niekoniecznie maksymalna temperatura, w której można go stosować.
- sucha komora
- Komora lub pojemnik, w których wnętrzu utrzymuje się bardzo niską wilgotność, często wypełniając ją argonem lub powietrzem pozbawionym dwutlenku węgla, w celu zapewnienia obojętnej atmosfery, w której manipulowanie bardzo reaktywnymi chemikaliami lub procedury wrażliwe na wilgoć mogą być przeprowadzić w laboratorium.
- środek osuszający
- Patrz środek osuszający .
- plastyczność
- Miara zdolności materiału do znacznego odkształcenia plastycznego przed rozerwaniem, zwykle wyrażana jako procentowe wydłużenie lub procentowe zmniejszenie powierzchni w próbie rozciągania i powszechnie określana jako zdolność materiału do rozciągania w drut.
- mieszanina Mieszanina dwóch lub więcej substancji, która ma najwyższą temperaturę topnienia spośród wszystkich możliwych mieszanin tych substancji. Kontrastowa mieszanina eutektyczna .
- dystektyczna

Jon sodu (Na + ) po rozpuszczeniu w roztworze wodnym tworzy kompleks solwatacyjny z cząsteczkami wody .
mi
- metal ziem alkalicznych
- Zobacz metal ziem alkalicznych .
- efektywna średnica cząsteczkowa
- Fizyczny zasięg chmury elektronowej otaczającej cząsteczkę określonego gazu, obliczony na kilka sposobów i zwykle wyrażany w nanometrach lub angstremach .
- musowanie
- Ucieczka gazu z roztworu wodnego bez zastosowania ciepła i wynikające z tego bulgotanie, pienienie lub musowanie; np. uwalnianie dwutlenku węgla z wody gazowanej.
- ładunek elektryczny
- Mierzona właściwość ( kulomby ) określająca oddziaływanie elektromagnetyczne .
- elektryczny moment dipolowy
- Miara separacji dodatnich i ujemnych ładunków elektrycznych w systemie elektrycznym, tj. miara ogólnej biegunowości elektrycznej systemu . Jednostką SI do pomiaru elektrycznego momentu dipolowego jest kulombometr (C⋅m), ale debye (D), jednostka spoza układu SI, jest również szeroko stosowana w chemii i fizyce atomowej.
- elektryd
- An związek jonowy , w którym anionem jest elektron .
- ogniwo elektrochemiczne
- Urządzenie zdolne do generowania energii elektrycznej w wyniku reakcji chemicznych, w którym to przypadku jest znane jako ogniwo galwaniczne lub galwaniczne, lub do wykorzystywania energii elektrycznej do wywoływania reakcji chemicznych, w którym to przypadku jest znane jako ogniwo elektrolityczne. Na przykład bateria zawiera jedno lub więcej ogniw galwanicznych, z których każde składa się z dwóch elektrod ułożonych w taki sposób, że reakcja utleniania-redukcji wytwarza siłę elektromotoryczną .
- elektrochemia
- Dziedzina chemii fizycznej zajmująca się związkiem między różnicą potencjałów elektrycznych a identyfikowalną przemianą chemiczną, rozumianą jako reakcje chemiczne towarzyszące przepływowi prądu elektrycznego lub różnica potencjałów wynikająca z określonej reakcji chemicznej.
- elektrolit
- Roztwór , który przewodzi pewną ilość prądu elektrycznego i można go kategorycznie podzielić na słabe i mocne elektrolity .
- promieniowanie elektromagnetyczne
- Rodzaj fali, która może przechodzić zarówno przez próżnię, jak i przez materiał, i jest klasyfikowana jako fala samorozprzestrzeniająca się.
- widmo elektromagnetyczne
- elektromagnetyzm
- Pola z ładunkiem elektrycznym i właściwościami elektrycznymi, które zmieniają sposób poruszania się i interakcji cząstek.
- siła elektromotoryczna (emf)
- elektron
- Typ cząstki subatomowej o ujemnym ładunku wypadkowym.
- konfiguracja elektronowa
- Rozmieszczenie elektronów w atomie lub cząsteczce w atomie lub orbitale molekularne . Rozbudowany system notacji służy do zwięzłego i unikalnego wyświetlania informacji o konfiguracji elektronowej każdego rodzaju atomu. Znajomość specyficznych układów elektronów w różnych atomach jest przydatna do zrozumienia wiązań chemicznych i organizacji układu okresowego pierwiastków .
- niedobór elektronów elektryczny
- moment dipolowy elektronu ( de )
- Wewnętrzna właściwość elektronu tak, że jego energia potencjalna jest liniowo związana z siłą jego pola elektrycznego; miara rozkładu ujemnego ładunku elektronu w wytwarzanym przez niego polu elektrycznym. Zobacz także elektryczny moment dipolowy .
- magnetyczny moment dipolowy elektronu
- Moment magnetyczny elektronu , spowodowany wewnętrznymi właściwościami jego spinu i ładunku elektrycznego , wynosi w przybliżeniu −9,284764 × 10–24 dżuli na teslę .
- para elektronów
- Dwa elektrony , które zajmują ten sam orbital cząsteczkowy , ale mają przeciwne spiny . Pary elektronowe tworzą wiązania chemiczne lub występują jako samotne pary elektronów walencyjnych ; możliwe jest również, aby elektrony występowały pojedynczo jako elektrony niesparowane .
- powłoka Orbital wokół jądra atomu zawierający stałą liczbę elektronów ( zwykle dwa lub osiem).
- elektronowa
- elektroujemność ( χ )
- Właściwość chemiczna opisująca tendencję atomu do przyciągania wspólnej pary elektronów ( lub gęstości elektronowej ) do siebie. Na elektroujemność atomu wpływa zarówno jego ładunek jądrowy (który jest proporcjonalny do liczby protonów w jego jądrze ), jak i liczba i położenie elektronów obecnych w jego powłokach atomowych (co wpływa na odległość jądra od elektronów walencyjnych ). Im wyższa elektroujemność atomu lub podstawnika , tym bardziej przyciąga on elektrony do siebie. Jak się zwykle oblicza, elektroujemność nie jest właściwością samego atomu, ale raczej atomu w cząsteczce ; dlatego zmienia się w zależności od środowiska chemicznego pierwiastka, chociaż ogólnie uważa się, że jest to właściwość zbywalna .
- elektrofil
- Każdy atom lub cząsteczka, która może przyjąć parę elektronów . Większość elektrofilów ma ładunek dodatni netto , zawiera atom niosący częściowy ładunek dodatni lub zawiera atom neutralny, który nie ma pełnego oktetu elektronów, a zatem przyciągają bogate w elektrony regiony innych gatunków; elektrofil z wolnymi orbitalami może przyjąć parę elektronów podarowaną przez nukleofila , tworząc wiązanie chemiczne między dwoma gatunkami. Ponieważ akceptują elektrony, elektrofile są z definicji kwasami Lewisa .
- pierwiastek
- elektrosyntezy
- Gatunek atomów o tej samej liczbie protonów w jądrach atomowych , a zatem o tej samej liczbie atomowej . Pierwiastki chemiczne stanowią całą zwykłą materię we wszechświecie; Zidentyfikowano 118 pierwiastków, które są uporządkowane według ich różnych właściwości chemicznych w układzie okresowym pierwiastków .
- reakcja elementarna
- Jakakolwiek reakcja chemiczna , w której jeden lub więcej związków chemicznych reaguje bezpośrednio, tworząc produkty w jednym etapie reakcji iw jednym stanie przejściowym , tj. bez żadnych produktów pośrednich . Porównaj reakcję stopniową .
- elucja
- Proces ekstrakcji jednego materiału z drugiego poprzez przemywanie rozpuszczalnikiem . Elucja polega na przepuszczaniu roztworu zawierającego analit przez adsorbent matrycy przeznaczonej do selektywnego wiązania cząsteczek analitu, a następnie przemywania kompleksu adsorbent/analit rozpuszczalnikiem, zwanym eluentem . Cząsteczki rozpuszczalnika wypierają analit, wiążąc się z adsorbentem w jego miejsce, umożliwiając wyprowadzenie analitu, obecnie będącego częścią eluatu , z kompleksu do kolektora w celu analizy.
- wzór empiryczny
- Najprostszy całkowity stosunek liczby atomów każdego pierwiastka obecnego w związku chemicznym .
- emulsja
- Rodzaj koloidu w którym małe cząstki jednej cieczy są rozproszone w innej cieczy; np. dyspersja wody w oleju lub oleju w wodzie. Emulsje są często stabilizowane przez dodanie substancji zwanej emulgatorem , która ma w swoich cząsteczkach zarówno część liofilową, jak i liofobową.
- enancjomer
- enancjomer enancjomer
- endotermiczna
- energia procesowa
- Zdolność systemu do wykonania pracy .
- w pełni
- Zobacz ilość substancji .
- entalpia
- Miara całkowitej energii wewnętrznej układu termodynamicznego, zwykle symbolizowanego przez H .
- entalpia syntezy jądrowej
- entropia
- Ilość energii niedostępnej do pracy w zamkniętym układzie termodynamicznym, zwykle symbolizowana przez S .
- enzym
- chemii środowiska
- Biologiczny katalizator białkowy przyspieszający reakcję chemiczną.
- epimer
- Probówka Eppendorfa
- Uogólniona nazwa będąca znakiem towarowym odnosząca się do probówki do mikrowirówki .
- równanie stanu
- równomolowego
- Posiadanie równej liczby moli lub roztworu o równym stężeniu molowym .
- równowaga
- Stan systemu, w którym wszystkie konkurencyjne wpływy są zrównoważone. Równowaga chemiczna to stan, w którym stężenia reagentów i produktów w układzie reagującym przestały się zmieniać w czasie.
- Kolba Erlenmeyera
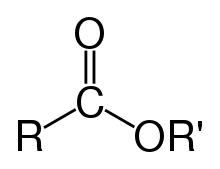
- ester
- Klasa związków organicznych i nieorganicznych pochodzących z reakcji an kwas z alkoholem , w którym co najmniej jedna grupa hydroksylowa (–OH) jest zastąpiona grupą alkoksylową (–O–). Estry mają wzór ogólny RCO2R ′ , gdzie R i R' oznaczają dowolną grupę alkilową lub arylową .
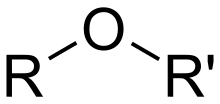
- eter
- Klasa związków organicznych i grupa funkcyjna zawierająca atom tlenu połączony z dwiema grupami alkilowymi lub arylowymi , które mogą być takie same lub różne. Etery mają ogólny wzór R–O–R′, gdzie R i R′ oznaczają grupy alkilowe lub arylowe.
- mieszanina eutektyczna
- Stały roztwór składający się z dwóch lub więcej substancji, które łącznie mają najniższą temperaturę topnienia ze wszystkich możliwych mieszanin tych składników.
- rozległa właściwość
- procesu egzotermicznego
- Wielkość fizyczna , której wartość jest proporcjonalna do wielkości układu, który opisuje, lub do ilości materii w układzie. Przykłady obejmują masę , objętość , entalpię i entropię . Kontrastowa właściwość .
- ekstrakcja
- 1. Proces separacji, w którym składnik jest oddzielany od jego mieszaniny przez selektywną rozpuszczalność . Zobacz także partycja .
- 2. Oddzielenie analitu składowego od matrycy .
- właściwość zewnętrzna
Wzór szkieletowy ogólnego estru , w którym R i R ′ oznaczają zmienne grupy podstawników zawierające węgiel
Wzór szkieletowy ogólnego eteru , w którym R i R ′ oznaczają zmienne grupy podstawników zawierające węgiel
F
- blok f
- Stała Faradaya ( F )
- Jednostka ładunku elektrycznego szeroko stosowana w elektrochemii , równa ujemnemu ładunkowi molowemu (ładunek elektryczny przypadający na mol) elektronów . Jest równa około 96 500 kulombów na mol ( F = 96 485 ,332 12 ... C/mol ).
- Prawa elektrolizy Faradaya
- Zestaw dwóch praw dotyczących elektrolizy które utrzymują, że: a) masa substancji zmienionej na elektrodzie podczas elektrolizy jest wprost proporcjonalna do ilości energii elektrycznej przeniesionej na tej elektrodzie; oraz b) masa materiału elementarnego zmieniona na elektrodzie jest wprost proporcjonalna do ciężaru równoważnika pierwiastka.
- Prawa Ficka dotyczące
- filtracji dyfuzyjnej
- Każda operacja fizyczna, biologiczna lub chemiczna, która oddziela duże cząstki (często ciała stałe ) od mniejszych cząstek (często płynu) poprzez przepuszczanie mieszaniny przez złożoną strukturę sieciową, przez którą mogą przechodzić tylko cząsteczki o wystarczająco małych rozmiarach, zwaną filtrem . Płyn i małe cząsteczki, które z powodzeniem przechodzą przez filtr, nazywane są filtratem .
- punkt zapłonu
- Najniższa temperatura , w której opary znajdujące się nad substancją lotną będą się palić przez co najmniej pięć sekund po zapaleniu przez otwarty płomień o standardowych wymiarach. Punktu zapłonu nie należy mylić z punktem zapłonu , nieco niższa temperatura, w której substancja zapala się na krótko, ale w której pary nie są wytwarzane z szybkością wystarczającą do podtrzymania spalania.
- temperatura zapłonu
- reakcji pierwszego rzędu
- Najniższa temperatura , w której opary znajdujące się nad materiałem lotnym zapalą się pod wpływem źródła zapłonu. W temperaturze zapłonu zastosowanie otwartego płomienia powoduje jedynie chwilowy „błysk”, a nie długotrwałe spalanie, dla którego temperatura otoczenia jest wciąż zbyt niska. Punktu zapłonu nie należy mylić z punktem zapłonu , która występuje w nieco wyższej temperaturze, ani z temperaturą zapłonu , która jest jeszcze wyższa.
- kolba
- Naczynie lub pojemnik, najczęściej rodzaj szkła , szeroko stosowane w laboratoriach do różnych celów, takich jak przygotowywanie, przechowywanie, przechowywanie, zbieranie lub pomiar objętościowy chemikaliów, próbek lub roztworów, lub jako komora, w której zachodzi reakcja chemiczna . Kolby mają różne kształty i rozmiary, ale zwykle charakteryzują się szerszym „korpusem” naczynia i jedną lub kilkoma węższymi sekcjami rurowymi z otworem u góry.
- flokulacja
- Proces, w którym rozproszone cząstki w koloidzie wydostają się z zawiesiny i łączą się w większe grudki znane jako kłaczki lub płatki , samoistnie lub w wyniku dodania środka klarującego . Termin ten jest często używany w odniesieniu do odwracalnej agregacji, w której siły utrzymujące cząstki razem są słabe, a koloid można ponownie rozproszyć przez mieszanie.
- ładunek formalny (FC)
- Ładunek elektryczny przypisany atomowi w cząsteczce , zakładając, że wszystkie elektrony we wszystkich wiązaniach są równo dzielone między atomy, niezależnie od względnej elektroujemności każdego atomu . Formalny ładunek dowolnego atomu, który jest częścią cząsteczki, można obliczyć za pomocą równania , gdzie to liczba elektronów walencyjnych neutralnego atomu w jego stanie podstawowym; to liczba elektronów walencyjnych atomu, które nie biorą udziału w wiązaniach w cząsteczce; a to liczba elektronów wspólnych w wiązaniach z innymi atomami w
- formuła wagowa (FW)
- Synonim masy molowej i masy cząsteczkowej , często używany w odniesieniu do związków niecząsteczkowych, takich jak sole jonowe .
- frakcjonowana
- destylacja frakcyjna
- Frakcjonowanie mieszaniny cieczy na jej części składowe , lub frakcje w procesie destylacji , zwykle przy użyciu długiej pionowej kolumny przymocowanej do naczynia destylacyjnego i wypełnionej szklanymi kulkami. Mieszaninę ogrzewa się do temperatury, w której jeden lub więcej składników odparuje ; para unosi się w górę kolumny, aż skrapla się i spływa z powrotem do naczynia, tworząc gradient temperatury i lotności oraz umożliwiając odciąganie różnych frakcji w różnych punktach wzdłuż kolumny. Powszechne w chemii przemysłowej , technika jest wystarczająco czuła, aby oddzielić związki, których temperatury wrzenia różnią się od siebie o mniej niż 25 ° C (45 ° F) przy standardowym ciśnieniu.
- frakcjonowanie
- Proces rozdzielania, w którym określona ilość mieszaniny jest dzielona podczas przemiany fazowej na szereg mniejszych ilości, zwanych frakcjami , których skład chemiczny zmienia się zgodnie z gradientem. Frakcjonowanie wykorzystuje subtelne różnice w pewnych specyficznych właściwościach (np. masa , temperatura wrzenia , rozpuszczalność itp.) między składnikami mieszaniny , umożliwiając wyizolowanie więcej niż dwóch składników mieszaniny w tym samym czasie. Istnieje wiele odmian frakcjonowania stosowanych w wielu gałęziach nauki i techniki.
- wolny rodnik
- Zobacz rodnik .
- zamrażanie
- Przemiana fazowa substancji ze stanu ciekłego w stan stały .
- punkt zamarzania
- Temperatura , w której substancja zmienia stan skupienia z ciekłego na stały . Ponieważ zamarzanie jest odwrotnością topnienia , temperatura zamarzania substancji jest identyczna z jej temperaturą topnienia , ale zgodnie z konwencją tylko temperatura topnienia jest określana jako charakterystyczna właściwość substancji.
- depresja punktu zamarzania
- częstotliwość
- Miara liczby cykli danego procesu w jednostce czasu. Jednostką SI do pomiaru częstotliwości jest herc (Hz), gdzie 1 Hz = 1 cykl na sekundę.
- Grupa funkcyjna

Schemat aparatury laboratoryjnej przeznaczonej do destylacji frakcyjnej
G
- ogniwo galwaniczne
- Rodzaj baterii składającej się z elektrochemikaliów z dwóch różnych metali połączonych mostkiem solnym .
- gaz
- Jeden z czterech podstawowych stanów skupienia materii , charakteryzujący się wysokoenergetycznymi cząstkami, które wypełniają swoje pojemniki, ale nie mają określonego kształtu ani objętości.
- chromatografia gazowa
- Rodzaj chromatografii powszechnie stosowany w chemii analitycznej do izolowania i analizowania związków chemicznych, które mogą odparować bez rozkładu . Chromatografia gazowa jest często stosowana do badania czystości substancji, identyfikacji nieznanych substancji oraz do pomiaru względnych ilości różnych składników mieszanin .
- Prawo Gay-Lussaca
- Prawo chemiczne stosowane dla każdego z dwóch związków wyprowadzonych przez francuskiego chemika Josepha Louisa Gay-Lussaca , które dotyczą właściwości gazów, chociaż nazwa ta jest częściej stosowana do jego prawa łączenia objętości.
- geochemia
- Badanie chemii i składu chemicznego Ziemi oraz procesów geologicznych .
- Energia Gibbsa
- Wartość wskazująca spontaniczność reakcji. Zazwyczaj symbolizowane jako G.
- szklany
- gram-atom
- Dawne określenie mola .
- Połączenie ze szlifem szklanym
- w reakcji Grignarda
- Urządzenie przeznaczone do szybkiego i łatwego łączenia ze sobą dwóch kawałków szczelnego szkła , ze szlifowanymi powierzchniami szklanymi i zwykle wykonanym na zamówienie stożkowym stożkiem.
- Grupa
- Pionowa kolumna układu okresowego pierwiastków i pierwiastków, które ją współdzielą. Okres kontrastu .
H
- hadron
- Cząstka subatomowa typu obejmującego bariony i mezony , które mogą brać udział w oddziaływaniach silnych.
- halogen
- Dowolny z pięciu niemetalicznych pierwiastków grupy 17 układu okresowego pierwiastków : fluor (F), chlor (Cl), brom (Br), jod (I) i astat (At).
- twarda woda
- Woda o bardzo wysokiej zawartości minerałów zawartość, zwykle powstająca, gdy woda przenika przez osady bogate w wapń , magnez i niektóre inne kationy metali .
- ciepło
- Energia przenoszona z jednego układu do drugiego w wyniku oddziaływania termicznego.
- ciepło topnienia
- Zobacz entalpię topnienia .
- Prawo Henry'ego
- Prawo Hessa stałego sumowania ciepła
- Prawo chemii fizycznej , które stwierdza, że całkowita zmiana entalpii podczas przebiegu reakcji chemicznej jest taka sama, niezależnie od tego, czy reakcja jest zakończona w jednym etapie, czy w wielu etapach.
- Reguły Hunda
- hydrat
- Każda substancja zawierająca wodę lub jej elementy składowe lub jakikolwiek związek utworzony przez dodanie wody lub jej elementów do innej cząsteczki.
- reakcja hydratacji
- wodór
- wiązanie wodorowe
- Forma oddziaływania elektrostatycznego między elektroujemnymi atom i atom wodoru związany z drugim atomem elektroujemnym. Wiązanie wodorowe jest wyjątkowe, ponieważ mały rozmiar atomów wodoru pozwala na bliskość oddziałujących ładunków elektrycznych i może występować jako siła międzycząsteczkowa lub wewnątrzcząsteczkowa .
- uwodornienie
- Jakakolwiek reakcja chemiczna między wodorem cząsteczkowym ( H
2 ) a innymi substancjami chemicznymi, zazwyczaj skutkująca redukcją lub nasyceniem innych gatunków przez dodanie jednej lub więcej par atomów wodoru do związku lub pierwiastka. Obecność katalizatora jest zwykle wymagana do zajścia reakcji uwodornienia; uwodornienie niekatalityczne zachodzi tylko w ekstremalnych temperaturach. - hydroliza
- Rozerwanie wiązania chemicznego przez dodanie wody .
- uwodniony
- mający lub zawierający cząsteczki wody , odnoszący się zwłaszcza do wody hydratacyjnej . Kontrast bezwodny .
- wodorotlenek
- A dwuatomowy anion OH- składający
się z atomu wodoru związanego kowalencyjnie z atomem tlenu, mający całkowity ładunek ujemny, o wzorze chemicznym ; lub dowolny członek klasy organicznych i nieorganicznych związków zawierających grupę hydroksylową , np. wodorotlenek sodu ( NaOH ). - higroskopijność
I
- gaz doskonały
- Hipotetyczny gaz składający się z wielu losowo poruszających się cząstek punktowych, które nie uczestniczą w żadnych interakcjach międzycząsteczkowych, dzięki czemu matematycznie wygodniej jest opisywać i przewidywać ich zachowanie przy zmianie zmiennych stanu . Koncepcja gazu doskonałego jest użyteczna, ponieważ jest zgodna z prawem gazu doskonałego i może być analizowana w ramach mechaniki statystycznej .
- idealna stała gazowa
- Stała proporcjonalności w prawie gazu doskonałego , określona jako 0,08206 L · atm /( K · mol ).
- doskonałe prawo gazu
- Równanie stanu hipotetycznego gazu doskonałego , z którego wynika, że objętość takiego gazu jest proporcjonalna do ilości gazu i jego temperatury w stopniach Kelvina , a odwrotnie proporcjonalna do jego ciśnienia . Prawo gazu doskonałego łączy prawo Boyle'a , prawo Charlesa , prawo Gay-Lussaca i prawo Avogadra w jedno równanie, konwencjonalnie sformułowane jako gdzie jest idealną gazową . Zależności między zmiennymi stanu opisane w tym równaniu są dobrym przybliżeniem zachowania wielu gazów w szerokim zakresie warunków, chociaż istnieją pewne ograniczenia.
- rozwiązanie Roztwór , w którym faza gazowa wykazuje właściwości termodynamiczne analogiczne do właściwości mieszaniny gazów doskonałych .
- idealne
- wskaźnik
- zmiennej niezależnej
- Specjalny związek dodawany do roztworu , który zmienia kolor w zależności od kwasowości roztworu. Różne wskaźniki mają różne kolory i są skuteczne w różnych pH .
- radioaktywność indukowana
- Radioaktywność spowodowana bombardowaniem stabilnego izotopu cząstkami elementarnymi, tworzącymi niestabilny izotop promieniotwórczy.
- obojętny
- związek nieorganiczny
- Każdy związek chemiczny niezawierający węgla , choć są wyjątki. Kontrastowy związek organiczny .
- chemia nieorganiczna
- Dział chemii dotyczący właściwości chemicznych i reakcji związków nieorganicznych . Porównaj chemię organiczną .
- nierozpuszczalność
- Niezdolność substancji ( substancji rozpuszczonej ) do utworzenia roztworu poprzez rozpuszczenie w innej substancji ( rozpuszczalniku ); przeciwieństwo rozpuszczalności .
- inspissation
- Proces zagęszczania cieczy dowolną metodą odwodnienia , zwłaszcza odparowania .
- izolator
- Każdy materiał, który opiera się przepływowi prądu elektrycznego . Dyrygent kontrastowy .
- właściwość intensywna
- Wielkość fizyczna , której wartość nie zależy od rozmiaru układu ani od ilości materii , dla której jest mierzona. Przykłady obejmują gęstość , temperaturę i ciśnienie . Kontrast rozległa nieruchomość .
- interfejs
- Granica między dwoma obszarami przestrzennymi zajmowanymi przez inną materię lub przez materię w różnych fazach lub stanach fizycznych . Zobacz także granicę powierzchni i faz .
- międzymetaliczny
- Rodzaj stopu , który tworzy uporządkowany związek w stanie stałym między dwoma lub większą liczbą pierwiastków metalicznych . Związki międzymetaliczne są na ogół twarde i kruche oraz mają użyteczne właściwości mechaniczne w wysokich temperaturach.
- siła międzycząsteczkowa
- Każda siła, która pośredniczy w oddziaływaniu między cząsteczkami , np. elektromagnetyczne siły przyciągania lub odpychania, wiązanie wodorowe i siła van der Waalsa , z których wszystkie działają między atomami jednej cząsteczki a atomami lub jonami pobliskich cząsteczek. Siły międzycząsteczkowe są słabe w porównaniu z siłami wewnątrzcząsteczkowymi , takimi jak wiązania kowalencyjne , które utrzymują razem poszczególne cząsteczki.
- Międzynarodowy Układ Jednostek Miar (SI)
- Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC)
- Międzynarodowa federacja chemików uznawana za światowy autorytet w opracowywaniu standardów nomenklatury chemicznej i inne metodologie w chemii.
- związek śródmiąższowy
- Związek złożony z metalu przejściowego związanego z wodorem , borem , węglem lub azotem , którego struktura krystaliczna składa się z gęsto upakowanych jonów metali z atomami niemetali znajdującymi się w szczelinach.
- siła wewnątrzcząsteczkowa
- właściwość wewnętrzna
- jon
- Cząsteczka , która zyskała lub straciła jeden lub więcej elektronów ze stanu neutralnego, a zatem posiada ujemny lub dodatni ładunek elektryczny .
- wiązanie jonowe
- Przyciąganie elektrostatyczne między jonami o przeciwnych ładunkach .
- siła jonowa
- Miara stężenia jonów w roztworze , zwykle wyrażana jako molarność (mol/l roztworu) lub molarność ( mol/kg rozpuszczalnika).
- jonizacja
- Rozpad związku chemicznego na oddzielne jony .
- izoelektryczność
- Zjawisko polegające na tym, że dwa lub więcej związków chemicznych ( atomów , cząsteczek , jonów itp.) składa się z różnych pierwiastków ale mające tę samą liczbę elektronów walencyjnych i ten sam układ strukturalny (tj. taką samą liczbę atomów z tą samą łącznością). Gatunki izoelektroniczne zazwyczaj wykazują użyteczną spójność i przewidywalność swoich właściwości chemicznych.
- izomeryzacja
- izomerów
- Jony lub cząsteczki o identycznych wzorach chemicznych , ale różniących się strukturami lub układami przestrzennymi. Izomery niekoniecznie mają podobne właściwości. Dwa główne typy izomerów to izomery strukturalne i stereoizomery .
- izotop
- Odmiana określonego pierwiastka chemicznego różniąca się liczbą neutronów obecnych w jądrze . Wszystkie izotopy danego pierwiastka mają taką samą liczbę protonów w każdym atomie .

Wiązanie jonowe między atomem sodu (Na) a atomem fluoru (F). Atom sodu traci swój jedyny elektron walencyjny (pozostawiając atom z dodatnim ładunkiem elektrycznym ), a atom fluoru zyskuje ten sam elektron w procesie egzotermicznym (dając atomowi ujemny ładunek elektryczny). Przeciwnie naładowane jony są następnie przyciągane do siebie, tworząc nowy związek zwany fluorkiem sodu .
J
- dżul (J)
- Jednostka energii w układzie SI (symbol: J). Jeden dżul jest definiowany jako jeden niutonometr .
k
- kelwin (K)
- Jednostka temperatury w układzie SI (symbol: K) . Skala Kelvina to bezwzględna termodynamiczna skala temperatury, w której zero absolutne jest punktem zerowym.
- kwas ketonowy
- Dowolny związek organiczny, który można sklasyfikować zarówno jako keton , jak i kwas karboksylowy , ze względu na to, że zawiera grupę ketonową i grupę karboksylową .
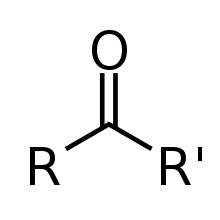
- keton
- Klasa związków organicznych i grupa funkcyjna złożona z grupy karbonylowej pomiędzy dwoma atomami węgla . Ketony mają ogólny wzór R2C = O, gdzie R może oznaczać dowolny podstawnik zawierający węgiel .
- zapłonu
- Patrz temperatura samozapłonu .
- kinetyka
- Poddziedzina chemii specjalizująca się w szybkościach reakcji .
- energia kinetyczna
- Energia obiektu związana z jego ruchem.
Wzór szkieletowy ogólnego ketonu , w którym R i R ′ oznaczają zmienne grupy podstawników zawierające węgiel
Ł
- nietrwałe
- lantanowce
- Okresowe serie pierwiastków metalicznych o liczbach atomowych od 57 do 71, od lantanu do lutetu .
- krata
- Wyjątkowy układ atomów lub cząsteczek w krystalicznej cieczy lub ciele stałym.
- energia sieci krystalicznej
- Energia uwalniana podczas tworzenia jednego mola krystalicznego związku jonowego z jego składowych jonów, które, jak się zakłada, istnieją początkowo w stanie gazowym. Energię sieci krystalicznej można postrzegać jako miarę sił spójności, które wiążą jonowe ciała stałe; jest zatem bezpośrednio związany z wieloma innymi właściwościami fizycznymi ciała stałego, w tym rozpuszczalnością , twardością i lotnością .
- prawo zachowania energii
- prawo zachowania masy
- prawo proporcji wielokrotnych
- prawa termodynamiki
- efekt niwelujący
- wpływ rozpuszczalnika na właściwości chemiczne kwasów lub zasady rozpuszczone w rozpuszczalniku. Siła mocnego kwasu jest ograniczona lub „wyrównana” przez zasadowość rozpuszczalnika, podobnie siła mocnej zasady jest ograniczona przez kwasowość rozpuszczalnika, tak że efektywne pH roztworu jest wyższe lub niższe niż może można zasugerować stałą dysocjacji kwasu lub zasady .
- Kwas Lewisa
- Zasada Lewisa
- Ligand
- struktury Lewisa
- Jon , grupa funkcyjna lub inna cząsteczka , która wiąże się z centralnym metalem atom tworzy kompleks koordynacyjny . Takie wiązanie może wahać się od kowalencyjnego do jonowego , ale generalnie obejmuje formalne przekazanie jednej lub więcej par elektronów liganda do metalu.
- światło
- Część widma elektromagnetycznego , która jest widoczna dla nieuzbrojonego oka ludzkiego.
- skraplanie
- Dowolny proces, w wyniku którego powstaje ciecz z ciała stałego lub gazu , lub w którym powstaje faza nieciekła, która zachowuje się jak płyn .
- punkt upłynnienia
- Patrz punkt topnienia .
- ciecz
- Jeden z czterech podstawowych stanów skupienia materii , charakteryzujący się obecnością prawie nieściśliwych cząstek płynu, które zachowują określoną objętość, ale nie mają ustalonego kształtu.
- ekstrakcja ciecz-ciecz (LLE)
- lokantowe
- londyńskie siły dyspersyjne
- Rodzaj słabych oddziaływań międzycząsteczkowych .
M
- plastyczność
- magnetycznych liczb kwantowych
- Zobacz plastyczność .
- manometr
- Przyrząd używany do pomiaru ciśnienia wynaleziony przez Evangelista Torricelli w 1643 r.
- środek Odczynnik stosowany w analizie chemicznej , który reaguje z jednym lub kilkoma innymi związkami chemicznymi , które mogą zakłócać analizę.
- maskujący
- masa
- Właściwość materii fizycznej , która jest miarą jej odporności na przyspieszenie , gdy a przykładana jest siła wypadkowa . Jednostką masy w układzie SI jest kilogram (kg).
- stężenie masowe
- ułamek masowy
- liczba masowa ( A )
- Całkowita liczba protonów i neutronów (zwanych łącznie nukleonami ) w jądrze atomu . Określa masę atomową atomu. Liczba masowa różni się w zależności od różnych izotopów tego samego pierwiastka chemicznego i często jest umieszczana po nazwie pierwiastka (jak w przypadku węgla-12 ) lub jako indeks górny po lewej stronie symbolu pierwiastka (jak w przypadku 12 C ) w celu zidentyfikowania określonego izotopu .
- spektrometria mas (MS)
- Technika analityczna, która mierzy stosunek masy do ładunku jonów w próbce chemicznej poprzez bombardowanie próbki elektronami aż do punktu jonizacji , a następnie rozdzielanie naładowanych fragmentów poprzez poddanie ich działaniu pola elektrycznego lub magnetycznego, zwykle w celu określenia pierwiastkowe lub izotopowe sygnatury nieznanej substancji, masy jej cząstek składowych i/lub tożsamości lub struktury zawartych w niej cząsteczek. Wyniki przedstawiono jako widmo masowe , wykres intensywności sygnałów jonowych jako funkcji stosunku masy do ładunku.
- materia
- Każda substancja, która ma masę i zajmuje przestrzeń dzięki objętości .
- metal
- Każdy pierwiastek chemiczny, który jest dobrym przewodnikiem zarówno elektryczności , jak i ciepła i który łatwo tworzy kationy i wiązania jonowe z niemetalami .
- topnienie
- Przemiana fazowa substancji ze stanu stałego w stan a ciecz .
- temperatura topnienia
- Temperatura , w której substancja zmienia stan skupienia ze stałego na ciekły . Zależy ona od ciśnienia i jest zwykle określana dla danej substancji w warunkach normalnych . Temperatura topnienia substancji jest identyczna z jej temperaturą zamarzania .
- merkaptan
- Zobacz tiol .
- merkapto
- Zobacz tiol .
- metaloid
- Pierwiastek chemiczny lub substancja posiadająca właściwości obu metale i niemetale .
- metamer
- Zobacz izomer .
- metateza
- Reakcja chemiczna obejmująca wymianę pierwiastków lub grup funkcyjnych między dwoma lub więcej związkami, zgodnie z ogólnym równaniem . Zobacz także podwójne przemieszczenie .
- metyl
- Grupa alkilowa pochodząca od metanu , składająca się z jednego atomu węgla związanego z trzema atomami wodoru, o wzorze chemicznym CH
3 . Jest najprostszą węglowodorową grupą funkcyjną i występuje jako podstawnik w wielu związkach organicznych, choć może też występować niezależnie jako jon lub rodnik. Obecność podstawnika metylowego można wskazać przedrostkiem metyl w nazwie związku lub skrótem Me we wzorach chemicznych; np. alkohol metylowy (metanol), który jest często zapisywany wzorem CH
3 OH lub MeOH . - błękit Heterocykliczny związek aromatyczny o wzorze cząsteczkowym C 16 H 18 N 3 S Cl .
- metylenowy
- probówka do mikrowirówki
- Mały plastikowy, zamykany pojemnik, który służy do przechowywania małych objętości cieczy, zazwyczaj poniżej 2 mililitrów.
- minerał
- Stały związek chemiczny o dość dobrze określonym składzie chemicznym i specyficznej strukturze krystalicznej , który występuje naturalnie w czystej postaci.
- mieszalność
- Tendencja lub zdolność dwóch lub więcej substancji (najczęściej cieczy, ale także ciał stałych i gazów) do jednolitego mieszania się po połączeniu, tj. do rozpuszczania się w sobie, tworząc jednorodną mieszaninę występującą w jednej fazie , bez rozdzielania faz, niezależnie od proporcji poszczególnych substancji. O substancjach, które nie mieszają się równomiernie we wszystkich proporcjach, mówi się, że są niemieszalne .
- mieszanina
- Materiał składający się z dwóch lub więcej różnych substancji, które są zmieszane fizycznie, ale nie są połączone chemicznie (tj. nie zaszła reakcja chemiczna, która zmieniła cząsteczki substancji w nowe substancje).
- ugrupowanie
- Każda nazwana charakterystyczna grupa, gałąź lub inna część dużej cząsteczki , którą można zidentyfikować również w innych rodzajach cząsteczek. Grupy funkcyjne są zazwyczaj mniejsze i bardziej ogólne niż ugrupowania, podczas gdy podstawniki i łańcuchy boczne często można klasyfikować jako ugrupowania i odwrotnie.
- molalność
- Miara stężenia substancji rozpuszczonej w roztworze pod względem ilości substancji rozpuszczonej na jednostkę masy rozpuszczalnika . Molalność jest zwykle wyrażana w jednostkach moli na kilogram (mol/kg); czasami mówi się, że roztwór o stężeniu dokładnie 1 mol/kg to 1 mol . Molarność kontrastu .
- molowy współczynnik tłumienia
- stężenie molowe
- Miara stężenia substancji chemicznej , zwłaszcza substancji rozpuszczonej w roztworze , wyrażona jako ilość substancji na jednostkę objętości roztworu. Molarność jest zwykle wyrażana w jednostkach moli na litr (mol/l); roztwór o stężeniu dokładnie 1 mol/L jest powszechnie określany jako 1 molowy , w skrócie 1 M. Kontrast molalność .
- ułamek molowy
- masa cząsteczkowa
- Dla danego związku chemicznego masa próbki tego związku podzielona przez ilość związku w próbce, zwykle wyrażana w gramach na mol (g/mol). Jako właściwość masowa, masa molowa jest średnią mas wielu przypadków związku, z których każdy może się nieznacznie różnić ze względu na obecność izotopów atomów składowych związku; zwykle wywodzi się z masy cząsteczkowej związku , która sama w sobie jest sumą standardowych mas atomowych składowych atomów, a zatem jest funkcją względnej obfitości izotopów występujących naturalnie na Ziemi. Masa molowa umożliwia łatwą konwersję między masą a liczbą moli przy rozważaniu masowych ilości substancji.
- mol (mol)
- Jednostka (symbol: mol) używana do pomiaru ilości substancji pod względem bezwzględnej liczby cząstek lub jednostek składających się na substancję . Z definicji jeden mol dowolnej substancji zawiera dokładnie liczbę Avogadra (tj. 6,022 × 10 23 ) cząstek lub jednostek.
- wzór cząsteczkowy
- orbital molekularny (MO)
- Dowolny obszar, w którym w cząsteczce można znaleźć jeden lub więcej elektronów (w przeciwieństwie do tego w pojedynczym atomie ).
- diagram orbity molekularnej
- masa cząsteczkowa
- cząsteczka
- Liczba atomów , które są ze sobą połączone chemicznie i łącznie są elektrycznie obojętne.
- jednoatomowy
- Posiadający tylko jeden atom , w przeciwieństwie do cząsteczki złożony z więcej niż jednego. Praktycznie wszystkie pierwiastki są jednoatomowe w gazowej w wystarczająco wysokich temperaturach. Kontrast dwuatomowy i wieloatomowy .

Różne sposoby przedstawiania grupy metylowej we wzorach strukturalnych

Probówka do mikrowirówki o pojemności 1,7 mililitra lub probówka Eppendorf zawierająca roztwór Coomassie Blue
N
- naturalna obfitość
- czysty
- Warunki z ciekłym odczynnikiem lub gazem, przeprowadzane bez dodatku rozpuszczalnika lub współrozpuszczalnika.
- neutron
- Typ cząstki subatomowej , która jest elektrycznie obojętna i nie ma ładunku wypadkowego.
- gaz szlachetny
- azot
- Dowolny z sześciu niemetalicznych pierwiastków grupy 18 układu okresowego pierwiastków : hel (He), neon (Ne), argon (Ar), krypton (Kr), ksenon (Xe) i radon (Rn). Wszystkie gazy szlachetne mają zewnętrzne powłoki elektronowe , które są całkowicie wypełnione w ich naturalnie występujących stanach, co zapewnia im bardzo niską reaktywność chemiczną.
- niemetal
- Każdy pierwiastek chemiczny, który nie jest metalem .
- związek niepolarny
- Związek składający się z cząsteczek kowalencyjnych bez stałego momentu dipolowego .
- normalność
- jądrowa
- Z jądra atomowego lub odnosząca się do jądra atomowego .
- chemia jądrowa
- Dział chemii, który bada różne procesy i właściwości związane z jądrami atomowymi , w tym radioaktywność .
- spektroskopia magnetycznego rezonansu jądrowego
- Technika wykorzystująca właściwości magnetyczne niektórych jąder atomowych, przydatna do identyfikacji nieznanych związków. Jądrowy rezonans magnetyczny jest często określany skrótem NMR .
- nukleon
- transmutacji jądrowej
- Proton lub neutron , uważany za składnik jądra atomowego .
- nukleofil
- Dowolny atom lub cząsteczka, która może przekazać parę elektronów innemu atomowi lub cząsteczce. Wszystkie cząsteczki lub jony z wolną parą elektronów lub co najmniej jednym wiązaniem pi mogą działać jako nukleofile, przez co są przyciągane do regionów innych gatunków z niedoborem elektronów ; reakcję chemiczną, w której nukleofil przekazuje parę elektronów elektrofilowi, można nazwać atakiem nukleofilowym . Ponieważ oddają elektrony, nukleofile są zasadami Lewisa .
- jądro
- Centrum atomu , złożone z neutronów i protonów i posiadające wypadkowy dodatni ładunek elektryczny.
- nuklid
- Rodzaj atomu charakteryzujący się liczbą masową , liczbą atomową i stanem energii jądrowej, pod warunkiem, że średni czas życia w tym stanie jest wystarczająco długi, aby można go było zaobserwować.
- gęstość liczbowa
- Miara koncentracji policzalnych obiektów (atomów, cząsteczek itp.) w przestrzeni, wyrażona jako liczba na jednostkę objętości .
O
- reguła oktetu
- Klasyczna reguła opisująca konfigurację elektronową atomów w niektórych cząsteczkach: maksymalna liczba par elektronów , które mogą się pomieścić w powłoce walencyjnej pierwiastka w pierwszym rzędzie układu okresowego pierwiastków, to cztery (lub łącznie osiem elektronów). W przypadku elementów w drugim i kolejnych wierszach istnieje wiele wyjątków od tej reguły.
- olefin
- Trywialna (nie IUPAC ) nazwa dowolnego alkenu .
- orbital
- aktywności optycznej
- Dowolny region atomu lub cząsteczki, w którym można znaleźć jeden lub więcej elektronów . Termin ten może odnosić się do orbitalu atomowego lub orbitalu molekularnego .
- kolejność
- hybrydyzacji orbitalnej reakcji
- kwas organiczny
- Dowolny związek organiczny o właściwościach kwasowych . Kontrastowa baza organiczna .
- zasada organiczna
- Dowolny związek organiczny o właściwościach zasadowych . Kontrast kwas organiczny .
- Chemia organiczna
- Dział chemii zajmujący się właściwościami chemicznymi i reakcjami związków organicznych . Porównaj chemię nieorganiczną .
- związek organiczny
- Każdy związek chemiczny zawierający jeden lub więcej atomów węgla . Kontrastowy związek nieorganiczny .
- organiczna reakcja redoks
- związek siarkoorganiczny
- Każdy związek chemiczny zawierający zarówno atomy węgla , jak i siarki .
- osmole
- osmoza
- Spontaniczny ruch netto lub dyfuzja cząsteczek rozpuszczalnika ( np. wody ) przez selektywnie przepuszczalną membranę oddzielającą dwa roztwory o różnych stężeniach rozpuszczonych substancji w kierunku, który dąży do wyrównania stężeń substancji rozpuszczonych po obu stronach, tj. od roztworu bardziej rozcieńczonego do bardziej stężonego roztworu lub, równoważnie, z regionu o wysokim potencjale wodnym do regionu o niskim potencjale wodnym. Ponieważ substancja rozpuszczona nie jest w stanie przejść przez membranę, tendencja do równoważenia zmusza rozpuszczalnik do przejścia przez membranę. Trwa to aż do osiągnięcia równowagi, w której żadna strona membrany nie jest bardziej lub mniej skoncentrowana niż druga.
- stężenie osmotyczne
- ciśnienie osmotyczne
- inny metal
- Dowolny pierwiastek metaliczny w bloku p , który charakteryzuje się kombinacją stosunkowo niskich temperatur topnienia (wszystkie poniżej 950 K) i stosunkowo wysokich wartości elektroujemności (wszystkie powyżej 1,6, poprawiony Pauling).
- utlenianie
- Wzrost stopnia utlenienia związku chemicznego w reakcji redoks , na ogół przez utratę elektronów . Redukcja kontrastu .
- stan utlenienia
- 1. Stopień utlenienia pojedynczego atomu w związku chemicznym, mierzony jako spadek liczby elektronów w stosunku do naturalnie występującego stanu pierwiastkowego atomu .
- 2. Hipotetyczny ładunek elektryczny (dodatni, ujemny lub zerowy), jaki miałby atom, gdyby wszystkie wiązania z atomami różnych pierwiastków były w 100% jonowe , bez składnika kowalencyjnego .
- Środek utleniający
- 1. Substancja chemiczna, która uzyskuje lub przyjmuje jeden lub więcej elektronów od innej cząsteczki, zwana środkiem redukującym , w reakcji redoks , powodując w ten sposób utlenianie innych substancji i z kolei sama ulega redukcji . Stopień utlenienia środka utleniającego maleje, podczas gdy stopień utlenienia środka redukującego wzrasta.
- 2. Substancja chemiczna przenosząca silnie elektroujemne atomy , zwykle tlen , na podłoże.
- oksokwas
- 1. Każdy kwas zawierający tlen w grupie kwasowej.
- 2. Każdy związek, który zawiera tlen, co najmniej jeden inny pierwiastek i co najmniej jeden atom wodoru związany z tlenem i który tworzy sprzężoną zasadę przez utratę dodatnich jonów wodorowych .
- tlen

Podczas osmozy przeniesienie cząsteczek rozpuszczalnika z bardziej rozcieńczonego roztworu (w lewej zlewce, po lewej stronie membrany) zwiększa stężenie substancji rozpuszczonej w tym roztworze, podczas gdy jednoczesne dodanie rozpuszczalnika do bardziej stężonego roztworu po drugiej stronie membrana zmniejsza własne stężenie. Ostatecznym rezultatem jest równowaga stężeń substancji rozpuszczonej po obu stronach membrany, chociaż objętości po każdej stronie nie są już równe (prawa zlewka).
P
- sparowany elektron
- bloku p
- Jeden z dwóch elektronów , które razem tworzą wiązanie walencyjne między dwoma atomami . Porównaj niesparowany elektron .
- parafina
- 1. Trywialna (nie IUPAC ) nazwa dowolnego alkanu .
- 2. Inna nazwa nafty .
- współczynnik podziału
- ciśnienia cząstkowego
- paskal (Pa)
- pasywacja
- Proces pokrywania substancji cienką warstwą materiału ochronnego, często tlenku metalu , aby stworzyć osłonę przed korozją lub innymi reakcjami chemicznymi z otoczeniem, czyniąc w ten sposób powleczoną substancję „pasywną” lub mniej podatną na niepożądane reakcje.
- pasywność
- Stan nieaktywności chemicznej, zwłaszcza metalu , który jest stosunkowo odporny na korozję z powodu naturalnej lub indukowanej utraty reaktywności chemicznej (jak w przypadku pasywacji ).
- pięciozasadowy
- (związku chemicznego) Posiadający pięć atomów wodoru , które można zastąpić metalami lub zasadami .
- pięciotlenek
- Dowolny związek dwuskładnikowy zawierający pięć atomów tlenu, np. pięciotlenek jodu ( I
2 O
5 ). - pentyl
- Alkilowa grupa funkcyjna
zawierająca 5 H
11 pięć atomów węgla, o wzorze chemicznym – C . Jest to forma podstawnika pentanu alkanu . - per-
- Przedrostek w nomenklaturze chemicznej IUPAC oznaczający pełny, wyczerpujący lub ekstremalny, jak w przypadku całkowicie podstawionego węglowodoru ; lub wskazujące na obecność nadtlenowej .
- nadkwas
- Kwas zawierający kwaśny nadtlenek grupa ( –O–O– ); np. kwas nadjodowy .
- okres
- Poziomy wiersz układu okresowego pierwiastków i pierwiastków z nim współdzielących. Grupa kontrastowa .
- układ okresowy pierwiastków
- Tabelaryczny układ pierwiastków chemicznych uporządkowany według ich liczby atomowej , konfiguracji elektronowej i innych właściwości chemicznych, którego przyjęta struktura pokazuje okresowe trendy i jest używany przez chemików do wyznaczania związków między różnymi pierwiastkami, a także do przewidywania właściwości i zachowania nieodkrytych lub nowo odkrytych pierwiastków zsyntetyzowane elementy. Pierwszy układ okresowy pierwiastków opublikował rosyjski chemik Dmitrij Mendelejew w 1869 roku.
- nadtlenek
- 1. Klasa związków zawierających grupę nadtlenową o ogólnym wzorze strukturalnym R–O–O–R , gdzie R oznacza dowolny pierwiastek lub grupę funkcyjną ; np. nadtlenek wodoru (empirycznie H
2 O
2 , strukturalnie H–O–O–H ). - 2. Inna nazwa samej grupy nadtlenowej.
- 3. Sól anionu O
2− 2 . _ - peroksy
- Grupa funkcyjna składająca się z dwóch atomów tlenu bezpośrednio połączonych ze sobą pojedynczym wiązaniem , a każdy z nich jest również połączony z innym atomem. Ma wzór chemiczny –O–O– .
- pH
- Skala logarytmiczna używana do określania kwasowości lub zasadowości roztworu wodnego . Skala pH jest zbliżona do wartości ujemnej logarytmu o podstawie 10 molowego stężenia jonów wodorowych w roztworze. W temperaturze pokojowej czysta woda jest neutralna (pH = 7); roztwory o pH mniejszym niż 7 są kwaśne, a te o pH większym niż 7 są zasadowe.
- faza
- Obszar przestrzeni, w którym wszystkie właściwości fizyczne substancji są zasadniczo jednolite, lub obszar materiału, który jest chemicznie jednorodny, fizycznie odrębny i często mechanicznie rozdzielny. Termin faza może mieć kilka różnych zastosowań w kontekstach chemicznych; potocznie jest często używany zamiennie ze stanem materii , ale w jednym stanie materii może istnieć wiele odrębnych faz.
- diagram fazowy
- Graficzne przedstawienie relacji równowagi między termodynamicznie odrębnymi fazami związku chemicznego, mieszaniny lub roztworu, wskazujące warunki fizyczne (np. temperatura i ciśnienie), w których różne fazy (np. stała , ciecz i para ) występują lub współistnieją.
- przemiana fazowa
- 1. Przemiana substancji chemicznej pomiędzy stanem stałym , ciekłym i gazowym oraz, w rzadkich przypadkach, plazma .
- 2. Mierzalne wartości warunków zewnętrznych, w których zachodzi taka przemiana.
- fenyl
- Grupa funkcyjna składająca się z pierścienia cyklicznego o sześciu atomach węgla o wzorze chemicznym –C
6 H
5 . Jest formą podstawnika cykloalkanowego benzenu . - wiązanie phi
- foton
- Nośnik promieniowania elektromagnetycznego o wszystkich długościach fal (takich jak promienie gamma i fale radiowe ).
- chemia fizyczna
- Dział chemii zajmujący się badaniem układów chemicznych pod kątem zasad, praktyk i koncepcji fizyki , takich jak między innymi ruch, energia, siła, czas, termodynamika , równowaga chemiczna i mechanika statystyczna. W przeciwieństwie do fizyki chemicznej , chemia fizyczna jest głównie (choć nie całkowicie) nauką makroskopową, która bada fizyczne i chemiczne interakcje masowych ilości materii.
- pipeta
- pi bond
- Narzędzie laboratoryjne powszechnie stosowane w chemii, biologii i medycynie do przenoszenia i dozowania precyzyjnie odmierzonej objętości cieczy.
- plazma
- Jeden z czterech podstawowych stanów materii , w którym cząstki o bardzo wysokiej energii są częściowo lub całkowicie zjonizowane do tego stopnia, że wykazują unikalne właściwości i zachowania w przeciwieństwie do pozostałych trzech stanów. Plazma nie występuje swobodnie na powierzchni Ziemi w warunkach naturalnych.
- polaryzacja
- poliatomowa
- Złożona z dwóch lub więcej atomów tego samego lub różnych pierwiastków. Kontrast monatomiczny i dwuatomowy .
- jon wieloatomowy
- Cząsteczka złożona z dwóch lub więcej atomów związanych kowalencyjnie , które razem przenoszą ładunek elektryczny wypadkowy i dlatego działają jak jon .
- polimeryzacja
- Wiązanie chemiczne dwóch lub więcej pojedynczych cząsteczek monomeru w celu utworzenia łańcucha lub sieci polimeru ; lub dowolna reakcja, która wytwarza takie wiązanie.
- energia potencjalna
- Energia zmagazynowana w ciele lub systemie, związana z jego położeniem w polu siłowym lub z powodu jego konfiguracji.
- osad
- Powstawanie ciała stałego w roztworze lub wewnątrz innego ciała stałego podczas reakcji chemicznej lub dyfuzji w ciele stałym.
- wytrącanie
- Proces wytwarzania możliwej do oddzielenia fazy stałej w ośrodku ciekłym , np. poprzez przekształcenie rozpuszczonej substancji rozpuszczonej w przesyconym roztworze w nierozpuszczalną substancję stałą; odczynnik powodujący taką reakcję nazywa się precypitantem , a sama substancja stała jest osadem . Mówiąc bardziej ogólnie, termin ten może odnosić się do tworzenia dowolnej nowej fazy skondensowanej poprzez zmianę właściwości fizycznych układu (np. pary wodnej w kropelki wody w stanie ciekłym).
- precyzja
- Jak bliskie są sobie wyniki wielu prób eksperymentalnych lub obserwacji. Porównaj dokładność .
- ciśnienie
- Siła przyłożona prostopadle do powierzchni przedmiotu na jednostkę powierzchni . Jednostką ciśnienia w układzie SI jest paskal (Pa), chociaż w chemii powszechnie stosuje się również wiele innych jednostek ciśnienia.
- pierwotna
- Najprostsza, najczęściej znana lub kanoniczna postać związku chemicznego z wieloma podobnymi lub izomerycznymi formami. Na przykład w alkoholu pierwszorzędowym węgiel jest związany z pojedynczą grupą podstawnikową ( R
1 CH
2 OH ), podczas gdy alkohol drugorzędowy jest podstawiony podwójnie ( R
1 R
2 CHOH ), a alkohol trzeciorzędowy jest podstawiony potrójnie ( R
1 R
2 r
3 COH ). - grupa ochronna
- proton
- Cząstka subatomowa o dodatnim ładunku elektrycznym, która znajduje się w jądrze atomu . Często oznaczany symbolem H + .
- protonowanie
- Dodanie protonu (H + ) do atomu, cząsteczki lub jonu.
- czysta substancja
- Patrz substancja chemiczna .
- piroliza
- Rozkład termiczny materiałów w podwyższonej temperaturze w obojętnej atmosferze, takiej jak gaz próżniowy.
Współczesny układ okresowy pierwiastków . Poziome rzędy nazywane są okresami , a pionowe kolumny - grupami lub rodzinami.
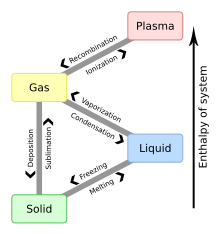
Ten diagram przedstawia nomenklaturę powszechnie używaną dla każdego z różnych przejść fazowych .
Q
- kwant
- mechanika kwantowa
- Badanie zachowania i budowy atomów, cząsteczek, cząstek subatomowych itp.
- kwark
- Cząstka elementarna i podstawowy składnik materii.
R
- racemat
- Równomolowa mieszanina pary enancjomerów , która nie wykazuje aktywności optycznej . Nazwę chemiczną lub wzór racematu odróżnia się od enancjomerów przedrostkiem (±)- lub symbolami RS i SR .
- promieniowanie
- Energia uwalniana w postaci fal lub cząstek subatomowych , gdy następuje przejście ze stanu wysokoenergetycznego do niskoenergetycznego.
- rodnik
- Każdy atom, cząsteczka lub jon, który ma co najmniej jeden niesparowany elektron walencyjny . Z nielicznymi wyjątkami takie niesparowane elektrony powodują, że rodniki są wysoce reaktywne chemicznie, a zatem rodniki organiczne są zwykle krótkotrwałe.
- rozpad promieniotwórczy
- Proces utraty energii przez niestabilne jądro atomowe poprzez emisję promieniowania.
- radiochemia
- Dział chemii zajmujący się badaniem substancji promieniotwórczych i promieniotwórczości , w tym wykorzystaniem izotopów promieniotwórczych do badania izotopów nieradioaktywnych i zwykłych reakcji chemicznych.
- Prawo Raoulta
- Prawo termodynamiki, które mówi, że ciśnienie cząstkowe każdego gazowego składnika idealnej mieszaniny cieczy jest równe prężności pary czystego składnika pomnożonej przez jego ułamek molowy w mieszaninie.
- pierwiastek ziem rzadkich
- Dowolny z 17 prawie nie do odróżnienia, srebrzystobiałych, miękkich, ciężkich metalicznych pierwiastków należących do zestawu obejmującego serię lantanowców (liczby atomowe od 57 do 71), a także skand i itr .
- równanie stawki
- etap determinujący szybkość
- Najwolniejszy etap reakcji chemicznej , który obejmuje więcej niż jeden etap. Szybkość tego etapu określa ogólną szybkość reakcji .
- reagent
- Każda substancja zużywana w trakcie reakcji chemicznej .
- mechanizm reakcji
- Sekwencja krok po kroku elementarnych reakcji, w wyniku której zachodzi większa reakcja chemiczna lub ogólna zmiana. Kompletny mechanizm musi opisywać i wyjaśniać, które wiązania są zerwane, a które powstają (i w jakiej kolejności), a także wszystkie zaangażowane reagenty , produkty i katalizatory ; kwoty każdego; wszystkie półprodukty , aktywowane kompleksy i stany przejściowe ; i stereochemia każdego gatunku chemicznego. Ponieważ w większości przypadków nie można zaobserwować szczegółowych procesów złożonej reakcji, mechanizm reakcji jest często teoretycznym przypuszczeniem opartym na wykonalności termodynamicznej i niewielkim wsparciu, jakie można uzyskać z eksperymentu.
- szybkość reakcji
- Szybkość, z jaką reagenty przekształcają się w produkty w reakcji chemicznej .
- stała szybkości reakcji
- reaktywny związek pośredni
- reaktywność
- Skłonność określonej substancji chemicznej do ulegania reakcji chemicznej , samej lub z innymi substancjami, ogólnie odnosząca się do jednej lub obu z dwóch odrębnych obserwacji: czy substancja reaguje w określonych warunkach i jak szybko reaguje (tj. szybkość reakcji ). Termodynamicznie reakcja chemiczna zachodzi, ponieważ produkty (brane jako grupa) mają niższą energię swobodną niż reagenty , a zatem są bardziej „stabilne” energetycznie, ale koncepcja reaktywności może również obejmować czynniki kinetyczne , w zależności od zastosowania. Stabilność chemiczna i kompatybilność chemiczna to pojęcia powiązane, ale odrębne.
- serie reaktywności
- Empiryczny, obliczony i strukturalnie analityczny ciąg szeregu metali , uporządkowany według ich ogólnej reaktywności od najwyższej do najniższej, służący do podsumowania informacji o ich reakcjach z kwasami i wodą oraz metodach stosowanych do ich ekstrakcji z rud.
- odczynnik
- Substancja badana dodawana do układu w celu wywołania reakcji chemicznej lub sprawdzenia, czy reakcja zachodzi.
- środek redukujący
- redoks
- Gatunek chemiczny, który traci lub przekazuje jeden lub więcej elektronów innemu gatunkowi, zwany środkiem utleniającym , w reakcji redoks , powodując w ten sposób redukcję innych gatunków, a sam z kolei ulega utlenieniu . Stopień utlenienia środka redukującego wzrasta, podczas gdy stopień utlenienia środka utleniającego maleje.
- redukcja
- Obniżenie stopnia utlenienia związku chemicznego w reakcji redoks , na ogół poprzez pozyskanie elektronów . Kontrast utlenianie .
- potencjał redukcyjny
- ogniotrwały
- 1. Posiadający wysoką temperaturę topnienia .
- 2. Materiał, który jest odporny na rozkład pod wpływem ciepła, ciśnienia lub chemikaliów oraz zachowuje swoją wytrzymałość i kształt w wysokich temperaturach, dzięki czemu nadaje się do zastosowań w środowiskach narażonych na takie warunki. Materiały ogniotrwałe to zazwyczaj związki polikrystaliczne, wielofazowe, nieorganiczne , niemetaliczne, porowate i heterogeniczne.
- retorta
- rezonansowa
- Aparatura laboratoryjna używana do destylacji lub sucha destylacja substancji chemicznych, tradycyjnie składająca się z kulistego naczynia z długą szyjką skierowaną w dół, która odprowadza skroplone opary wytwarzane podczas destylacji do oddzielnego naczynia zbiorczego.
- reakcja odwracalna
- Reakcja chemiczna , która może przebiegać w dowolnym kierunku w zależności od warunków reakcji, tj. od reagentów do produktów lub od produktów do reagentów, w szczególności oznacza taką, w której obie przemiany zachodzą jednocześnie. Nieodwracalna reakcja kontrastu .
- rdza
- kolby okrągłodennej
- rotameru
S
- s-block
- Zbiorcza nazwa pierwiastków z grup 1 i 2 układu okresowego pierwiastków ( metale alkaliczne i metale alkaliczne ), a także wodór i hel .
- roztwór soli
- Powszechny termin oznaczający roztwór chlorku sodu (NaCl) rozpuszczonego w wodzie (H 2 O).
- sól
- Dowolny związek jonowy składający się z jednego lub więcej anionów i jednego lub więcej kationów .
- mostek solny
- Urządzenie służące do połączenia redukcji z półogniwami utleniającymi w ogniwie elektrochemicznym .
- nasycenie
- równanie Schrödingera
- Równanie stanu kwantowego, które przedstawia zachowanie elektronu wokół atomu.
- półprzewodnik
- reakcji drugiego rzędu
- Ciało stałe przewodzące prąd elektryczny, którego stopień przewodnictwa leży gdzieś pomiędzy przewodnictwem przewodnika a przewodnictwem izolatora .
- łańcuch boczny
- rozcieńczeń seryjnych
- Grupa podstawników chemicznych który jest przyłączony do części rdzenia lub „ szkieletu ” większej cząsteczki , zwłaszcza oligomerycznego lub polimerowego łańcucha węglowodorowego , który odgałęzia się od dłuższego pierwszorzędowego łańcucha makrocząsteczki . Termin ten jest najczęściej spotykany w biochemii i chemii organicznej .
- wiązanie Wiązanie polegające na dzieleniu jednej pary elektronów .
- pojedyncze
- szkieletowa
- zol
- Zawiesina formuła cząstek stałych w cieczy. Sztuczne przykłady obejmują zol-żele .
- ciało stałe
- Jeden z czterech podstawowych stanów skupienia materii , charakteryzujący się stosunkowo niskoenergetycznymi cząstkami upakowanymi blisko siebie w sztywnych strukturach o określonym kształcie i objętości. Zobacz moduł Younga .
- ekstrakcja do fazy stałej SPE)
- rozpuszczalność
- ( Właściwość rozpuszczania substancji stałej , ciekłej lub gazowej w stałym, ciekłym lub gazowym rozpuszczalniku . Zwykle wyraża się ją jako proporcję substancji rozpuszczonej rozpuszczonej w rozpuszczalniku w całkowicie nasyconym roztworze .
- iloczyn rozpuszczalności ( lub Miara
- rozpuszczalności jonowej substancji rozpuszczonej , wyrażona jako iloczyn arytmetyczny stężeń jego jonów w całkowicie nasyconym roztworze, w odniesieniu do określonej dysocjacji substancji rozpuszczonej równowagą i obecnością poszczególnych jonów. Dla równowagi dysocjacji B jest dana przez , gdzie i to stężenia składników jonowych substancji rozpuszczonej w nasyconym roztworze. Produkt rozpuszczalności wywodzi się z i działa jak stała równowagi dysocjacji, chociaż w przeciwieństwie do stałej równowagi nie jest bezwymiarowy. Jeśli iloczyn stężeń jonów w roztworze przekracza iloczyn rozpuszczalności, wytrącanie . substancja
- rozpuszczona
- Część roztworu rozpuszczona w rozpuszczalniku . Na przykład chlorek sodu (NaCl) jest substancją rozpuszczoną w roztworze słonej wody.
- rozwiązanie
- Jednorodny mieszanina składająca się z wielu substancji ogólnie określanych jako substancje rozpuszczone i rozpuszczalniki . solwatowana
- solwatacja
- elektronowa
- Każde stabilizujące oddziaływanie substancji rozpuszczonej z rozpuszczalnikiem lub podobne oddziaływanie między rozpuszczalnikiem a grupami nierozpuszczalnego materiału (np. grupami jonowymi żywicy jonowymiennej ) . Takie interakcje na ogół obejmują siły elektrostatyczne i siły van der Waalsa , a także efekty specyficzne dla związku, takie jak wiązanie wodorowe . Zobacz też rozwiązanie .
- rozpuszczalnik powłoki solwatacyjnej
- Część
- roztworu , która rozpuszcza substancję rozpuszczoną . Na przykład woda (H2O ) jest rozpuszczalnikiem w roztworze słonej wody.
- sonikacja
- Proces naświetlania substancji energią dźwiękową, zwykle o częstotliwościach ultradźwiękowych (>20 kHz ), w celu wzburzenia cząstek w próbce w różnych celach, takich jak zwiększenie szybkości reakcji chemicznej lub przygotowanie pęcherzyków w mieszaninach środków powierzchniowo czynnych i woda.
- izomer przestrzenny
- Zobacz stereoizomer .
- ciepło właściwe ( c p )
- Pojemność cieplna próbki substancji podzielona przez masę próbki. Nieformalnie jest to ilość ciepła , którą należy dostarczyć do jednostki masy substancji, aby spowodować wzrost temperatury o jednostkę . Jednostką ciepła właściwego w układzie SI jest dżul na kelwin na kilogram (J/K/kg). Ciepło właściwe często zmienia się wraz z temperaturą i każdym stanem skupienia .
- spektrochemia
- spektrometria
- Zob spektrometria mas .
- spektroskopia
- Badanie promieniowania i materii , takie jak absorpcja rentgenowska i spektroskopia emisyjna.
- rozwiązanie standardowe
- standardowe warunki temperatury i ciśnienia (STP)
- Standaryzacja temperatury i ciśnienia otoczenia stosowana w celu łatwego porównania wyników eksperymentów. Standardowa temperatura to 25 stopni Celsjusza (°C), a standardowe ciśnienie to 100 000 kilopaskali (kPa). Standardowe warunki są często oznaczane skrótem STP lub SATP .
- stan materii
- Stan materii występujący w odrębnej, jednorodnej, makroskopowej postaci. Ciało stałe , ciecz , gaz i plazma to cztery tradycyjne i najbardziej znane stany materii. Zobacz także faza .
- centrum stereogeniczne
- stereochemii
- reakcji krokowej
- stereoizomer
- Izomer , który ma identyczny skład chemiczny , ale różni się przestrzennym rozmieszczeniem atomów.
- stechiometria
- Obliczanie ilości reagentów i produktów reakcji chemicznych . Stechiometria opiera się na prawie zachowania masy i obserwacji, że ilości reagentów i produktów zazwyczaj występują w stosunkach dodatnich liczb całkowitych, co oznacza, że jeśli znane są ilości oddzielnych reagentów, można obliczyć ilości produktów i nawzajem.
- mocny
- kwas Kwas całkowicie dysocjuje reakcją _ do tego stopnia, że stężenie gatunków jest zbyt niskie, aby można je było zmierzyć Dowolny kwas o pKa mniej niż w przybliżeniu -2 jest ogólnie uważany za mocny kwas; przykładem jest kwas solny (HCl). Porównaj słaby kwas .
- wzór strukturalny
- mocnej zasady
- Graficzne przedstawienie struktury cząsteczkowej i geometrii określonego związku chemicznego , pokazujące rozmieszczenie atomów w rzeczywistej, trójwymiarowej przestrzeni. Wiązanie chemiczne w cząsteczce jest również pokazany, pośrednio lub jawnie. Znane z całą pewnością wzory strukturalne są bardzo przydatne, ponieważ umożliwiają chemikom wizualizację cząsteczek i zmian strukturalnych zachodzących w nich podczas reakcji chemicznych .
- izomer strukturalny
- cząstka subatomowa
- Każda cząstka mniejsza od atomu . Przykłady obejmują protony , neutrony i elektrony .
- sublimacja
- Przemiana fazowa substancji ze stanu stałego w wodę wapienną w paliwo lub gaz bez widocznej pośredniej przemiany w ciecz w procesie.
- substancja
- Patrz substancja chemiczna .
- podstawnik
- atom _ lub grupa atomów, która zastępuje inny atom lub grupę atomów w większej cząsteczce jako produkt reakcji chemicznej , stając się w ten sposób ugrupowaniem nowo utworzonego związku, generalnie bez powodowania jakichkolwiek znaczących zmian w innych częściach tej samej cząsteczki. Na przykład grupa hydroksylowa może zastąpić dowolny atom wodoru w benzenie , tworząc fenol . Zobacz także łańcuch boczny i grupę funkcyjną .
- reakcja podstawienia
- Rodzaj reakcji chemicznej , w której jedna grupa funkcyjna w większym związku zastępuje lub jest zastępowana inną grupą funkcyjną.
- pierwiastki superciężkie
- Zobacz transaktynowce .
- powierzchnioznawstwo
- surfaktant
- powierzchniowy
- Substancja, która obniża napięcie powierzchniowe ośrodka, w którym jest rozpuszczona, i/lub napięcie międzyfazowe z innymi fazami, iw związku z tym jest dodatnio adsorbowana na granicy faz ciecz-para i/lub na innych granicach faz.
- zawieszenie
- heterogeniczne mieszanina zawierająca cząstki stałe , które są wystarczająco duże, aby nastąpiła sedymentacja , w wyniku której takie cząstki oddzielają się od płynu i osadzają się z niego w miarę upływu czasu, jeśli nie są naruszone. W zawiesinie substancja rozpuszczona nie rozpuszcza się , ale pozostaje rozproszona lub zawieszona w płynnym rozpuszczalniku tylko przejściowo i przy mechanicznym mieszaniu. Kontrastowy koloid i roztwór .
T
- matowienie
- Cienka warstwa korozji , która tworzy się na powierzchni miedzi, mosiądzu, aluminium, magnezu i innych miękkich metali lub stopów , gdy ich najbardziej zewnętrzna warstwa przechodzi reakcję chemiczną z otaczającym powietrzem, często, ale niekoniecznie, z udziałem tlenu atmosferycznego. Nalot zwykle pojawia się jako matowoszary, czarny lub czasami opalizujący film lub powłoka na metalu. Jest to samoograniczające się zjawisko powierzchniowe, ponieważ zmatowiałe wierzchnie warstwy metalu chronią leżące poniżej warstwy przed reakcją.
- temperatura
- Proporcjonalna miara średniej energia kinetyczna przypadkowych ruchów składowych mikroskopijnych cząstek układu. Jednostką temperatury w układzie SI jest kelwin .
- związek trójskładnikowy
- Związek chemiczny zawierający trzy różne pierwiastki .
- terpen
- Klasa naturalnie występujących węglowodorów nienasyconych o szkielecie węglowym pochodzącym z jednej lub więcej jednostek izoprenu ( C
5 H
8 ). Terpeny są często ,
dzielone na podgrupy według całkowitej liczby zawartych w nich atomów węgla, np. ,
hemiterpeny itp
C5 monoterpeny C10 diterpeny C20 . - Wydajność teoretyczna
- Patrz wydajność .
- przewodność cieplna
- Właściwość materiału, która pozwala mu przewodzić energię cieplną lub ciepło (wielkość często oznaczana przez ).
- termochemia
- Badanie wchłaniania lub uwalniania ciepło podczas reakcji chemicznej .
- stabilność termodynamiczna
- Stan, w którym układ znajduje się w najniższym stanie energetycznym z otoczeniem (równowaga).
- termodynamika
- Badanie skutków zmiany temperatury, objętości lub ciśnienia (lub pracy, ciepła i energii) w skali makroskopowej.
- termometr
- Przyrząd służący do pomiaru temperatury .
- tiol
- 1. Dowolny z klasy organicznych związków siarki składających się z atomu siarki przyłączonego do atomu wodoru i dowolnego innego podstawnika organicznego , o ogólnym wzorze R – SH. Tiole są siarkowymi odpowiednikami alkoholi . Także pochodna tiolowa i merkaptan . 2. Sama
- grupa funkcyjna –SH . Również sulfhydryl , sulfanyl i merkapto .
- miareczkowanie
- Laboratoryjna metoda ilościowej analizy chemicznej, która służy do określenia stężenia zidentyfikowanego analitu . Procedura polega na przygotowaniu określonego odczynnika jako roztworu wzorcowego o znanym stężeniu i objętości ( tzw .
- torr
- Jednostka miary ciśnienia , odpowiadająca 133,322 Pa lub 1,3158 × 10-3 atm .
- pierwiastek Pierwiastek w próbce, którego średnie stężenie jest mniejsze niż 100 części na milion atomów lub mniejsze niż 100 mikrogramów na gram.
- śladowy
- transaktynidy
- W układzie okresowym pierwiastki chemiczne o liczbie atomowej większej niż 103, czyli te cięższe od aktynowców . Transaktynowce są podzbiorem pierwiastków transuranowych .
- metal Pierwiastek , którego atomy naturalnie występują z niecałkowicie wypełnionymi podpowłokami „d”. Elementy te są zgrupowane jako tak zwane elementy bloku d w układzie okresowym .
- przejściowy
- pierwiastki transuranowe
- Zbiór pierwiastków chemicznych o liczbie atomowej większej niż 92, czyli występujących po uranie w układzie okresowym . Żaden z pierwiastków transuranowych nie jest stabilny w warunkach naturalnych.
- wiązanie Wiązanie , które obejmuje kowalencyjne współdzielenie trzech par elektronów (na przykład dwuatomowa cząsteczka azotu, N 2 , składa się z dwóch atomów azotu połączonych wiązaniem potrójnym).
- potrójne
- punkt potrójny
- Miejsce, w którym temperatura i ciśnienie trzech faz jest takie samo. Woda ma specjalny diagram fazowy.
- Efekt Tyndalla
- Efekt rozpraszania światła przez cząstki koloidalne lub zawieszone .
Wzór szkieletowy dla ogólnego tiolu , gdzie R oznacza zmienną grupę podstawników zawierających węgiel
u
- Numer UN
- Czterocyfrowy kod używany do oznaczania substancji niebezpiecznych i łatwopalnych.
- niepewność
- Pogląd, że żaden pomiar obejmujący oszacowanie dowolnej wielkości nie może być dokładnie powtarzalny.
- zasada nieoznaczoności
- Znajomość położenia cząstki sprawia, że pęd jest niepewny, natomiast znajomość pędu cząstki powoduje niepewność położenia.
- komórka elementarna
- Najmniejsza powtarzająca się jednostka sieci krystalicznej .
- współczynnik jednostek
- Instrukcje używane przy przeliczaniu jednostek.
- niesparowany elektron
V
- termos
- Naczynie do przechowywania składające się z dwóch kolb lub innych pojemników, umieszczonych jedna w drugiej i połączonych szyjką oraz przestrzeni pomiędzy nimi, która jest częściowo opróżniona z powietrza, tworząc bliską próżnię, która znacznie zmniejsza przenoszenie ciepła między wnętrzem naczynia i jego otoczenia. Termosy mogą znacznie wydłużyć czas, w którym ich zawartość pozostaje cieplejsza lub chłodniejsza niż otoczenie.
- elektron walencyjny
- Dowolny z najbardziej zewnętrznych elektronów atomu, które znajdują się w powłokach elektronowych .
- teoria wiązań walencyjnych
- Teoria wyjaśniająca wiązania chemiczne w cząsteczkach poprzez omówienie wartościowości , liczby wiązań chemicznych tworzonych przez atom.
- wartościowość
- Zdolność łączenia elementu.
- siła van der Waalsa
- Jedna z sił (przyciągania/odpychania) między cząsteczkami.
- współczynnik van 't Hoffa
- Stosunek liczby moli cząstek w roztworze do liczby moli rozpuszczonej substancji .
- para
- Gdy substancja znajduje się w fazie gazowej poniżej temperatury krytycznej .
- ciśnienie pary
- Ciśnienie wywierane przez parę znajdującą się w równowadze termodynamicznej ze swoimi fazami skondensowanymi ( stałymi lub ciekłymi ) w danej temperaturze w układzie zamkniętym . Jest powszechnie opisywany jako tendencja cząstek do samorzutnej ucieczki ze stanu ciekłego lub stałego do stanu gazowego i jest używany jako wskaźnik szybkości parowania cieczy .
- odparowanie
- Przemiana fazowa substancji z cieczy w gaz .
- temperatura parowania
- Patrz temperatura wrzenia .
- lepkość
- Miara oporu przepływu cieczy .
- lotność
- Jakość materiału, która opisuje, jak łatwo substancja odparowuje . W danej temperaturze i ciśnieniu istnieje większe prawdopodobieństwo, że substancja o dużej lotności występuje w postaci gazu , podczas gdy substancja o małej lotności występuje częściej w postaci cieczy lub stałe ; równoważnie mniej lotne substancje będą łatwiej skraplać się ze stanu gazowego niż te wysoce lotne.
- wolt (V)
- Jednostka pochodna potencjału elektrycznego , różnicy potencjałów elektrycznych i siły elektromotorycznej , zdefiniowana jako jeden dżul pracy na kulomb .
- woltomierz
- Przyrząd do pomiaru potencjału elektrycznego ogniwa .
- objętość
- Wielkość przestrzeni trójwymiarowej zamknięta przez zamkniętą powierzchnię lub przestrzeń, którą zajmuje lub zawiera substancja (ciało stałe, ciecz, gaz lub plazma) lub kształt. Jednostką objętości w układzie SI jest metr sześcienny (m 3 ).
- analiza wolumetryczna
- Patrz miareczkowanie .
- kolba miarowa
W
- szkiełko zegarkowe
- Okrągły, wklęsły kawałek szkła powszechnie używany w laboratoriach chemicznych jako powierzchnia robocza do różnych celów, takich jak odparowywanie cieczy, utrzymywanie ciał stałych podczas ich ważenia, podgrzewanie niewielkich ilości substancji lub jako przykrywka do zlewki .
- woda
- Polarny związek nieorganiczny o wzorze chemicznym H 2 O, który jest bez smaku, bezwonny i ogólnie bezbarwną cieczą w standardowej temperaturze i ciśnieniu , chociaż występuje również naturalnie jako ciało stałe i gaz na powierzchni Ziemi. Jest to najbardziej rozpowszechniona substancja na Ziemi, a zatem integralny składnik praktycznie wszystkich systemów chemicznych i biologicznych. Woda jest często opisywana jako „uniwersalny rozpuszczalnik ” ze względu na jej wrodzoną zdolność rozpuszczania wielu substancji.
- woda krystalizacyjna
- wody obecne w kryształach . Po krystalizacji z wody lub roztworów wodnych wiele związków zawiera wodę w swoich strukturach krystalicznych; cząsteczki wody są zwykle obecne w stechiometrycznym i mogą oddziaływać w różnym stopniu z atomami kryształu.
- funkcja falowa
- Funkcja matematyczna opisująca położenie elektronu w przestrzeni trójwymiarowej.
- słaby kwas
- Kwas , który dysocjuje tylko częściowo w rozpuszczalniku ponieważ reakcją , gdy gatunków _ jest nadal znaczący; przykładem jest kwas octowy (CH3COOH ) . Kontrast mocny kwas .
- słabo zasadowa
- chemia mokra
- Forma chemii analitycznej , która wykorzystuje klasyczne metody laboratoryjne, takie jak prosta obserwacja i elementarne testy chemiczne do badania związków chemicznych i reakcji chemicznych, tj. bez użycia wyrafinowanych instrumentów lub zautomatyzowanej lub skomputeryzowanej analizy. Jest często używany w szkołach do nauczania zasad chemii dla uczniów.
- obróbka
- środka zwilżającego
- Seria
- manipulacji wymaganych do wyizolowania i oczyszczenia pożądanego produktu lub produktów reakcji chemicznej .
X
- Promieniowanie rentgenowskie
- Forma jonizującego promieniowania elektromagnetycznego między promieniami gamma i UV w widmie elektromagnetycznym .
- Dyfrakcja rentgenowska
- metoda ustalania struktur krystalicznych ciał stałych przy użyciu promieni rentgenowskich o pojedynczej długości fali i obserwacji obrazu dyfrakcyjnego.
- Rentgenowska spektroskopia fotoelektronów
- Technika spektroskopowa używana do pomiaru składu chemicznego materiału.
Y
- wydajność Wymierna
- ilość produktu wytworzonego podczas reakcji chemicznej .
Z
- topienie strefowe
- Sposób usuwania zanieczyszczeń z elementu poprzez stopienie go i powolne przemieszczanie się w dół wlewka (odlewu).
- cynk
- Metaliczny pierwiastek chemiczny o liczbie atomowej 30 i symbolu Zn.
- jon obojnaczy
- Dowolna cząsteczka, która zawiera wewnętrzną polaryzację dzięki równej liczbie dodatnio naładowanych i ujemnie naładowanych grup funkcyjnych .
Zobacz też
- Zarys chemii
- Indeks artykułów chemicznych
- Lista pierwiastków chemicznych
- Słowniczek dziedzin matematyki
- Słowniczek biologii
- Słowniczek inżynierii
- Słowniczek fizyki
















![{\textstyle K_{{\ce {s}}}=[{\ce {A+}}]^{x}[{\ce {B-}}]^{y}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/846796149c475d808bcf953cb72edfe83e6a6c62)
![{\textstyle [{\ce {A+}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1295d5e193de0a7dd071d683d08a0f3e2d60824e)
![{\textstyle [{\ce {B-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/449418fe3fa94f81a0a2156133bf8bda4b121720)