P-TEFb

Dodatni czynnik elongacji transkrypcji, P-TEFb , jest kompleksem wielobiałkowym, który odgrywa istotną rolę w regulacji transkrypcji przez polimerazę RNA II (Pol II) u eukariontów. Natychmiast po inicjacji Pol II zostaje uwięziony w proksymalnych, zatrzymanych pozycjach promotora w większości ludzkich genów (ryc. 1). P-TEFb jest kinazą zależną od cyklin, która może fosforylować DRB ( DSIF ) i ujemny czynnik wydłużania (NELF), jak również domeny końca karboksylowego dużej podjednostki Pol II, co powoduje przejście do elongacji produktywnej prowadzącej do syntezy mRNA. P-TEFb jest częściowo regulowany przez odwracalne powiązanie z 7SK snRNP. Traktowanie komórek inhibitorami P-TEFb DRB lub flawopidirolem prowadzi do utraty produkcji mRNA i ostatecznie do śmierci komórki.
Odkrycie, skład i struktura
Zidentyfikowano i oczyszczono P-TEFb jako czynnik potrzebny do generowania transkryptów o długim przepływie przy użyciu systemu transkrypcji in vitro pochodzącego z komórek Drosophila. Jest to kinaza zależna od cykliny , zawierająca podjednostkę katalityczną Cdk9 i podjednostkę regulatorową, cyklinę T u Drosophila. U ludzi istnieje wiele form P-TEFb, które zawierają Cdk9 i jedną z kilku podjednostek cykliny, cykliny T1, T2 i K. P-TEFb wiąże się z innymi czynnikami, w tym białkiem bromodomeny BRD4 i jest związany z dużym kompleksem białek zwanym kompleksem super elongacyjnym. Co ważne, w przypadku wirusa AIDS, HIV , P-TEFb jest celem białka Tat HIV , które omija normalną komórkową kontrolę P-TEFb i bezpośrednio przenosi P-TEFb do promotora proksymalnej zatrzymanej polimerazy w genomie HIV.
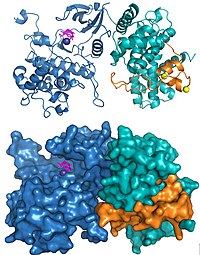
Struktury ludzkiego P-TEFb zawierającego Cdk9 i cyklinę T1 oraz kompleks HIV Tat•P-TEFb zostały rozwiązane za pomocą krystalografii rentgenowskiej. Pierwsza rozwiązana struktura wykazała, że dwie podjednostki były ułożone tak, jak stwierdzono w innych kinazach zależnych od cyklin. Trzy substytucje aminokwasów zostały nieumyślnie wprowadzone w podjednostkach użytych do pierwotnej struktury, a późniejsze określenie struktury przy użyciu prawidłowych sekwencji wykazało tę samą ogólną strukturę, z wyjątkiem kilku znaczących zmian wokół miejsca aktywnego. Struktura HIV Tat związana z P-TEFb wykazała, że wirusowe białko tworzy rozległe kontakty z podjednostką cykliny T1 (ryc. 2).
Regulacja P-TEFb
Ze względu na swoją centralną rolę w kontrolowaniu ekspresji genów eukariotycznych, P-TEFb podlega ścisłej regulacji na poziomie transkrypcji genów kodujących podjednostki, translacji mRNA podjednostki, obrotu podjednostek, a także poprzez nietypowy mechanizm polegający na 7SK snRNP. Jak pokazano na rycinie 3, P-TEFb jest utrzymywany w 7SK snRNP przez białko wiążące dwuniciowy RNA HEXIM ( HEXIM1 lub HEXIM2 w ludziach). HEXIM związany z 7SK RNA lub dowolnym dwuniciowym RNA wiąże się z P-TEFb i hamuje aktywność kinazy. Dwa inne białka są zawsze związane z 7SK RNA. Enzym czapeczkujący fosfazę metylową MEPCE umieszcza grupę metylową na gammafosforanie pierwszego nukleotydu 7SK RNA, a białko LARP7 związane z La wiąże się z końcem 3' 7SK. Kiedy P-TEFb jest ekstrahowany z 7SK snRNP, 7SK RNA ulega zmianie konformacji, HEXIM jest wyrzucany i hnRNP w miejsce usuniętych czynników. Ponowna sekwestracja P-TEFb wymaga kolejnej rearanżacji RNA, związania HEXIM, a następnie P-TEFb. W szybko rosnących komórkach dominującą formą P-TEFb jest 7SK snRNP. Do wglądu.