Reakcja Prilezhaeva
| Reakcja Prilezhaeva | |
|---|---|
| Nazwany po | Nikołaj Aleksandrowicz Prilezhaev (pisany także Nikolaj Alexandrovich Prileschajew, ros. Николай Александрович Прилежаев) |
| Typ reakcji | Reakcja tworzenia pierścienia |
| Identyfikatory | |
| Portal chemii organicznej | |
| Identyfikator ontologii RSC | |
Reakcja Prilezhaeva , znana również jako reakcja Prileschajewa lub epoksydacja Prilezhaeva , jest reakcją chemiczną alkenu z kwasem nadtlenowym , w wyniku której powstają epoksydy . Jego nazwa pochodzi od Nikołaja Prilezhaeva , który jako pierwszy opisał tę reakcję w 1909 roku. Powszechnie stosowanym kwasem nadtlenowym w tej reakcji jest kwas meta -chloronadbenzoesowy ( m.in. -CPBA), ze względu na stabilność i dobrą rozpuszczalność w większości rozpuszczalników organicznych. Reakcję prowadzi się w obojętnych rozpuszczalnikach (C6H14, C6H6, CH2Cl2, CHCl3, CCl4) w temperaturze od -10 do 60°C z wydajnością 60-80%.
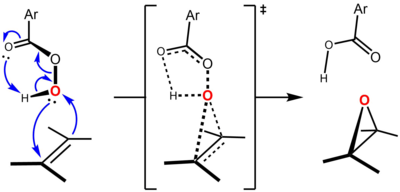
Ilustrującym przykładem jest epoksydacja trans -2-butenu za pomocą m -CPBA z wytworzeniem trans -2,3-epoksybutanu :
Atom tlenu, który dodaje się przez podwójne wiązanie alkenu, jest pobierany z kwasu nadtlenowego, tworząc cząsteczkę odpowiedniego kwasu karboksylowego jako produkt uboczny. Reakcja jest wysoce stereospecyficzna w tym sensie, że stereochemia podwójnych wiązań jest na ogół przenoszona na względną konfigurację epoksydu z zasadniczo doskonałą wiernością, tak że trans-olefina prowadzi do stereoselektywnego tworzenia wyłącznie trans -2,3-podstawionego epoksydu , jak ilustruje powyższy przykład, podczas gdy cis -olefina dałaby tylko cis- epoksyd. Ten wynik stereochemiczny jest konsekwencją przyjętego mechanizmu omówionego poniżej.
Mechanizm reakcji
Reakcja przebiega zgodnie z tak zwanym „mechanizmem motylkowym”, zaproponowanym po raz pierwszy przez Bartletta, w którym nadkwas jest wewnątrzcząsteczkowo wiązaniem wodorowym w stanie przejściowym. Chociaż istnieją graniczne interakcje orbitalne w obu kierunkach, nadkwas jest ogólnie postrzegany jako elektrofil , a alken jako nukleofil . Na poparcie tego poglądu alkeny bardziej bogate w elektrony ulegają epoksydacji z większą szybkością. Na przykład względne szybkości epoksydacji rosną po podstawieniu metylowym alkenu (grupy metylowe zwiększają gęstość elektronową wiązania podwójnego o hiperkoniugacja ): etylen (1, bez grup metylowych), propen (24, jedna grupa metylowa), cis -2-buten (500, dwie grupy metylowe), 2-metylo-2-buten (6500, trzy grupy metylowe), 2 ,3-dimetylo-2-buten (>6500, cztery grupy metylowe).
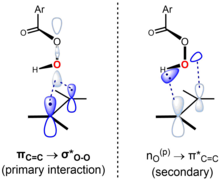
Uważa się, że reakcja jest skoordynowana, a stan przejściowy jest synchroniczny lub prawie synchroniczny. „Mechanizm motylkowy” zachodzi poprzez geometrię stanu przejściowego, w którym płaszczyzna nadkwasu przecina płaszczyznę alkenu na pół, z wiązaniem O – O ustawionym prostopadle do niej. Ta konformacja pozwala na wystąpienie kluczowych granicznych interakcji orbitalnych. Podstawowa interakcja zajętego orbitalu π C=C (HOMO) i nisko położonego niezajętego σ* OO orbitalny (LUMO). Ta interakcja wyjaśnia obserwowany ogólny charakter nukleofilowy i elektrofilowy, odpowiednio, alkenu i nadkwasu. Istnieje również wtórna interakcja pomiędzy orbitalem samotnej pary prostopadłym do płaszczyzny nadkwasu, n O (p) (HOMO) i niezajętym orbitalem π* C=C (LUMO). Stosując podejście Anslyna i Dougherty’ego (2006, s. 556), mechanizm można przedstawić w następujący sposób:
Istnieje bardzo duża zależność szybkości reakcji od wyboru rozpuszczalnika.