Reakcja egzergoniczna
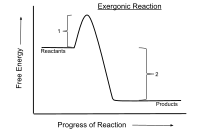
W termodynamice chemicznej reakcja egzergoniczna jest reakcją chemiczną , w której zmiana energii swobodnej jest ujemna (występuje uwolnienie energii swobodnej). Wskazuje to na spontaniczną reakcję , jeśli układ jest zamknięty , a temperatury początkowa i końcowa są takie same. Dla procesów zachodzących w układzie zamkniętym przy stałym ciśnieniu i temperaturze wykorzystywana jest energia swobodna Gibbsa , natomiast dla procesów zachodzących w stałej objętości i temperaturze istotna jest energia Helmholtza . Każda reakcja zachodząca w stałej temperaturze bez wkładu energii elektrycznej lub fotonowej jest egzergoniczna, zgodnie z drugą zasadą termodynamiki . Przykładem jest oddychanie komórkowe .
Symbolicznie uwolnienie energii swobodnej w reakcji egzergonicznej (przy stałym ciśnieniu i temperaturze) jest oznaczone jako sol
Chociaż mówi się, że reakcje egzergoniczne zachodzą spontanicznie , nie oznacza to, że będą zachodzić z obserwowalną szybkością . Na przykład dysproporcjonowanie nadtlenku wodoru uwalnia energię swobodną, ale jest bardzo powolne w przypadku braku odpowiedniego katalizatora. Sugerowano, że chętny byłby terminem bardziej intuicyjnym w tym kontekście.
Mówiąc bardziej ogólnie, terminy egzergoniczny i endergoniczny odnoszą się do zmiany energii swobodnej w dowolnym procesie, nie tylko w reakcjach chemicznych. Natomiast terminy egzotermiczny i endotermiczny odnoszą się do zmiany entalpii w układzie zamkniętym podczas procesu, zwykle związanego z wymianą ciepła .

