Reakcja petasisa
| Reakcja petasisa | |
|---|---|
| Nazwany po | Nicos A. Petasis |
| Typ reakcji | Reakcja sprzęgania |
| Identyfikatory | |
| Portal Chemii Organicznej | |
| Identyfikator ontologii RSC | |
Reakcja Petasisa (alternatywnie nazywana reakcją Petasisa boronowo-Mannicha (PBM) ) jest wieloskładnikową reakcją aminy , karbonylu i kwasu winylowego lub arylo - borowego , w wyniku której powstają podstawione aminy.
Zgłoszona w 1993 roku przez Nicosa Petasisa jako praktyczna metoda syntezy geometrycznie czystego środka przeciwgrzybiczego, naftyfiny . W reakcji Petasisa grupa winylowa kwasu boronoorganicznego służy jako nukleofil. W porównaniu z innymi metodami generowania alliloamin, reakcja Petasisa toleruje wielofunkcyjne rusztowanie, z różnymi aminami i kwasami boronoorganicznymi jako potencjalnymi materiałami wyjściowymi. Ponadto reakcja nie wymaga warunków bezwodnych ani obojętnych. Jako łagodna, selektywna synteza, reakcja Petasisa jest przydatna do generowania α-aminokwasów i jest wykorzystywana w chemii kombinatorycznej i odkrycie leku .
Zakres reakcji i zastosowania syntetyczne
Aminę kondensuje się z karbonylem, po czym dodaje się kwas boronowy.
Jedną z najbardziej atrakcyjnych cech reakcji Petasisa jest stabilność kwasów winyloborowych. Wraz z pojawieniem się sprzęgła Suzuki , wiele z nich jest dostępnych na rynku.
Opisano również inne metody wytwarzania kwasów boronowych.
W reakcji Petasisa tolerowana jest szeroka gama grup funkcyjnych, w tym alkohole, kwasy karboksylowe i aminy. Znane substraty, które są kompatybilne z warunkami reakcji, obejmują estry winyloboronowe, estry aryloboronowe i organotrifluoroborany potasu . Ponadto można stosować różne podstawione aminy inne niż aminy drugorzędowe. Opisano trzeciorzędowe aminy aromatyczne , hydrazyny , hydroksyloaminy , sulfonamidy i indole .
Synteza amin allilowych
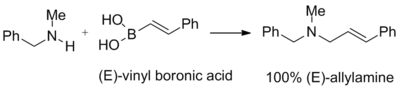
Kwasy winyloborowe reagują z adduktami drugorzędowych amin i paraformaldehydem dając trzeciorzędowe alliloaminy. Geometria podwójnego wiązania wyjściowego kwasu winyloborowego jest zachowana w produkcie końcowym:
Ta reakcja została wykorzystana do syntezy naftyfiny
Synteza aminokwasów
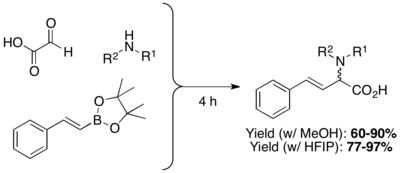
β,γ-nienasycone, N-podstawione aminokwasy są otrzymywane przez kondensację kwasów boronoorganicznych, boronianów lub estrów boronowych z aminami i kwasami glioksalowymi. Wysoce polarne rozpuszczalniki protonowe Heksafluoroizopropanol (HFIP) mogą skrócić czas reakcji i poprawić wydajność.
Oprócz kwasów winyloborowych, w wieloskładnikowym sprzęganiu Petasisa można stosować także kwasy aryloboronowe i inne pochodne heterocykliczne. Możliwy zakres substratów obejmuje grupy tienylowe, pirydylowe, furylowe i benzofuranylowe, 1-naftylowe i arylowe z podstawnikiem elektronodonorowym lub elektronoakceptorowym.
Racemiczny klopidogrel, środek przeciwpłytkowy, zsyntetyzowano w dwóch etapach przy użyciu reakcji Petasis.
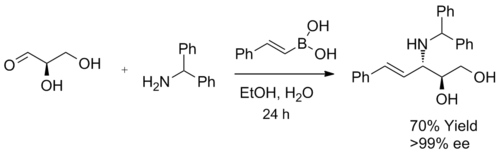
Reakcja Petasisa wykazuje wysoki stopień stereokontroli, gdy jako substrat stosuje się chiralną aminę lub aldehyd. Kiedy pewne chiralne aminy, takie jak (S)-2-fenyloglicynol, miesza się z α-ketokwasem i kwasem winyloborowym w temperaturze pokojowej, odpowiednia alliloamina tworzy się jako pojedynczy diastereoizomer. Ponadto czystość enancjomeryczną można osiągnąć przez uwodornienie diastereoselektywnego produktu.
Niekonwencjonalna synteza kwasów karboksylowych
Oprócz aminokwasów, reakcja PBM może być również wykorzystana do otrzymywania kwasów karboksylowych, aczkolwiek z niekonwencjonalnymi mechanizmami. W przypadku N -podstawionych indoli jako równoważników aminowych reakcja rozpoczyna się od ataku nukleofilowego pozycji 3 „N”-podstawionego indolu do aldehydu elektrofilowego, po którym następuje utworzenie „ate complex” 1 poprzez reakcję kwasu boronowego z kwasem karboksylowym. Następnie produkt pośredni ulega odwodnieniu, po czym następuje migracja grupy boronowo-alkilowej w celu dostarczenia końcowego kwasu karboksylowego. Szeroka gama kwasów aryloboronowych jest tolerowana, natomiast nie odnotowano stosowania kwasów winyloborowych. „N”-niepodstawione indole reagują bardzo wolno w normalnych warunkach reakcji, potwierdzając w ten sposób poniższy mechanizm.
Trzeciorzędowe aminy aromatyczne mogą być stosowane w reakcji Petasisa jako kolejny równoważnik nukleofilu aminowego. Mechanizm jest podobny do przypadku N-podstawionego indolu. Reakcję prowadzi się w trudnych warunkach (24 godziny w temperaturze wrzenia pod chłodnicą zwrotną w 1,4-dioksanie), ale otrzymany kwas karboksylowy otrzymuje się z rozsądną wydajnością. Stosowanie α-ketokwasów zamiast kwasu glioksalowego nie zmniejsza plonów. Zamiast trzeciorzędowych amin aromatycznych można również stosować pochodne 1,3,5-trioksygenowanego benzenu.
Synteza pochodnych kwasu iminodikarboksylowego
Aminokwasy stosowane jako nukleofile azotowe mogą dostarczać różnych pochodnych kwasu iminodikarboksylowego. Zwykle obserwuje się wysoką diastereoselektywność, a nowo utworzone centrum stereo zwykle ma tę samą konfigurację co wyjściowy aminokwas. Reakcja ta przebiega dobrze w silnie polarnych rozpuszczalnikach (np. wodzie, etanolu itp.). Peptydy z niezabezpieczonym końcowym atomem azotu można również stosować jako azotowy równoważnik nukleofilowy. Petasis i współpracownicy przygotowali tą metodą Enalaprilat, inhibitor ACE.
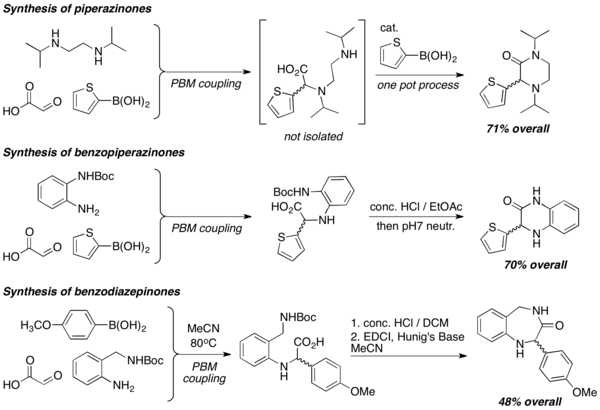
Synteza heterocykli peptydomimetycznych
Gdy w reakcjach PBM stosuje się diaminy, wydajnie wytwarza się heterocykle o różnych strukturach, takie jak piperazynon, benzopiperazynon i benzodiazepinony. Reakcje laktamizacji są powszechnie stosowane do tworzenia heterocykli, zwykle w warunkach silnie kwaśnych.
Synteza aminoalkoholi
Gdy α-hydroksyaldehyd jest stosowany jako substrat w syntezie β-aminoalkoholi, powstaje pojedynczy diastereoizomer. Ta reakcja tworzy wyłącznie antyprodukt, co potwierdza 1H NMR. Produkt nie ulega racemizacji, a przy zastosowaniu enancjomerycznie czystych α-hydroksyaldehydów można uzyskać nadmiar enancjomeryczny. Uważa się, że kwas boronowy najpierw reagował z chiralną grupą hydroksylową, dostarczając nukleofilowy boronian alkenylu, po czym nastąpiła selektywna względem twarzy, wewnątrzcząsteczkowa migracja grupy alkenylowej do elektrofilowego węgla iminiowego, tworząc nieodwracalnie pożądane wiązanie CC.
Diastereoselektywność może wynikać z reakcji bardziej stabilnej (i w tym przypadku bardziej reaktywnej) konformacji kompleksu ate, gdzie szczep allilowy 1,3 jest zminimalizowany.
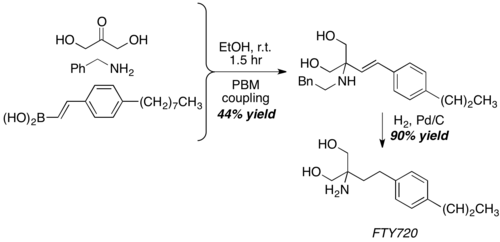
Z dihydroksyacetonem, nieco niekonwencjonalnym odpowiednikiem aldehydu, reakcja Petasis daje strukturę rdzenia FTY720, silnego środka immunosupresyjnego.
Synteza aminopolioli i aminocukrów
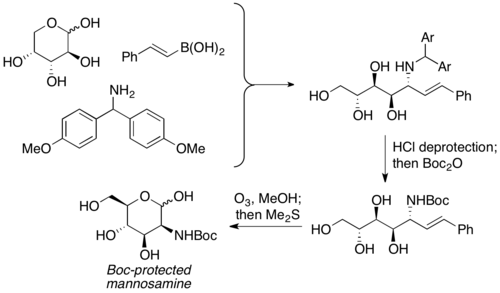
Petasis i współpracownicy zgłosili użycie niezabezpieczonych węglowodanów jako składnika karbonylowego w reakcjach PBM. Jest stosowany jako odpowiednik aldehydów α-hydroksylowych z istniejącą wcześniej chiralnością, a produkt aminopoliolowy jest zwykle dostarczany z wydajnością od umiarkowanej do dobrej, z doskonałą selektywnością. Szeroka gama węglowodanów, jak również azotowych nukleofili (np. aminokwasów), może być stosowana do dostarczania produktów o wysokim stopniu stereochemii. Produkty aminopoliolowe można następnie poddać dalszym reakcjom w celu przygotowania aminocukrów. Petasis wykorzystał tę reakcję do przygotowania mannozaminy zabezpieczonej Boc z D-arabinozy.
Zastosowania w syntezie enancjoselektywnej
Z chiralnym nukleofilem aminowym
Ogólnie rzecz biorąc, gdy chiralna amina jest stosowana w sprzęganiu Petasisa, stereochemiczny wynik reakcji Petasisa jest silnie skorelowany z chiralnością aminy, a diastereoselektywność od wysokiej do doskonałej obserwuje się nawet bez użycia dużych chiralnych grup indukujących. Wykazano, że chiralne benzyloaminy, 2-podstawione pirolidyny i 5-podstawione 2-morfolinony indukują dobry lub doskonały nadmiar diastereoizomeryczny w różnych warunkach reakcji Petasisa.
Z chiralnymi jonami N-acyliminiowymi
Chiralne „materiały wyjściowe” jonów N-acyliminowych są na ogół przygotowywane przez odwodnienie in situ cyklicznego hemiaminalu. Niosą również chiralną grupę hydroksylową, która znajduje się w pobliżu węgla iminiowego; kwasy boronowe reagują z takimi chiralnymi grupami hydroksylowymi, tworząc chiralne i bogate w elektrony formy boronianowe, po czym następuje boronowo-selektywny i wewnątrzcząsteczkowy transfer winylowo-arylowy do węgla iminiowego. W związku z tym reakcja jest wysoce diastereoselektywna, a dominującym szlakiem jest przeniesienie cis-boronianu arylu/winylu. Wykazano, że hydroksypirolidyny oraz hydroksy-γ- i δ-laktamy reagują bardzo diastereoselektywnie, z dobrą lub doskonałą wydajnością. Jednak takie procedury są ograniczone do stosowania wyłącznie kwasów aryloboronowych bogatych w winyl lub elektrony.
(±)-6-Deoksykastanosperminę przygotowano w 7 etapach z estru winylowo-borowego. Kluczowy acykliczny prekursor dezoksykastanosperminy (A) powstaje najpierw przez kondensację estru winyloborowego 1 z Cbz-zabezpieczoną hydroksypirolidyną 2 ze sprzęganiem PBM, a następnie przez dihydroksylację i zabezpieczenie TBS. A następnie przechodzi wewnątrzcząsteczkową cyklizację poprzez kontynuację tworzenia i redukcji w jednym naczyniu, po której następuje odbezpieczenie TBS, z wytworzeniem (±) -6-deoksykastanosperminy.
Z katalizatorem tiomocznikowym
Enancjoselektywna reakcja typu Petasis przekształca chinoliny w odpowiednie chiralne 1,2-dihydrochinoliny (produkt) przy użyciu kwasów alkenyloboronowych i chiralnego tiomocznika jako katalizatora:
Chloromrówczany są wymagane jako elektrofilowe środki aktywujące. Ponadto, aby reakcja przebiegała stereoselektywnie, na katalizatorze wymagana jest grupa funkcyjna 1,2-aminoalkoholu.
Z chiralnymi bifenolami
Chiralne α-aminokwasy o różnych funkcjach są dogodnie dostarczane przez zmieszanie alkenylo-dietyloboranów, drugorzędowych amin, glioksylanów i chiralnego katalizatora bifenolowego w toluenie w jednym naczyniu:
Reakcja ta toleruje szeroki zakres funkcyjności, zarówno po bokach alkenyloboranów, jak i aminy drugorzędowej: bogactwo elektronów substratów nie wpływa na wydajność i enancjoselektywność, a sterycznie wymagające substraty (dialkilopodstawione alkenyloboroniany i aminy z α-stereocentrum ) tylko nieznacznie obniżają enancjoselektywność. Wskaźniki reakcji różnią się w zależności od przypadku.
W opisanych warunkach substraty kwasu boronowego nie dały żadnej enancjoselektywności. W układzie reakcyjnym zastosowano również sito molekularne 3Å. Chociaż autorzy nie podali powodu takiego zastosowania w artykule, spekulowano, że sita molekularne 3Å działają jako wychwytywacze wody i zapobiegają rozkładowi alkenylo-dietyloboranów do odpowiednich kwasów boronowych. Katalizator można zawrócić z reakcji i ponownie użyć bez uszczerbku dla wydajności lub enancjoselektywności.
Niedawno Yuan wraz ze współpracownikami z Chengdu Institute of Organic Chemistry, Chinese Academy of Science połączył oba podejścia (chiralny katalizator tiomocznikowy i chiralny bifenol) w jednym katalizatorze, zgłaszając po raz pierwszy system katalityczny, który jest w stanie przeprowadzić enancjoselektywną reakcję Petasis między aldehydy salicylowe, cykliczne aminy drugorzędowe i kwasy arylo- lub alkenyloboronowe:
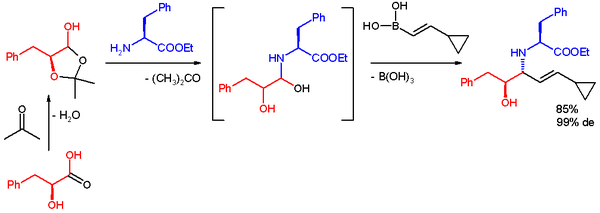
W jednym zastosowaniu reakcja Petasisa jest wykorzystywana do szybkiego dostępu do wielofunkcyjnego rusztowania dla rozbieżnej syntezy . Reagentami są laktol pochodzący z kwasu L-fenylo-mlekowego i acetonu , ester metylowy l-fenyloalaniny i kwas boronowy . Reakcja zachodzi w etanolu w temperaturze pokojowej, dając produkt, anty-1,2-aminoalkohol z dużym nadmiarem diastereoizomerów .
Należy zauważyć, że autorzy nie mogą ocenić syn-1,2-aminoalkoholu tą metodą ze względu na wewnętrzną selektywność mechanistyczną, a autorzy argumentują, że taka wewnętrzna selektywność utrudnia im dostęp do pełnej matrycy produktów stereoizomerycznych do wykorzystania w badaniach przesiewowych małych cząsteczek. W niedawnym raporcie Schaus i współpracownicy poinformowali, że synaminoalkohol można otrzymać w następujących warunkach reakcji, stosując chiralny dibromo-bifenol jako katalizator opracowany przez ich grupę:
Chociaż stosunek diastereoizomerów syn do anty waha się od przeciętnego do dobrego (1,5: 1 do 7,5: 1), zakres substratów dla takich reakcji pozostaje raczej ograniczony, a diastereoselektywność zależy od centrum stereogenicznego na aminowym materiale wyjściowym .
Reakcja Petasisa i synteza całkowita
Beau i współpracownicy zmontowali rdzeń szkieletu dihydropiranu kongenerów zanamiviru poprzez połączenie reakcji PBM i sekwencji odbezpieczania-cyklizacji promowanej przez żelazo (III). Stereochemicznie zdefiniowany α-hydroksyaldehyd 2, dialliloamina i kwas boronowy 1 zabezpieczony dimetyloketalem są sprzęgane, tworząc acykliczny, stereochemicznie zdefiniowany aminoalkohol 3, który następnie ulega cyklizacji promowanej żelazem (III), tworząc bicykliczny dihydropiran 4. Selektywny otwarcie części oksazolinowej półproduktu dihydropiranowego 4 wodą lub azydkiem timetylosililu, a następnie dostarczenie dalszych produktów, które mają struktury przypominające członków rodziny Zanamivir.
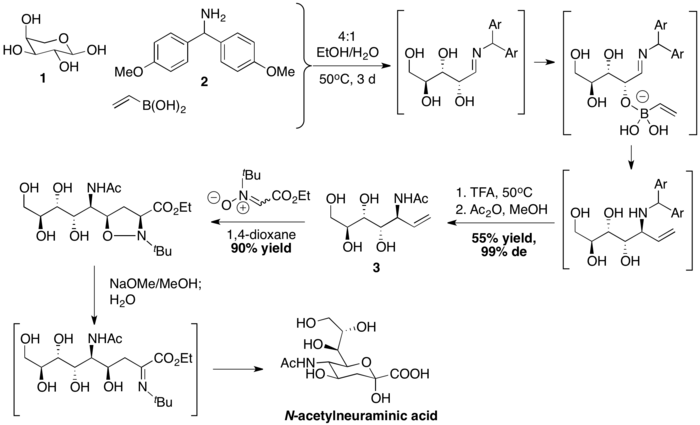
Wong i współpracownicy przygotowali kwas N-acetyloneuraminowy ze sprzęganiem PBM, a następnie cykloaddycją nitronu-[3+2]. Kwas winyloborowy jest najpierw sprzęgany z L-arabinozą 1 i bis (4-metoksyfenylo) metanoaminą 2, tworząc stereochemicznie zdefiniowaną alliloaminę 3. Następnie sekwencja cykloaddycji dipolarnej, rozpadu wiązań N – O za pośrednictwem zasady i hydrolizy kończy syntezę kwasu N-acetyloneuraminowego.












![Deoxycastanospermine synthesis.[30]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Deoxycastanospermine_synthesis.png/600px-Deoxycastanospermine_synthesis.png)