Spektrometria mas jonów wtórnych w nanoskali
NanoSIMS (nanoskalowa spektrometria masowa jonów wtórnych ) to przyrząd analityczny wyprodukowany przez firmę CAMECA , który działa na zasadzie spektrometrii masowej jonów wtórnych . NanoSIMS służy do uzyskiwania pomiarów składu pierwiastkowego i izotopowego próbki w nanoskali. NanoSIMS jest w stanie tworzyć nanoskalowe mapy rozkładu pierwiastków lub izotopów, równoległą akwizycję do siedmiu mas, identyfikację izotopową , wysoką rozdzielczość masy, czułość części na milion z rozdzielczością przestrzenną do 50 nm.
Oryginalny projekt instrumentu NanoSIMS został opracowany przez Georgesa Slodziana z University of Paris Sud we Francji . Obecnie na świecie jest około 50 instrumentów NanoSIMS.
Jak to działa
NanoSIMS wykorzystuje źródło jonów do wytwarzania pierwotnej wiązki jonów. Te pierwotne jony niszczą powierzchnię próbki i powodują zderzenia atomów, niektóre z tych zderzeń powodują uwolnienie cząstek jonów wtórnych. Jony te są transmitowane przez spektrometr masowy, w którym mierzy się i identyfikuje masy. Pierwotna wiązka jonów jest rastrowana na powierzchni próbki, a „mapa” pierwiastka i rozkładu izotopów jest tworzona przez zliczanie liczby jonów pochodzących z każdego piksela z rozdzielczością co najwyżej 50 nanometrów (nm), 10-50 razy większą niż konwencjonalne karty SIM. Osiąga się to poprzez umieszczenie sondy głównej w bliskiej odległości od próbki za pomocą współosiowego zespołu soczewek. Wiązka jonów pierwotnych uderza w powierzchnię próbki pod kątem 90°, a jony wtórne są usuwane z powrotem przez ten sam zespół soczewek. Pozwala to na rozróżnienie składu izotopowego poszczególnych komórek w zakresie części na milion (ppm) lub części na miliard (ppb). Główną wadą tego układu jest to, że pierwotna i wtórna wiązka jonów muszą mieć przeciwną polaryzację, co może ograniczać elementy, które można wykryć jednocześnie.
NanoSIMS może wykryć niewielkie różnice masy między jonami z rozdzielczością M/dM > 5000, gdzie M to nominalna masa izotopu, a dM to różnica masy między interesującymi nas izotopami. Możliwości NanoSIMS w zakresie wysokiej rozdzielczości masowej umożliwiają identyfikację i mapowanie przestrzenne różnych pierwiastków i ich izotopów w próbce, nawet jeśli ich masa jest bardzo zbliżona. Spektrometr masowy jest zdolny do wielokrotnego zbierania, co oznacza, że można wykryć jednocześnie do 5 (NanoSIMS 50) lub 7 (NanoSIMS 50 L) mas, od wodoru do uranu, choć z ograniczeniami. Stosunkowo duża liczba odważników pomaga wyeliminować błędy pomiarowe, ponieważ unika się ewentualnych zmian stanu przyrządu lub próbki, które mogą wystąpić pomiędzy seriami.
Wiązkę jonów należy ustawić tak, aby wykrywała jony ujemne lub dodatnie, co zwykle uzupełnia się odpowiednio wiązką cezu+ lub tlenu. Osiągalna wysoka rozdzielczość masowa jest szczególnie istotna w zastosowaniach biologicznych. Na przykład azot jest jednym z najbardziej powszechnych pierwiastków w organizmach. Jednak ze względu na niskie powinowactwo elektronowe atomu azotu produkcja jonów wtórnych jest rzadka. Zamiast tego można generować i mierzyć cząsteczki takie jak CN. Jednak ze względu na kombinacje izotopów, takie jak izobary 13 C 14 N- i 12 C 15 Zostaną wygenerowane N-, prawie identyczne masy cząsteczkowe odpowiednio 27 000 i 27 006 daltonów. W przeciwieństwie do innych technik obrazowania, gdzie 13 C 14 N i 12 C 15 N nie mogą być mierzone niezależnie z powodu prawie identycznych mas, NanoSIMS może bezpiecznie rozróżnić różnice między tymi cząsteczkami, umożliwiając przeprowadzenie eksperymentów z izotopami.
Fizyka NanoSIMS
Spektrometr masowy z sektorem magnetycznym powoduje fizyczne rozdzielenie jonów o różnym stosunku masy do ładunku . Fizyczna separacja jonów wtórnych jest spowodowana siłą Lorentza , gdy jony przechodzą przez pole magnetyczne, które jest prostopadłe do wektora prędkości jonów wtórnych. Siła Lorentza mówi, że na cząstkę działa siła
gdy utrzymuje ładunek q i porusza się przez pole elektryczne E i pole magnetyczne B z prędkością v . Jony wtórne, które opuszczają powierzchnię próbki, zazwyczaj mają energię kinetyczną rzędu kilku elektronowoltów (eV), chociaż stwierdzono, że raczej niewielka ich część ma energię rzędu kilku keV. Pole elektrostatyczne wychwytuje jony wtórne, które opuszczają powierzchnię próbki; te wyekstrahowane jony są następnie przenoszone do spektrometru masowego. W celu uzyskania precyzyjnego izotopu pomiarów, istnieje potrzeba wysokiej transmisji i dużej rozdzielczości masowej . Wysoka transmisja odnosi się do niskiej utraty jonów wtórnych między powierzchnią próbki a detektorem, a wysoka rozdzielczość masowa odnosi się do zdolności skutecznego oddzielania jonów wtórnych (lub cząsteczek będących przedmiotem zainteresowania) od innych jonów i/lub jonów o podobnej masie. Jony pierwotne zderzają się z powierzchnią z określoną częstotliwością na jednostkę powierzchni. Zderzenie, które ma miejsce, powoduje rozpylanie atomów z powierzchni próbki, z których tylko niewielka ilość ulegnie jonizacji. Stają się one jonami wtórnymi, które są następnie wykrywane po przejściu przez spektrometr mas. Każdy jon pierwotny generuje pewną liczbę jonów wtórnych izotopu, które dotrą do detektora w celu zliczenia. The szybkość zliczania jest określana przez
gdzie I ( i M) jest szybkością zliczania izotopu i M pierwiastka M . Szybkość zliczania izotopu zależy od stężenia X M i obfitości izotopowej pierwiastka , oznaczanej A i . Ponieważ pierwotna wiązka jonów określa jony wtórne, Y , które są rozpylane, gęstość pierwotnej wiązki jonów, d b , która jest zdefiniowana jako ilość jonów na sekundę na jednostkę pola powierzchni, wpłynie na część pola powierzchni próbki, S , przy równomiernym rozmieszczeniu jonów pierwotnych. Spośród rozpylonych jonów wtórnych tylko część ulegnie jonizacji, Yi . Prawdopodobieństwo, że dowolny jon zostanie pomyślnie przeniesiony ze spektrometru mas do detektora wynosi T . Iloczyn Y i i T określa ilość izotopów, które zostaną zjonizowane, a także wykryte, dlatego uważa się je za użyteczną wydajność.
Przygotowanie próbki
Przygotowanie próbki jest jednym z najważniejszych etapów analizy NanoSIMS, szczególnie w przypadku analizy próbek biologicznych. Należy opracować specjalne protokoły dla poszczególnych eksperymentów, aby jak najlepiej zachować nie tylko strukturę próbki, ale także rzeczywisty rozkład przestrzenny i obfitość cząsteczek w próbce. Ponieważ NanoSIMS działa w ultrawysokiej próżni , próbka musi być kompatybilna z próżnią (tj. nie zawiera substancji lotnych), płaska, co zmniejsza zmienne trajektorie jonizacji, oraz przewodząca, co można uzyskać przez napylanie katodowe Au , Pt lub C . Próbki biologiczne, takie jak komórki lub tkanki, można przygotować za pomocą utrwalania chemicznego lub kriofiksacji i zatapiania w żywicy przed pocięciem na cienkie plasterki (100 nm - 1 μm) i umieszczeniem na płytkach krzemowych lub szkiełkach do analizy. Przygotowanie próbki do próbek metalograficznych jest na ogół znacznie prostsze, ale do uzyskania płaskiej, wolnej od zadrapań powierzchni wymagane jest bardzo dobre wypolerowanie metalograficzne .
Aplikacje
NanoSIMS może uchwycić przestrzenną zmienność pomiarów izotopowych i elementarnych obszarów submikronowych, ziaren lub inkluzji z próbek geologicznych, materiałoznawczych i biologicznych. Instrument ten może charakteryzować materiały nanostrukturalne o złożonym składzie, które są coraz ważniejszymi kandydatami do wytwarzania i magazynowania energii.
Zastosowania geologiczne
NanoSIMS okazał się również przydatny w badaniu zagadnień kosmochemicznych , gdzie można analizować próbki pojedynczych ziaren o wielkości mikro lub submikrometra z meteorytów, a także skrawki mikrotomu przygotowane techniką zogniskowanej wiązki jonów (FIB). NanoSIMS można łączyć z transmisyjną mikroskopią elektronową (TEM) przy użyciu skrawków mikrotomu lub FIB. Ta kombinacja pozwala na skorelowane badania mineralogiczne i izotopowe in situ w skali poniżej mikrometra.
Jest szczególnie przydatny w badaniach materiałowych ze względu na swoją wysoką czułość przy wysokiej rozdzielczości masowej, która pozwala na obrazowanie pierwiastków śladowych i oznaczanie ilościowe.
Zastosowania biologiczne
Początkowo opracowany do badań geochemicznych i pokrewnych, NanoSIMS jest obecnie wykorzystywany w wielu różnych dziedzinach, w tym w biologii i mikrobiologii. W badaniach biomedycznych NanoSIMS jest również określany jako spektrometria mas z obrazowaniem wieloizotopowym (MIMS). Rozdzielczość 50 nm umożliwia bezprecedensową rozdzielczość cech komórkowych i subkomórkowych (dla odniesienia, organizm modelowy E. coli ma zazwyczaj średnicę od 1000 do 2000 nm). Wysoka rozdzielczość, którą oferuje, pozwala na wewnątrzkomórkowe pomiar akumulacji i strumieni cząsteczek zawierających różne stabilne izotopy. NanoSIMS można używać do czystych kultur, wspólnych kultur i mieszanych próbek społeczności.
Po raz pierwszy NanoSIMS w biologii zastosowali Peteranderl i Lechene w 2004 roku, którzy wykorzystali prototyp NanoSIMS do badania i pomiaru izotopów węgla i azotu w komórkach eukariotycznych. W badaniu tym po raz pierwszy zmierzono bezpośrednio stosunki izotopów węgla i azotu w skali subkomórkowej w próbce biologicznej.
Zastosowania materiałoznawcze
NanoSIMS był używany w wielu różnych obszarach inżynierii materiałowej. Jest w stanie mapować wodór i deuter w mikrostrukturalnie odpowiednich skalach, co jest ważne dla badań kruchości wodorowej metali, chociaż istnieją poważne wyzwania związane z dokładnym wykrywaniem wodoru i deuteru.
Metody często łączone z NanoSIMS
Mikroskopia
Inne techniki mikroskopii są powszechnie stosowane w połączeniu z NanoSIMS, które umożliwiają uzyskanie wielu rodzajów informacji, takich jak informacje taksonomiczne poprzez fluorescencyjną hybrydyzację in situ (FISH) lub identyfikację dodatkowych cech fizjologicznych lub mikrostrukturalnych za pomocą transmisyjnej mikroskopii elektronowej (TEM) lub skanowania mikroskopia elektronowa (SEM).
Znakowanie immunogoldem
Tradycyjne metody stosowane do znakowania i identyfikowania cech subkomórkowych komórek, takie jak znakowanie immunogoldem, mogą być również stosowane w analizie NanoSIMS. Znakowanie immunogoldem wykorzystuje przeciwciała do namierzania określonych białek, a następnie znakuje przeciwciała nanocząstkami złota. Instrument NanoSIMS może wykrywać cząsteczki złota, dostarczając lokalizację znakowanych białek w wysokiej rozdzielczości. Związki zawierające złoto lub platynę stosowane jako leki przeciwnowotworowe obrazowano za pomocą NanoSIMS w celu zbadania dystrybucji subkomórkowej odpowiednio w komórkach raka piersi i raka okrężnicy. W oddzielnym badaniu badano wiązanie przeciwciało-antygen bez potrzeby dodawania znacznika fluorescencyjnego do przeciwciała, co umożliwiło lokalizację bez znaczników i analizę ilościową w wysokiej rozdzielczości.
Trwałe znakowanie izotopowe
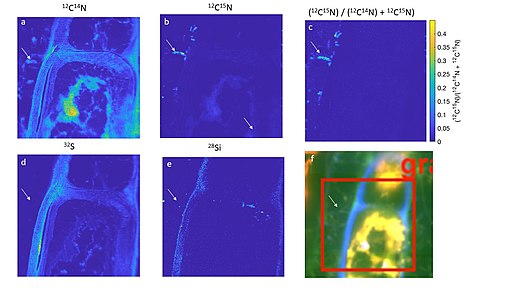
Inną powszechną techniką zwykle stosowaną w analizie NanoSIMS jest sondowanie stabilnych izotopów. Metoda ta polega na wprowadzeniu stabilnych, znakowanych izotopowo związków biologicznie istotnych do organizmów w celu spożycia i integracji z materią organiczną. W przypadku analizy za pomocą NanoSIMS technika ta jest określana jako nanoSIP. NanoSIMS można wykorzystać do wykrywania, które organizmy włączyły które cząsteczki, ile znakowanych cząsteczek zostało włączonych w sposób półilościowy i gdzie w komórce nastąpiło włączenie. Poprzednie techniki analizy ilościowej w rozdzielczości niższej niż NanoSIMS stabilnych cząsteczek znakowanych izotopowo były ograniczone do analizowanego materiału masowego, co nie pozwalało na wgląd w wkład poszczególnych komórek lub przedziałów subkomórkowych. Ponadto usunięcie dużych obcych cząsteczek (takich jak przeciwciała lub cząsteczki złota) z układu eksperymentalnego zmniejsza obawy, że znakowane cząsteczki wymagane w innych technikach mikroskopii mogą mieć inne reakcje biochemiczne lub właściwości niż normalnie.
Technikę tę można wykorzystać do badania wymiany składników odżywczych. Zbadano mikrobiom jelita myszy, aby określić, które drobnoustroje żywią się związkami pochodzącymi od żywiciela. W tym celu myszom podawano pokarm wzbogacony stabilnymi aminokwasami znakowanymi izotopowo i badano biomasę drobnoustrojów. NanoSIMS umożliwia zbadanie wkładu metabolicznego poszczególnych drobnoustrojów. NanoSIMS został wykorzystany do zbadania i udowodnienia po raz pierwszy zdolności bakterii i archeonów z głębin oceanu do wiązania azotu poprzez dostarczenie 15 N azot zawiera związki do sedymentacji próbek. NanoSIMS można również wykorzystać do oszacowania tempa wzrostu organizmów, ponieważ ilość węgla lub innego substratu zgromadzonego wewnątrz komórki pozwala oszacować, ile biomasy jest generowane.
Pomiar naturalnej obfitości izotopów w organizmach
Materiał organiczny naturalnie zawiera stabilne izotopy w różnych proporcjach w środowisku, co może dostarczyć informacji o pochodzeniu źródła pożywienia dla organizmów. Różne rodzaje materiału organicznego źródeł pożywienia mają różne ilości stabilnych izotopów, co znajduje odzwierciedlenie w składzie organizmu spożywającego te źródła pożywienia. Ten typ analizy został po raz pierwszy zastosowany w 2001 roku w połączeniu z FISH do zbadania związków syntroficznych między beztlenowymi archeonami utleniającymi metan a bakteriami redukującymi siarczany. Izotopy o naturalnie małej liczebności mogą nie być w stanie wykryć tą metodą.
Paleobiologia
NanoSIMS można również wykorzystać do badania składu pierwiastkowego i izotopowego mikrocząstek zachowanych w zapisie skalnym. Rodzaje pierwiastków i stosunki izotopowe mogą pomóc określić, czy materiał jest pochodzenia biologicznego. NanoSIMS został po raz pierwszy użyty w tej dziedzinie paleobiologii w 2005 roku przez Roberta i in. W tym badaniu stwierdzono, że mikroskamieniałości zawierają pierwiastki węgla, azotu i siarki ułożone w „kuleczki”, które przypominają ściany komórkowe. Zmierzony stosunek węgla do azotu służył również jako wskaźnik pochodzenia biologicznego, ponieważ skała otaczająca skamieniałości miała bardzo różne stosunki C do N.

![\mathbf {F} =q\left[\mathbf {E} +(\mathbf {v} \times \mathbf {B} )\right]](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0139e901d2aa4f20d3deb80a4e6dd56cd3321a6)
