Syntetyczne genomy
Syntetyczny genom to syntetycznie zbudowany genom, którego tworzenie obejmuje modyfikację genetyczną wcześniej istniejących form życia lub sztuczną syntezę genów w celu stworzenia nowego DNA lub całych form życia. Dziedzina zajmująca się badaniem genomów syntetycznych nazywana jest genomiką syntetyczną .
Technologia rekombinacji DNA
Wkrótce po odkryciu endonukleaz restrykcyjnych i ligaz genetyka zaczęła wykorzystywać te narzędzia molekularne do składania sztucznych sekwencji z mniejszych fragmentów syntetycznego lub naturalnie występującego DNA . Zaleta stosowania podejścia rekombinacyjnego w przeciwieństwie do ciągłej syntezy DNA wynika z odwrotnej zależności istniejącej między syntetyczną długością DNA a procentową czystością tej syntetycznej długości. Innymi słowy, w miarę syntezy dłuższych sekwencji liczba klonów zawierających błędy wzrasta ze względu na nieodłączny poziom błędów obecnych technologii. Chociaż rekombinacji DNA jest coraz powszechniej stosowana w konstrukcji białek fuzyjnych i plazmidów , pojawiło się kilka technik o większych możliwościach, pozwalających na budowę całych genomów.
Zespół cykliczny polimerazy
Zespół cykliczny polimerazy (PCA) wykorzystuje serię oligonukleotydów (lub oligo) o długości około 40 do 60 nukleotydów, które razem tworzą obie nici syntetyzowanego DNA. Te oligonukleotydy są zaprojektowane tak, że pojedynczy oligonukleotyd z jednej nici zawiera długość około 20 nukleotydów na każdym końcu, która jest komplementarna do sekwencji dwóch różnych oligonukleotydów na przeciwległej nici, tworząc w ten sposób regiony nakładania się. Cały zestaw poddaje się cyklom: (a) hybrydyzacji w temperaturze 60°C; (b) wydłużanie przez polimerazę Taq i standardowa ligaza; oraz (c) denaturacja w temperaturze 95 °C, tworząca coraz dłuższe ciągłe nici i ostatecznie prowadząca do ostatecznego genomu. PCA użyto do wygenerowania pierwszego w historii syntetycznego genomu wirusa Phi X 174 .
Metoda montażu Gibsona
Metoda składania Gibsona , zaprojektowana przez Daniela Gibsona podczas jego pracy w Instytucie J. Craiga Ventera , wymaga zestawu dwuniciowych kaset DNA, które składają się na cały syntetyzowany genom. Należy zauważyć, że kasety różnią się od kontigów z definicji tym, że te sekwencje zawierają regiony homologii z innymi kasetami do celów rekombinacji . W przeciwieństwie do Polymerase Cycling Assembly, Gibson Assembly jest jednoetapową, izotermiczną reakcją o większej pojemności sekwencji; ergo, jest używany zamiast Polymerase Cycling Assembly dla genomów większych niż 6 kb.
Egzonukleaza T5 przeprowadza reakcję przeżuwania na segmentach końcowych, działając w kierunku od 5' do 3', tworząc w ten sposób komplementarne nawisy. Nawisy hybrydyzują ze sobą, polimeraza DNA Phusion uzupełnia brakujące nukleotydy, a nacięcia są uszczelniane ligazą. Jednak genomy, które można zsyntetyzować przy użyciu samej tej metody, są ograniczone, ponieważ wraz ze wzrostem długości kaset DNA wymagają one namnażania in vitro, aby kontynuować hybrydyzację; w związku z tym montaż Gibsona jest często używany w połączeniu z rekombinacją związaną z transformacją (patrz poniżej) do syntezy genomów o wielkości kilkuset kilozasad.
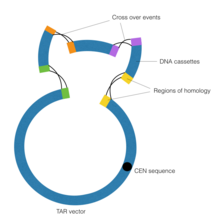
Rekombinacja związana z transformacją

Celem technologii rekombinacji związanej z transformacją (TAR) w genomice syntetycznej jest łączenie kontigów DNA za pomocą rekombinacji homologicznej przeprowadzanej przez sztuczny chromosom drożdżowy (YAC). Ważny jest element CEN w wektorze YAC , który odpowiada centromerowi drożdży. Sekwencja ta daje wektorowi zdolność zachowywania się w sposób chromosomalny, umożliwiając w ten sposób przeprowadzenie rekombinacji homologicznej .
Najpierw przeprowadza się klonowanie z naprawą przerw w celu wygenerowania regionów homologii flankujących kontigi DNA. Klonowanie z naprawą przerw to szczególna forma reakcji łańcuchowej polimerazy , w której wykorzystywane są wyspecjalizowane startery z przedłużeniami poza sekwencję docelowego DNA. Następnie kasety DNA są wystawiane na działanie wektora YAC, który napędza proces rekombinacji homologicznej, łącząc w ten sposób kasety DNA. Polymerase Cycling Assembly i technologia TAR zostały użyte razem do skonstruowania 600 kb Mycoplasma genitalium genom w 2008 roku, pierwszy syntetyczny organizm, jaki kiedykolwiek stworzono. Podobne kroki podjęto przy syntezie większego Mycoplasma mycoides kilka lat później.
Ogólne tworzenie syntetycznych genomów
Trudno jest bezpośrednio zsyntetyzować oligonukleotydy większe niż ~ 200 par zasad i zachować wysoką wierność. Dlatego mniejsze oligonukleotydy (około 5-20 par zasad) są łączone w celu utworzenia oligonukleotydów wielkości genomu. Poprzednie metody zszywania mniejszych nici obejmowały użycie ligazy polinukleotydowej T4. Nowoczesne techniki, takie jak metody oparte na PCA/ PCR , poprawiły tę metodę, zwiększając szybkość i wierność. Aby jeszcze bardziej zwiększyć wierność, metody oparte na PCA mogą obejmować etap odwracania błędów, w którym nukleazy rozpoznawać i wycinać niedopasowane pary zasad. Rozpoznanie jest możliwe, ponieważ błędy zwykle powodują ruchy strukturalne i nieprawidłowości w DNA. E. coli o wielkości 4 Mb utworzony w maju 2019 r. jest rekordzistą pod względem wielkości syntetycznego genomu.