TLTx
Toksyna Theraphosa leblondi ( TLTx ) to toksyna występująca w trzech różnych formach (podtypach), które są oczyszczane i sekwencjonowane z jadu tarantuli olbrzymiej Theraphosa blondi . Ta toksyna selektywnie hamuje kanały potasowe bramkowane napięciem Kv4.2, działając jako modyfikator bramkowania.
Źródła
Toksyna jest składnikiem jadu ptakożernego pająka Goliata Theraphosa leblondi .
Chemia
TLTx należy do rodziny toksyn tarantuli specyficznych dla Kv4, które są krótkimi peptydami z domeną rdzeniową związaną wiązaniami dwusiarczkowymi. Innymi członkami tej rodziny są heteropodatoksyny i friksotoksyny .
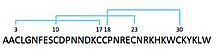
Z jadu tarantuli wyizolowano trzy homologiczne peptydy (TLTx1, 2 i 3). Składają się z 35 aminokwasów o masie <5 kDa. Tworzą łącznie 3 wiązania dwusiarczkowe między łańcuchami bocznymi cysteiny, których pozycje w sekwencji są identyczne we wszystkich podtypach toksyny. Homologia z innymi toksynami tarantuli sugeruje, że TLTx tworzy również węzła cystynowego (ICK).
Cel
Główną różnicą między trzema podtypami TLTx jest ich powinowactwo do zależnego od napięcia kanału potasowego Kv4.2. TLTx1 ma najwyższe powinowactwo z IC50 193 nM, a następnie TLTx2 z IC50 około 800 nM. Dla TLTx3 nie zmierzono IC50.
Sposób działania
TLTx1 działa jako modyfikator bramkowania na kanałach Kv4.2. TLTx1 przesuwa napięciową zależność aktywacji kanałów Kv4.2 na bardziej dodatnie potencjały, spowalnia jego aktywację i przyspiesza kinetykę dezaktywacji. Dodatkowo TLTx zmniejsza szybkość ich inaktywacji. Miejscem wiązania, z którym najprawdopodobniej oddziałuje TLTx, jest region łącznikowy między segmentami transbłonowymi S3 i S4. Ponadto pewną rolę mogą odgrywać pętle S1-S2 i S5-S6.
Toksyczność
Blokując przejściowe kanały potasowe Kv4.2, TLTx może zakłócać repolaryzację potencjału czynnościowego, prowadząc do paraliżu ofiary. [ źródło opublikowane samodzielnie? ] Nie zgłoszono żadnych śmiertelnych epizodów u ludzi, co sugeruje, że ilość i stężenie TLTx w jadzie jest zbyt niskie, aby mogło być bardzo szkodliwe dla ludzi.