Tropizm komórek śródbłonka
Tropizm komórek śródbłonka lub endoteliotropizm to rodzaj tropizmu tkankowego lub tropizmu gospodarza , który charakteryzuje zdolność patogenu do rozpoznawania i infekowania komórki śródbłonka. Patogeny, takie jak wirusy, mogą atakować określony typ tkanki lub wiele typów tkanek. Podobnie jak inne komórki, komórka śródbłonka posiada kilka cech, które wspierają produktywną infekcję wirusową, w tym komórkę, receptory na powierzchni komórki , odpowiedzi immunologiczne i inne czynniki wirulencji . Komórki śródbłonka znajdują się w różnych typach tkanek, takich jak naczynia włosowate , żyły i tętnice w ludzkim ciele. Ponieważ komórki śródbłonka wyścielają te naczynia krwionośne i krytyczne sieci, które rozszerzają dostęp do różnych układów narządów ludzkich, wejście wirusa do tych komórek może być szkodliwe dla rozprzestrzeniania się wirusa w układzie gospodarza i wpływać na kliniczny przebieg choroby. Zrozumienie mechanizmów, w jaki wirusy przyczepiają się, wnikają i kontrolują funkcje śródbłonka oraz reakcje gospodarza, dostarcza wiedzy na temat chorób zakaźnych i medycznych środków zaradczych .
Funkcje i mechanizmy komórkowe
Istnieje wiele cech komórek śródbłonka, które wpływają na tropizm komórek i ostatecznie przyczyniają się do aktywacji i dysfunkcji komórek śródbłonka , jak również do kontynuacji cyklu życiowego wirusa .
Receptory powierzchniowe komórki

Patogeny wirusowe wykorzystują wszechobecne receptory na powierzchni komórki, które mogą rozpoznawać wiele różnych ligandów w celu przyłączenia i ostatecznie wejścia do komórki. Ligandy te składają się nie tylko z białek endogennych, ale także z produktów bakteryjnych i wirusowych. Gdy wirus zostanie zakotwiczony na powierzchni komórki, pobieranie wirusa zwykle zachodzi przy użyciu mechanizmów gospodarza, takich jak endocytoza . Jedną z metod wchłaniania wirusa jest endocytoza za pośrednictwem klatryny (CME). Receptory na powierzchni komórki zapewniają kieszonkę wiążącą do przyłączenia i wejścia do komórki, a zatem wpływają na podatność komórki na infekcję. Ponadto gęstość receptorów na powierzchni komórki śródbłonka wpływa również na to, jak skutecznie wirus wnika do komórki gospodarza. Na przykład, mniejsza gęstość receptorów na powierzchni komórki może sprawić, że komórka śródbłonka będzie mniej podatna na zakażenie wirusem niż komórka śródbłonka o większej gęstości receptorów na powierzchni komórki. Śródbłonek zawiera niezliczoną ilość receptorów powierzchniowych komórek związanych z takimi funkcjami, jak przyleganie i transport komórek odpornościowych, krzepnięcie krwi , rozszerzenie naczyń i przepuszczalność bariery. Biorąc pod uwagę te funkcje życiowe, interakcje wirusa z tymi receptorami dają wgląd w objawy występujące podczas patogenezy wirusa , takie jak zapalenie , zwiększona przepuszczalność naczyń i zakrzepica .
Czynniki transkrypcyjne i replikacja wirusa
Po wejściu do komórki te wewnątrzkomórkowe pasożyty wymagają czynników w komórce gospodarza, aby wspierać replikację wirusa i uwalnianie potomnych wirionów. Konkretnie, czynniki gospodarza obejmują białka , takie jak czynniki transkrypcyjne i polimerazy , które pomagają w replikacji genomu wirusa. Dlatego samo wejście do żywego gospodarza niekoniecznie skutkuje namnażaniem potomstwa wirusa, ponieważ komórka może nie zawierać krytycznych czynników transkrypcyjnych lub polimeraz do replikacji wirusa. Ponadto w genomie wirusowym znajdują się nie tylko instrukcje syntezy białek wirusowych, ale także inne czynniki wirulencji, takie jak geny , struktury komórkowe i inne procesy regulacyjne, które umożliwiają patogenowi kontrolowanie odpowiedzi przeciwwirusowych gospodarza. Te czynniki wirulencji mogą przeciwdziałać mechanizmom obronnym gospodarza, które próbują wyeliminować infekcję poprzez układ odpornościowy gospodarza .
Mechanizmy obronne gospodarza
Komórki śródbłonka posiadają również wewnętrzne reakcje przeciwwirusowe, które wykorzystują układ odpornościowy gospodarza do zwalczania infekcji lub ograniczania replikacji wirusa. W odpowiedzi na wytwarzanie wirusa w komórce, komórka gospodarza może uwolnić białko, takie jak interferon cytokinowy (IFN), który będzie sygnalizował odpowiedź immunologiczną. IFN „interferuje” z replikacją wirusa, sygnalizując innym komórkom naszego układu odpornościowego zatrzymanie infekcji. Inne mechanizmy komórkowe są również na różnych poziomach subkomórkowych. W szczególności istnieją receptory rozpoznające wzorce komórkowe, takie jak TLR7 i TLR8 (wykrywające RNA) oraz TLR9 (wykrywające DNA). Te podobne do opłat receptory , które potrafią rozróżnić, czy w komórce gospodarza znajdują się wirusowe kwasy nukleinowe, i podobnie, wywołają odpowiedź immunologiczną, aby oznaczyć komórkę i podjąć próbę wyeliminowania patogenu. Połączenie tych mechanizmów, które wspierają pomyślne wejście wirusa, replikację wirusa i blokowanie odpowiedzi immunologicznej gospodarza, przyczynia się do produktywnej infekcji wirusowej i replikacji.
Przykłady i wpływ na patogenezę wirusową
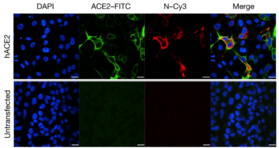
SARS-CoV-2 jest wirusem, który powoduje chorobę COVID-19 i infekuje różne typy komórek, ale wykazuje również zajęcie naczyń wielonarządowych. W ciężkich przypadkach SARS-CoV-2 może powodować dysfunkcję lub uszkodzenie śródbłonka. Ta wywołana wirusem reakcja śródbłonka może prowadzić do zakrzepicy, przekrwienia i mikroangiopatii . Receptory na powierzchni komórki związane z wejściem wirusa obejmują ACE2 i współreceptor TMPRSS2 . TMPRSS2 jest potrzebny do rozszczepienia białka kolca w celu fuzji wirusa z błoną komórkową. Jednak ostatnie badanie wykazało, że niska ekspresja ACE2 w komórkach śródbłonka była związana ze słabą zdolnością do namnażania wirusa z powodu braku punktów wejścia na powierzchni komórki.
Flawiwirusy
Denga jest przykładem flawiwirusa przenoszonego przez komary , który powoduje gorączkę denga . Chociaż komórki śródbłonka nie są głównymi celami komórek dengi, wirus wiąże się z różnymi receptorami na powierzchni komórek na komórkach śródbłonka ze szczególnym zakażeniem produktywnym poprzez receptory powierzchniowe zawierające siarczan heparanu . Wykazano, że infekcja śródbłonka przez te receptory upośledza krytyczne odpowiedzi immunologiczne i zmienia przepuszczalność naczyń włosowatych, co z kolei wspiera przebieg kliniczny choroby.
filowirusy
Ebola to jeden wirus gorączki krwotocznej, który powoduje chorobę wirusową Ebola (EVD) . Analiza próbek ludzkich osób, które nie przeżyły choroby, wykazała, że śródbłonek jest znacznie zmieniony w stosunku do stanu zdrowego. Inne zmiany homeostazy obejmują powszechną ekspresję antygenów wirusowych w komórkach śródbłonka. Wykazano, że glikoproteina wirusa , która służy jako „klucz” wirusa do komórki, powoduje poważne uszkodzenia śródbłonka. Na przykład wątroba jest wysoce zaangażowana jako obszar uszkodzeń po infekcji. Komórki śródbłonka sinusoidalnego wątroby (LSEC) wykazują ekspresję różnych receptorów zmiatających , w tym FcγRIIb2 i receptor mannozy , które są krytyczne w usuwaniu cząsteczek odpadów w wątrobie, ale także pochłaniają ligandy poprzez szlak CME. Oprócz wspomagania wnikania wirusa, interakcje z tymi receptorami mogą również utrudniać klirens leków podawanych w celu złagodzenia infekcji.
Orthomyxoviridae
Grypa A H1N1 jest podtypem wirusa grypy , który atakuje i infekuje komórki śródbłonka układu oddechowego, na przykład w płucach. Wirus może również atakować nabłonek błon śluzowych tych układów narządów. Cząsteczki wirusa mają tendencję do opuszczania światła śródbłonka, co prowadzi do obecności antygenów wirusowych we krwi i limfatycznych komórkach śródbłonka. Jednak w miarę rozprzestrzeniania się wirusa będzie on atakowany na przykład w komórkach śródbłonka płuc, ale nie w mózgu.
Aplikacje
Technologie nauki

W zależności od poziomu bezpieczeństwa biologicznego (BSL), znanego również jako patogen lub poziom ochrony, do badania patogenu wymagane są różne poziomy ochrony biologicznej i zezwoleń; ten poziom ochrony wpływa na sposób i miejsce badania patogenu. Chociaż te podsumowania koncentrują się na tropizmie komórek śródbłonka, techniki te mają również szerokie zastosowanie do różnych metod wirusologicznych . Podsumowania te nie zawierają wyczerpującej listy, ale są reprezentatywne dla wspólnych platform do badania pojawiających się chorób zakaźnych.
Podejścia in vitro
Unieśmiertelnione komórki stanowią odnawialne źródło do badania różnych patogenów. Charakterystyka tropizmu śródbłonka pozwala naukowcom zmodyfikować komórkę tak, aby wyświetlała receptor, z którym glikoproteina wirusa oddziałuje w celu przyłączenia się do komórki. Jednak te hodowle komórkowe 2D niekoniecznie mają na celu naśladowanie namnażania się wirusa lub odpowiedzi gospodarza in vivo . Te formaty testów biologicznych pozwalają na badanie wirusa i potencjalnie identyfikację receptorów powierzchniowych komórek lub innych czynników zaangażowanych w tropizm komórkowy. Powszechnie biologii molekularnej , takie jak immunofluorescencja lub immunohistochemia , umożliwiają naukowcom wizualizację miejsca występowania receptora w komórce. I odwrotnie, użycie zastępczego lub pseudotypowanego wirusa jest również metodą zrozumienia tropizmu komórkowego. W skrócie, te podejścia zwykle biorą inny i dobrze scharakteryzowany patogen, taki jak wirus pęcherzykowego zapalenia jamy ustnej (VSV) i modyfikują go tak, aby wyświetlał glikoproteinę innego wirusa będącego przedmiotem zainteresowania. Ponieważ glikoproteina służy jako „klucz” do komórki, metoda ta umożliwia badanie wejścia do komórki niezależnie od innych procesów w cyklu życiowym wirusa. Dalszy wzrost lub seryjne pasażowanie tego rekombinowanego wirusa może wykazać, w jaki sposób wirus ewoluuje lub mutuje, aby wspierać skuteczność infekcji.
Modele infekcji in vivo
Naczelne inne niż ludzie, takie jak makaki rezus, służą jako podejście „złotego standardu” dla modeli zwierzęcych dla wielu patogenów BSL4, gdy zjawiska biologicznego nie można badać u innych gatunków. Ponieważ wiele chorób zakaźnych ma odzwierzęcy , modelowanie tych chorób u tych gatunków makaków, które mają pewne biologiczne podobieństwa do ludzi, zapewnia wgląd w zrozumienie choroby w okolicznościach, w których wirus jest słabo poznany, a opcje leczenia są ograniczone lub nie istnieją. Odczyty tych modeli można ocenić na przykład za pomocą próbek tkanek lub próbek krwi. Jednak te modele infekcji in vivo , takie jak modele gryzoni i naczelnych innych niż człowiek, budzą obawy etyczne i niedociągnięcia, ponieważ obejmują zamknięcie zwierzęcia w laboratorium i wprowadzenie do niego zniewagi chorobowej. Pojawienie się zaawansowanych modeli in vivo , w tym humanizowanych lub transgenicznych modeli gryzoni, stanowi alternatywę dla serii makaków, ale budzi również obawy, czy te modele podsumowują ludzką fizjologię lub przewidują ludzkie reakcje na chorobę lub leczenie. Modele te obejmują genetyczną modyfikację i/lub przeszczepienie tkanki ludzkiej do modelu gryzonia. W połączeniu z testami komórkowymi in vitro te modele in vivo mają kluczowe znaczenie dla walidacji leków podczas odkrywania i opracowywania leków.
Odkrywanie i rozwój leków
Tropizm komórek śródbłonka stanowi podstawę medycznych środków zaradczych w odpowiedzi na pojawiające się choroby zakaźne. Te medyczne środki zaradcze obejmują sposób opracowywania środków terapeutycznych, takich jak związki małocząsteczkowe i szczepionki .
Leki przeciwwirusowe i inne leki małocząsteczkowe
przeciwwirusowe to środki lecznicze, które wspomagają organizm człowieka w eliminacji infekcji, łagodzeniu objawów infekcji i/lub zmniejszaniu klinicznego przebiegu choroby. Zrozumienie tropizmu komórek śródbłonka jest wykorzystywane do odkrywania celów leków przeciwwirusowych. Wiele mechanizmów działania tych leków ukierunkowanych jest najpierw na cykl życiowy wirusa. Leki te występują w postaci związków małocząsteczkowych lub innych środków bioterapeutycznych (np. terapii przeciwciałami monoklonalnymi ). W opartych na komórkach, wysokoprzepustowych badaniach przesiewowych leków , tropizm komórkowy jest ważnym czynnikiem podczas selekcji typu komórek. Typ komórki w tych testach powinien wykazywać docelowy receptor, aby reprezentatywnie potwierdzić proponowany mechanizm działania leku i określić jego moc , bezpieczeństwo i skuteczność in vitro . Ponadto inne aspekty tropizmu komórek śródbłonka nadają się do podejść terapeutycznych. Aspekty te obejmują różnorodne mechanizmy wykrywania wirusów przez komórki śródbłonka i reagowania na infekcję. Na przykład bariera śródbłonkowa służy zarówno jako bariera ochronna, jak i jako mediator odpowiedzi immunologicznych przeciwko ciałom obcym. Jednak bariera śródbłonka ulega uszkodzeniu w wyniku infekcji wirusowej. Leki, które wzmacniają lub przywracają integralność bariery śródbłonka po jej uszkodzeniu, zostały uznane za potencjalne cele dla pojawiających się chorób zakaźnych, takich jak COVID-19, Ebola, gorączka denga i inne. W sumie badanie tropizmu komórek śródbłonka może zapewnić wgląd w odpowiednie interwencje terapeutyczne.
| Grupa | Narkotyki) | Mechanizm akcji | Bibliografia |
|---|---|---|---|
| Inhibitory wejścia wirusa | Marawirok | Blokuje zaangażowanie receptora, endocytozę/makropinocytozę, przyłączenie, fuzję lub przekazywanie sygnału związane z pobieraniem wirusa | |
| Wirusowe inhibitory syntezy białek | Lopinawir/rytonawir | Tłumi lub spowalnia replikację wirusa, zakłócając procesy związane z translacją lub wytwarzaniem białka | |
| Wirusowe inhibitory polimerazy | Molnupirawir | Zakłóca regulację transkrypcji białek wirusowych podczas replikacji wirusa | |
| Immunomodulatory | Nitazoksanid | Interferują i przeciwdziałają szlakom regulowanym przez gospodarza podczas replikacji wirusa (np. szlaki IFN i mechanizm wykrywania wirusowego RNA) |
Szczepionki
Szczepionki to środki lecznicze, które zapobiegają chorobom zakaźnym. Te środki terapeutyczne zapewniają organizmowi odporność nabytą na określony patogen. Zasadniczo szczepionki zapewniają pacjentom ochronę poprzez wywoływanie odpowiedzi immunologicznej, dzięki czemu rozwijają się przeciwciała, które pomogą chronić przed inwazyjnym patogenem. Rozwój, produkcja i globalna dystrybucja tych szczepionek jest niezbędna do zapobiegania, kontrolowania i eliminowania potencjalnych patogenów pandemicznych. Konkretnie, technologie szczepionek oparte na hodowlach komórkowych wykorzystują linie komórkowe, które mają szeroki zakres tropizmu wirusowego, aby przystosować szczepy wirusa stosowane w opracowywaniu szczepionek do nowych komórek. To zastosowanie tropizmu komórkowego ocenia różne wirusowe szlaki wejścia i receptory gospodarza, aby osiągnąć ten cel. Co więcej, aspekty aktywacji i dysfunkcji komórek śródbłonka stają się ważnymi odczytami podczas opracowywania szczepionek, ponieważ są one częścią charakterystycznych cech wielu klinicznych przebiegów chorób zakaźnych. Jednym z najbardziej obiecujących kandydatów na szczepionkę przeciwko wirusowi Ebola jest rekombinowana szczepionka VSV-EBOV firmy Merck , Ervebo . Szczepionka była krytyczna podczas wybuchu epidemii eboli w Gwinei pod koniec 2014/2015 roku . Wykazano, że Ervebo jest skuteczny u naczelnych innych niż człowiek, a później w Gwinei podczas zatwierdzonego badania skuteczności na ludziach, które wykazało, że Ervebo również silnie chroni ludzi. Szczepionka wykorzystuje VSV jako substytut do prezentacji glikoproteiny Ebola. VSV nie powoduje chorób u ludzi, co czyni go użytecznym szkieletem do przechowywania ważnego białka wirusa Zair Ebola . Po podaniu szczepionki rekombinowany VSV wprowadza funkcjonalną glikoproteinę wirusa Ebola, która oddziałuje z barierą komórek śródbłonka i wywołuje szybką odpowiedź immunologiczną bez wywoływania choroby u pacjentów. Dlatego opracowywanie i skalowanie szczepionek wiąże się z ważnymi rozważaniami dotyczącymi tropizmu komórek śródbłonka.