Tupanwirus
| Klasyfikacja wirusów | |
|---|---|
| Tupanvirus | |
|
|
| (nierankingowe): | Wirus |
| królestwo : | Varidnaviria |
| Królestwo: | Bamfordvirae |
| Gromada: | Nucleocytoviricota |
| Klasa: | Megawirycety |
| Zamówienie: | Imiterwirusy |
| Rodzina: | Mimiviridae (?) |
| Rodzaj: | Tupanwirus |
| Gatunek | |
|
|
Tupanvirus to rodzaj wirusów opisany po raz pierwszy w 2018 roku. Rodzaj składa się z dwóch gatunków wirusów należących do grupy gigantycznych wirusów . Naukowcy odkryli pierwszy izolat w 2012 roku z próbek osadów głębinowych pobranych na głębokości 3000 m u wybrzeży Brazylii . Drugi izolat został pobrany z jeziora sodowego w południowej Nhecolândii w Brazylii w 2014 roku. Zostały nazwane na cześć Tupã (Tupan), boga piorunów Guaraní, oraz miejsc, w których zostały znalezione. Są to pierwsze wirusy, o których doniesiono, że posiadają geny syntetazy amino-acylo-tRNA dla wszystkich 20 standardowych aminokwasy .
Klasyfikacja
Rodzaj Tupanvirus został po raz pierwszy opisany w 2018 roku wraz z odkryciem dwóch izolatów tupanwirusów znalezionych w próbkach jeziora sodowego i głębokich osadów oceanicznych zebranych w Brazylii. Rodzaj jest obecnie nieprzypisany, ale przypuszcza się, że należy do rodziny Mimiviridae wraz z innymi wirusami infekującymi ameby. Członkowie rodziny Mimiviridae obejmują Acanthamoeba polyphaga mimivirus (APMV), który jest znany ze swojego dużego rozmiaru ~ 500 nm średnicy. W przeciwieństwie do tego, typowy zakres wielkości wirusa wynosi około 20-200 nm. Mimiwirusy posiadają również fibryle struktury na kapsydzie, a także geny kodujące białka do syntezy nukleotydów i różnych metabolizmów, które nie występują u innych wirusów.
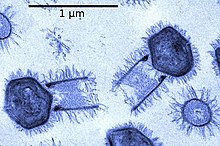
W przeciwieństwie do innych mimiwirusów z rodziny Mimiviridae , tupanwirus ma cylindryczny ogon o długości około 550 nm pokryty włóknami, który jest przyczepiony do podstawy kapsydu . Ta cecha morfologiczna sprawia, że tupanwirus jest największym opisanym wirusem (około ~ 1,2 μm długości z ogonem) z najdłuższym ogonem, jaki kiedykolwiek zaobserwowano u wirusa. Tupanwirusy są również zdolne do infekowania szerszego zakresu ameb niż inne mimiwirusy i wywołują cytotoksyczny w organizmach gospodarza i innych organizmów, którego nie obserwuje się w APMV. Ponadto wyniki filogenomiczne ujawniły, że rodzaj Tupanvirus jest odrębny od innych wirusów z tej rodziny Mimiviridae .
Morfologia
Morfologię Tupanvirusa można porównać do innych „mimiwirusów infekujących amebę”. Wynika to z podobieństw między kapsydem Tupanvirusa a kapsydem innych mimiwirusów infekujących ameby. Kapsyd Tupanwirusa mierzy około 450 nm. Jedną z głównych różnic jest to, że wirion Tupanwirusa ma duży cylindryczny ogon (średnica ~ 550 nm × 450 nm) przymocowany do podstawy kapsydu. Zarówno kapsyd, jak i cylindryczny ogon są pokryte włókienkami. Tupanwirus może mierzyć do 1,2 μm długości, a niektóre cząsteczki mogą osiągnąć nawet 2,3 μm ze względu na „wysoki stopień plastyczności wielkości ogona”. Należy również zauważyć, że w kapsydzie widoczna jest błona lipidowa. Dodatkowo ich kapsyd jest opisany jako mający „strukturę gwiezdnych wrót”. Ten wierzchołek w kształcie gwiazdy jest obecny w innych mimivurises i działa jako pieczęć dla wierzchołka kapsydu. Stwierdzono również, że ogon Tupanvirusa ma mniejszą gęstość elektronów niż kapsyd.
Genom

Genom zawiera około 1,5 miliona par zasad dwuniciowego DNA , kodującego przewidywane białka 1276–1425, co czyni go czwartym co do wielkości wśród genomów wirusowych. Podczas gdy 30% genów jest nowych i nie występuje w innych wirusach, analiza genomowa pokazuje, że większość znanych genów może być spokrewniona z mimiwirusami infekującymi ameby, a reszta odpowiada eukariontom i bakteriom. Wspólne geny tupanwirusa z różnymi liniami mimiwirusów infekujących amebę wskazują, że jest to odrębny rodzaj w obrębie rodziny Mimiviridae. Na przykład jego genom bogaty w A/T przypomina genom innych mimiwirusów amebowych i sugeruje preferencję dla kodonów utworzonych przez sekwencje bogate w A/T. Również częste występowanie motywu promotora „AAAATTGA” jest podobne do tego w przypadku innych mimiwirusów.
Jako gigantyczny wirus, tupanvirus przedstawia największy aparat translacyjny w znanej wirosferze, niosąc 20 syntetazy aminoacylo-tRNA (aaRS) i 70 transferowych RNA (tRNA), podczas gdy reszta bierze udział w dojrzewaniu i splicingu RNA, a także modyfikacji białek rybosomalnych. Ponadto tupanwirusy zawierają szereg niezależnych od DNA polimeraz i enzymów syntetyzujących RNA, a także czynniki transkrypcyjne, które biorą udział w transkrypcji wirusowej. Co więcej, wiele genów kodujących procesy występujące w organizmach komórkowych znajduje się również w genomie Tupanwirusa, który zawiera bogatszy zestaw genów niż niektóre bakterie i archeony, a nawet niektóre eukarionty. W rezultacie analiza tupanwirusów stanowi nowy krok w kierunku zrozumienia ewolucji gigantycznych wirusów, ponieważ tak różnorodne i kompletne zestawy genów nie tylko przewyższają genomy innych wirusów, ale także rywalizują z genomami bakterii, a nawet eukariontów. W rzeczywistości tupanvirus jest jedynym znanym wirusem, który obsługuje wszystkie 20 aaRS, przewyższając inne gigantyczne wirusy, takie jak Klosneuvirus ; jednak nie ma zgody co do tego, czy geny te pochodzą od gospodarza, czy też są przekazywane przez przodka mimiwirusa. Jednym z takich niezwykłych przykładów są dwie kopie regionu intronowego 18 S rRNA, które ulegają silnej ekspresji podczas replikacji wirusa. Chociaż te regiony intronowe istnieją również w innych mimiwirusach, rRNA 18S tupanwirusa jest filogenetycznie inny, a ich funkcja jest wciąż nieznana.
Gospodarz
Tupanwirusy mają zdolność infekowania szerszego zakresu żywicieli niż inne olbrzymie wirusy, w tym wiele ameby z rodzaju Acanthameoba (jak również członków gatunku Vermamoeba vermiformis, Dictyostelium discoideum i Willartia magna), a także mogą infekować inne protisty . Nie ma udokumentowanych zagrożeń dla ludzi. Ogólne podejście tupanwirusa można przypisać niskiemu bogactwu gatunkowemu i obfitości siedliska wirusa.
Ameby zakażone tupanwirusem wykazują również nową interakcję wirus-gospodarz, której wcześniej nie obserwowano wśród innych ameb. Stwierdzono, że zainfekowane komórki agregują z komórkami niezainfekowanymi, co sugeruje, że w mechanizmie pośredniczy białka wiążącego mannozę (MBP). Wykazano, że skupiska dotkniętych komórek zwiększają rozprzestrzenianie się wirusa w gospodarzu, zwiększając w ten sposób zjadliwość wirusa. Podejście ogólne, w połączeniu z zachowaniem agregacyjnym, zmniejsza efekt rozcieńczenia i zwiększa współczynniki spotkania z żywicielem.
Cykl życia i interakcja żywiciela
Załącznik
Cząsteczki wirusa przyczepiają się bezpośrednio do powierzchni komórki gospodarza. Proces przywiązania zachodzi bardzo szybko. Wiriony mogą być widoczne w 0 godzin po zakażeniu. Konkretny mechanizm jest nadal nieznany.
Wejście
Wiriony wchodzą przez fagocytozę . Zasadniczo w każdym fagosomie będzie obecna tylko jedna cząstka , chociaż kilka cząstek może jednocześnie dostać się do macierzy wewnątrzkomórkowej w różnych fagosomach. Ten Tupanwirus wykorzystuje fuzję błonową w celu uwolnienia swojego genomu. Kapsyd wirusa zawiera błonę lipidową, która ułatwia fuzję z błoną fagosomu w celu uwolnienia genomu wirusa. Wirus uwalnia również zawartość utrzymywaną w ogonie po inwazji fagosomu między dwoma składnikami ogona, co powoduje fuzję.
Replikacja
cytoplazmy ameby . Wirus ten ułatwia agregację żywicieli ameby w celu szybkiej replikacji i posiadania zapasu żywicieli dla cząstek potomnych. Tworzenie pęczków następuje szybko po zakażeniu i będzie trwało tak długo, jak żywe będą komórki gospodarza. Pęczki mogą ponownie tworzyć się po mechanicznej separacji, o ile żywe są komórki gospodarza. Fabryki replikacji powstają już od 8 do 12 hpi
Montaż
Początkowo, gdy fabryki replikacji są jeszcze niedojrzałe, nowe wiriony są składane tak szybko, jak to możliwe. Dlatego w jednej fabryce może znajdować się wiele cząstek na różnych etapach montażu. Gdy fabryka dojrzeje, składanie kapsydu jest zakończone, a genom zostaje włączony. Ogony są przyłączane do kapsydu po włączeniu do genomu. Montaż cząstek odbywa się na luźnej osi czasu, w wyniku czego cząsteczki znajdują się na różnych etapach składania w momencie uwolnienia.
Uwolnienie
Cząsteczki wirusa są uwalniane, co ułatwia liza komórek . Podczas infekowania ameby gatunku Vermamoeba vermiformis wiele zmontowanych cząstek nie jest funkcjonalnych w momencie uwolnienia. Aż połowa uwolnionych cząstek nie jest zakaźna; zjawisko to występuje również podczas infekowania ameby żywiciela Acanthamoeba castellanii . Chociaż wymagane są dalsze badania, przypuszcza się, że wytwarzanie niezakaźnych cząstek może być normalną częścią cyklu replikacji.
