Utlenianie katalizowane przez oksoamoniowy
Reakcje utleniania katalizowane przez oksoamoniowy obejmują konwersję substratów organicznych do bardziej utlenionych materiałów poprzez działanie związków N-oksoamoniowych . Tlenki azotu można również stosować w ilościach katalitycznych w obecności stechiometrycznej ilości końcowego utleniacza. Stosowanymi rodnikami nitroksydowymi są 2,2,6,6-tetrametylopiperydyno-1-oksyl (TEMPO) lub jego pochodne.
(1)
Mechanizm i stereochemia
Jednoelektronowe utlenianie nitroksydu prowadzi do powstania wysoce elektrofilowych form oksoamoniowych, które służą jako aktywny środek utleniający. Nitrotlenek może być stosowany jako katalizator w połączeniu z tańszymi utleniaczami stechiometrycznymi, takimi jak podchloryn sodu lub bis (acetoksy) jodobenzen (BAIB).
W warunkach obojętnych lub lekko kwaśnych (na przykład w obecności żelu krzemionkowego) utlenianie zachodzi przez początkowe wiązanie wodorowe między grupą hydroksylową a azotem oksoamoniowym, po czym następuje skoordynowane przeniesienie protonu i abstrakcja wodorków. Za potrzebą tworzenia wiązań wodorowych przemawia niska reaktywność β-alkoksy i β-aminoalkoholi, które wykazują konkurencyjne wewnątrzcząsteczkowe wiązanie wodorowe. Mechanizm utleniania w warunkach słabo zasadowych (pirydyny) jest podobny, z wyjątkiem tego, że pirydyna neutralizuje formy hydroksyamoniowe, a ten związek pośredni „proporcjonuje” do soli oksoamoniowej, dając rodniki nitroksydowe i sole pirydyniowe (patrz równanie (3) poniżej). Ponieważ ta reakcja zużywa zasadę i aktywny utleniacz, w słabo zasadowych warunkach potrzebne są dwa równoważniki zasady i utleniacza. Zunifikowany mechanizm w warunkach neutralnych i podstawowych został przedstawiony w niedawnym artykule. Autorzy przedstawiają obszerną analizę szeregu procesów utleniania, w których pośredniczą sole oksoamoniowe.
(2)
W silnie zasadowych warunkach zdeprotonowany substrat reaguje z formami N-oksyamoniowymi. Może wystąpić atak alkoholanu substratu na azot lub tlen, chociaż uważa się, że ten pierwszy działa na podstawie obserwacji utleniania N-alkoksyamin (które przypuszczalnie przebiegają przez związek pośredni 1 ) . Komproporcjonowanie zredukowanego produktu (hydroksyloaminy) z jonem oksoamoniowym współzawodniczy z utlenianiem; w związku z tym często wymagany jest nadmiar środka utleniającego.
(3)
Utleniania katalizowane azotanami obejmują półprodukty N-oksoamoniowe jako aktywny środek utleniający. Mechanizm utleniania rodnika nitroksydowego zależy od zastosowanego końcowego utleniacza. Utleniacze dwuelektronowe, takie jak NaOCl, są w stanie bezpośrednio przekształcić tlenki azotu w oksoamoniowe.
(4)
Utleniacze jednoelektronowe, takie jak miedź (II), działają poprzez bardziej złożony mechanizm, w którym tlen tlenowy jest końcowym utleniaczem. Miedź (II) utlenia cztery równoważniki nitroksydu do oksoamoniaku, z czego dwa równoważniki (niebieski) reagują z alkoholami, tworząc związki karbonylowe. Pozostałe dwa równoważniki oksoamoniowe (czerwony) ulegają komproporcjonowaniu w celu ponownego utworzenia rodników nitroksylowych (różowy). Wreszcie tlen tlenowy ponownie utlenia cztery równoważniki miedzi (I) z powrotem do miedzi (II). Ogólnie rzecz biorąc, pojedyncza cząsteczka tlenu pośredniczy w utlenianiu dwóch równoważników alkoholu, z utworzeniem dwóch równoważników wody.
(5)
Warianty stereoselektywne
Enancjoselektywne utlenianie to zazwyczaj kinetyczne rozdzielanie chiralnych alkoholi lub reakcje desymetryzacji. Te utleniania można ułatwić poprzez zastosowanie chiralnych rodników nitroksydowych w trybie katalitycznym. Dobrym przykładem jest rozdział kinetyczny racemicznego 1-fenyloetanolu. Z drugiej strony, procesy oksydacyjnej desymetryzacji wykorzystujące utleniacze oksoamoniowe są stosunkowo rzadkie.
(6)
Zakres
Utleniania z użyciem soli oksoamoniowych można prowadzić w trybie stechiometrycznym lub katalitycznym w warunkach kwasowych lub zasadowych. W tej sekcji opisano najczęściej stosowane warunki stechiometrycznego i katalitycznego utleniania alkoholi do związków karbonylowych solami oksoamoniowymi. Chociaż za pomocą TEMPO można utleniać wiele różnych alkoholi, czasami ma miejsce konkurencyjne utlenianie bardziej bogatych w elektrony grup funkcyjnych. Ponadto selektywność miejscowa utleniania polioli może się różnić w zależności od zastosowanych warunków.
Utleniania stechiometryczne
W warunkach lekko kwaśnych lub obojętnych sole oksoamoniowe, takie jak sól Bobbitta, utleniają alkohole allilowe, benzylowe, propargilowe lub alifatyczne do odpowiednich aldehydów lub ketonów. Alkohole drugorzędowe reagują szybciej niż pierwszorzędowe, chociaż selektywność jest niska. Wygodny protokół doświadczalny pozwala na recykling soli oksoamoniowej.
(7)
Aminy, etery benzylowe i alkeny utleniają się szybciej niż nieaktywowane alkohole; w związku z tym selektywne stechiometryczne utlenianie nieaktywowanych alkoholi w obecności tych grup funkcyjnych nie jest możliwe. Alkohole z podstawnikami β-azotowymi lub β-tlenowymi reagują wolno w środowisku kwaśnym. W tych warunkach alkohole allilowe i benzylowe mogą być selektywnie utleniane
(8)
W warunkach zasadowych potrzebne są dwa równoważniki utleniacza ze względu na konkurencyjne proporcje między zredukowanym tlenkiem azotu a nieprzereagowanym oksoamonem (patrz równanie (3) powyżej). Pirydyna jest zwykle stosowana jako zasada. Są to najczęstsze warunki utleniania nitroksydu w trybie stechiometrycznym.
(9)
Trzeciorzędowe alkohole allilowe można również stechiometrycznie utlenić solami oksoamoniowymi do enonów w odmianie reakcji Bablera-Daubena .
Utleniania katalityczne
Katalityczne utlenianie oksoamonu można ułatwić stosując podchloryn sodu jako końcowy utleniacz. Aby reakcja mogła przebiegać, pH musi być utrzymywane poniżej 10 przy użyciu buforu. Aktywnym utleniaczem nitroksydu jest anion podbrominowy; stąd bromek potasu jest stosowany jako dodatek. W produktach zawierających karbonyl nie zachodzi epimeryzacja centrów α-stereogenicznych.
(10)
Zastosowanie chlorynów jako końcowych utleniaczy w połączeniu zarówno z podchlorynami, jak i TEMPO daje kwasy karboksylowe bez produktów ubocznych chlorowania. Reakcję zwykle prowadzi się w dwóch etapach w tym samym naczyniu: przeprowadza się częściowe utlenianie za pomocą TEMPO i podchlorynu, następnie dodaje się chloryn w celu zakończenia utleniania. Obserwuje się tylko utlenianie pierwszorzędowych alkoholi. W połączeniu z dihydroksylacją Sharplessa metoda ta może być stosowana do wytwarzania enancjomerycznie czystych α-hydroksykwasów.
(11)
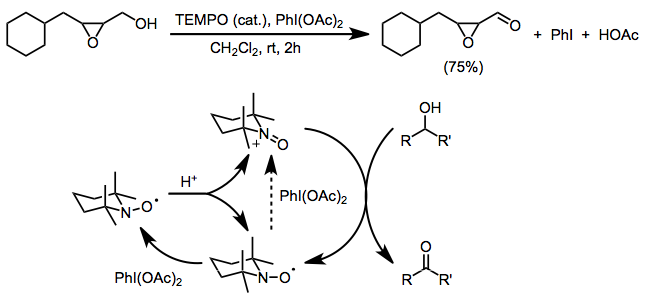
Istotnym ograniczeniem obu powyższych metod jest niezgodność z wolnymi grupami funkcyjnymi aminowymi lub alkenowymi, które ulegają kompetycyjnemu utlenianiu. Zastosowanie bis(acetoksy)jodobenzenu (BAIB) jako końcowego utleniacza pozwala uniknąć tego problemu. BAIB nie jest w stanie bezpośrednio utlenić rodnika nitroksydowego i uważa się, że początkowe tworzenie oksoamoniaku jest spowodowane dysproporcjonowaniem katalizowanym kwasem. BAIB może następnie utlenić powstałą hydroksyloaminę do soli oksoamoniowej. Chociaż reakcję prowadzi się w warunkach kwaśnych (kwas octowy jest produktem ubocznym i często dodaje się go w celu ułatwienia dysproporcjonowania), selektywność utleniania pierwszorzędowych alkoholi jest znaczna. Grupy funkcyjne wrażliwe na zasady, takie jak epoksydy, są tolerowane w tych warunkach.
(12)
Inne dwuelektronowe końcowe utleniacze stosowane z TEMPO obejmują mCPBA (preferowane jest wtórne utlenianie, chociaż mogą wystąpić reakcje uboczne), N-chlorosukcynoimid i Oxone.
Miedź(II), zarówno w postaci wolnej soli chlorkowej, jak i kompleksu z ligandami dwukleszczowymi, utlenia TEMPO do jego soli oksoamoniowej. W tych reakcjach powietrze służy jako końcowy utleniacz. Nie jest jasne, czy powietrze utlenia miedź (I) do miedzi (II), czy też w utlenianiu alkoholu częściowo pośredniczy miedź, a powietrze utlenia powstałą hydroksyloaminę z powrotem do soli oksoamoniowej. Pierwsza zachodzi podczas procesu Wackera , ale druga wyjaśnia, dlaczego kompleksy miedzi i kilka innych kompleksów metali mogą utleniać alkohole w połączeniu z TEMPO.
(13)
Aktywowany dwutlenek manganu , utleniający alkohole allilowe i benzylowe, jest tańszy od TEMPO i prosty w obsłudze. Odczynniki na bazie chromu, takie jak chlorochromian pirydyniowy, można również stosować do przekształcania alkoholi w związki karbonylowe; chociaż stechiometryczne wytwarzanie odpadów chromu jest wadą. Utleniania wykorzystujące sulfotlenek dimetylu , takie jak Swern i Moffatt reakcji, nie zawierają metali ciężkich i utleniają szeroką gamę substratów. Utleniania oksoamoniowe są preferowane w stosunku do metod DMSO w reakcjach dioli i alkoholi acetylenowych. Nadjodan Dessa-Martina jest wysoce selektywnym, łagodnym utleniaczem alkoholi, którego podstawową wadą są trudności w przygotowaniu i bezpieczeństwo.