Znakowanie immunogoldem
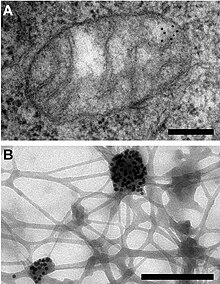
Znakowanie immunogoldem lub barwienie immunogoldem (IGS) to technika barwienia stosowana w mikroskopii elektronowej . Ta technika barwienia jest odpowiednikiem pośredniej immunofluorescencji dla światła widzialnego. Cząsteczki złota koloidalnego są najczęściej przyłączane do przeciwciał drugorzędowych , które z kolei są przyłączane do przeciwciał pierwszorzędowych zaprojektowanych do wiązania określonego antygenu lub innego składnika komórki . Złoto jest używane ze względu na wysoką gęstość elektronów , która wzrasta elektronów , aby uzyskać „ciemne plamy” o wysokim kontraście.
Po raz pierwszy zastosowane w 1971 r., znakowanie immunogoldem zostało zastosowane zarówno w transmisyjnej mikroskopii elektronowej , jak i skaningowej mikroskopii elektronowej , a także w mikroskopii jasnego pola . Technikę etykietowania można dostosować do rozróżniania wielu obiektów za pomocą cząstek złota o różnej wielkości.
Znakowanie immunogoldem może wprowadzać artefakty, ponieważ cząsteczki złota znajdują się w pewnej odległości od znakowanego obiektu, a podczas przygotowywania próbki wymagane jest bardzo cienkie skrawanie.
Historia
Znakowanie immunogoldem zostało po raz pierwszy użyte w 1971 roku przez Faulka i Taylora do identyfikacji antygenów Salmonelli . Został po raz pierwszy zastosowany w transmisyjnej mikroskopii elektronowej (TEM) i był szczególnie przydatny do wyróżniania białek występujących w małych gęstościach, takich jak niektóre antygeny powierzchniowe komórek. Wraz ze wzrostem rozdzielczości skaningowej mikroskopii elektronowej (SEM) rosło również zapotrzebowanie na etykiety wielkości nanocząstek, takie jak immunogold. W 1975 roku Horisberger i współpracownicy z powodzeniem zwizualizowali nanocząsteczki złota o średnicy mniejszej niż 30 nm i wkrótce stało się to uznaną techniką SEM.
Technika
Najpierw wycina się cienki skrawek próbki, często za pomocą mikrotomu . Następnie mogą mieć miejsce różne inne etapy przygotowania próbki .
Przygotowana próbka jest następnie inkubowana ze specyficznym przeciwciałem przeznaczonym do wiązania cząsteczki będącej przedmiotem zainteresowania. Następnie dodaje się drugorzędowe przeciwciało z przyłączonymi cząsteczkami złota, które wiąże się z przeciwciałem pierwszorzędowym. Złoto może być również przyłączone do białka A lub białka G zamiast przeciwciała drugorzędowego, ponieważ białka te wiążą regiony Fc ssaków IgG w sposób niespecyficzny.
Cząsteczkę złota o dużej gęstości elektronów można teraz zobaczyć pod mikroskopem elektronowym jako czarną kropkę, pośrednio oznaczającą interesującą cząsteczkę.
Etykietowanie wielu obiektów
Znakowania immunogoldem można użyć do jednoczesnej wizualizacji więcej niż jednego celu. Można to osiągnąć w mikroskopii elektronowej za pomocą dwóch cząsteczek złota o różnej wielkości. Rozszerzenie tej metody wykorzystywało trzy różnej wielkości cząsteczki złota do śledzenia lokalizacji peptydów regulatorowych . Bardziej złożona metoda znakowania wielomiejscowego polega na oddzielnym znakowaniu przeciwległych stron miejsca antygenowego , dzięki czemu cząsteczki immunozłota przyłączone po obu stronach można oglądać jednocześnie.
Zastosowania w mikroskopii jasnego pola
Chociaż znakowanie immunogoldem jest zwykle używane w transmisyjnej mikroskopii elektronowej, gdy złoto jest „wzmocnione srebrem”, można je zobaczyć za pomocą mikroskopii jasnego pola . Wzmocnienie srebrem zwiększa rozmiar cząstek, umożliwiając również skaningową mikroskopię elektronową. W celu wytworzenia cząstek złota wzmocnionego srebrem, cząsteczki złota koloidalnego umieszcza się w kwaśnym roztworze wzmacniającym zawierającym jony srebra . Cząsteczki złota działają wtedy jak zarodkowanie miejsce i srebro osadza się na cząstce. Przykładem zastosowania immunozłotego znakowania wzmocnionego srebrem (IGSS) była identyfikacja patogenu Erwinia amylovora .
Ograniczenia
Nieodłącznym ograniczeniem techniki immunogold jest to, że cząsteczka złota znajduje się w odległości około 15-30 nm od miejsca, z którym wiąże się przeciwciało pierwszorzędowe (w przypadku stosowania strategii znakowania przeciwciałami pierwszorzędowymi i drugorzędowymi ). Dlatego dokładne położenie docelowej cząsteczki nie może być dokładnie obliczone. Cząsteczki złota mogą mieć średnicę 1 nm (lub mniejszą), ale wówczas pojawia się inne ograniczenie — przy tych rozmiarach złota etykieta staje się trudna do odróżnienia od struktury tkanki.
Do znakowania immunozłotem wymagane są cienkie skrawki, które mogą dawać mylące obrazy; cienki wycinek składnika komórkowego może nie dawać dokładnego obrazu jego trójwymiarowej struktury . Na przykład mikrotubula może wyglądać jak „kolec” w zależności od tego, w której płaszczyźnie nastąpiło przecięcie. Aby przezwyciężyć to ograniczenie, można wykonać sekcje seryjne, które następnie można skompilować w trójwymiarowy obraz.
Kolejnym ograniczeniem jest to, że przeciwciała i cząsteczki złota nie mogą przenikać przez żywicę używaną do zatapiania próbek do obrazowania. Zatem tylko dostępne cząsteczki mogą być celowane i wizualizowane. Oznakowanie przed zatopieniem próbki może zmniejszyć negatywny wpływ tego ograniczenia.