Aktywator wybielania
Aktywatory wybielania to związki, które pozwalają na niższą temperaturę prania niż byłaby wymagana w innym przypadku do osiągnięcia pełnej aktywności środków wybielających w kąpieli piorącej. Środki wybielające, zazwyczaj nadtlenki , są zwykle wystarczająco aktywne dopiero w temperaturze 60°C i wyższej. Dzięki aktywatorom wybielania aktywność tę można osiągnąć w niższych temperaturach. Aktywatory wybielacza są zawarte w niektórych do prania (np. Tide), niektórych proszkach do prania i kilku saszetkach z dodatkami do prania. Nie wchodzą w skład żadnych płynnych detergentów do prania. Aktywatory wybielacza reagują z nadtlenkiem wodoru w roztworze wodnym, tworząc nadtlenokwasy . Kwasy nadtlenowe są bardziej aktywnymi wybielaczami niż nadtlenek wodoru w niższych temperaturach (<60 ° C), ale są zbyt niestabilne, aby można je było przechowywać w ich aktywnej postaci, dlatego muszą być wytwarzane in situ.
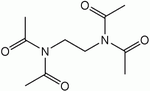
Najbardziej powszechnymi aktywatorami wybielaczy stosowanymi w handlu są tetraacetyloetylenodiamina (TAED) i nonanoiloksybenzenosulfonian sodu (NOBS). NOBS jest głównym aktywatorem stosowanym w USA i Japonii, TAED jest głównym aktywatorem stosowanym w Europie.
Struktura i właściwości
Aktywatory wybielacza składają się zazwyczaj z dwóch części: prekursora kwasu nadtlenowego i grupy opuszczającej ; i są modyfikowane poprzez zmianę tych części. Prekursor kwasu nadtlenowego wpływa na właściwości wybielające kwasu nadtlenowego: określa aktywność, selektywność, równowagę hydrofobową/hydrofilową i potencjał utleniający. Grupa opuszczająca wpływa na rozpuszczalność , szybkość perhydrolizy i stabilność podczas przechowywania aktywatora.
Mechanizm aktywacji
Aktywacja wybielacza jest również znana jako perhydroliza. Nadsole to sole nieorganiczne, które są używane jako nośniki nadtlenku wodoru (przykłady obejmują nadwęglan sodu i nadboran sodu ). Nadsole i aktywatory wybielania są zawarte razem w proszkach do prania zawierających wybielacze. W praniu oba związki rozpuszczają się w wodzie. Po rozpuszczeniu w wodzie sól nadtlenowa uwalnia nadtlenek wodoru ( np. z nadwęglanu sodu):
- 2Na2CO3 ∙ 3H2O2 → 2Na2CO3 + 3H2O2 _ _ _ _ _ _ _ _ _
W zasadowym roztworze myjącym nadtlenek wodoru traci proton i przekształca się w anion perhydroksylowy:
- H. 2 O 2 ⇌ H. + + H O 2 -
Anion nadhydroksylowy następnie atakuje aktywator, tworząc kwas nadtlenowy:
- H O 2 − + RC(O)X → X − + RC(O)O 2 H
Całkowita reakcja TAED ( 1 ) z 2 równoważnikami nadtlenku wodoru daje diacetyloetylenodiaminę ( 2 ) i 2 równoważniki kwasu nadoctowego ( 3 ):
Tylko anion perhydroksylowy, a nie cząsteczka nadtlenku wodoru, reaguje z aktywatorem wybielania. W roztworach wodnych obecny jest również jon wodorotlenkowy, ale ze względu na większą nukleofilowość anionu perhydroksylowego będzie on reagował preferencyjnie. Po utworzeniu kwas nadtlenowy może działać jako wybielacz .
Ekonomia
Zużycie aktywatorów wybielaczy w 2002 roku wyniosło około 105 000 ton. Jednak konsumpcja pozostaje w stagnacji lub spada z powodu presji cenowej na detergenty i rozwoju płynnych preparatów detergentowych (które nie zawierają wybielaczy i aktywatorów wybielania). Stosunkowo wysoki koszt konwencjonalnych systemów wybielających ogranicza ich rozpowszechnienie na rynkach wschodzących, gdzie do prania używa się zimnej wody, a fotowybielanie światłem słonecznym jest powszechne lub powszechne jest stosowanie roztworu podchlorynu sodu (jak w USA ) .
W Europie istnieje znaczny potencjał w zakresie bardziej aktywnych aktywatorów wybielania ze względu na znaczne potencjalne oszczędności energii, które można osiągnąć dzięki praniu w niższych temperaturach, ale ich wyższej aktywności nie może towarzyszyć większe niszczenie barwników tekstylnych i włókien. Oprócz wybielania plam w praniu, ważną rolę odgrywają również dezynfekujące i dezodoryzujące działanie kombinacji wybielacza i aktywatora. Dlatego też są stosowane w środkach do mycia naczyń i środkach do czyszczenia protez zębowych.
Przykłady
Typowymi aktywatorami wybielania są zasadniczo związki N- i O -acylowe, które tworzą peroksykwasy w wyniku perhydrolizy (co oznacza hydrolizę nadtlenkiem wodoru z wybielacza, nadsolami). Na przykład TAED wytwarza w płynie piorącym wybielający aktywny kwas peroksyoctowy lub z kwasu peroksydodekanowego DOBA. We wszystkich przypadkach aktywator poddaje się reakcji chemicznej w zależności od stopnia zanieczyszczenia prania, a tym samym „zużywa się”.
Literatura opisuje różne aktywne związki N -acylowe, takie jak tetraacetyloglikoluril i inne acylowane nasycone związki heterocykliczne zawierające azot , takie jak hydantoiny , hydrotriazyny, diketopiperazyny itp., jak również acylowane imidy i laktamy. Wadą tych związków w porównaniu ze standardowym związkiem TAED jest ich zwykle gorsza wydajność ekonomiczna i ekologiczna.
Oprócz acylowanych pochodnych fenolu NOBS, LOBS i DOBA (naładowanych ujemnie w środowisku wodnym) opisano dalsze związki O-acylowe o działaniu bielącym, na przykład tetraacetyloksylozę lub pentaacetyloglukozę. DOBA, powszechnie stosowana w Japonii, charakteryzuje się dobrą biodegradowalnością i większym wpływem na szereg mikroorganizmów w porównaniu do TAED. Oba działają synergistycznie. Ponadto nitryle, takie jak cyjanopirydyna i cyjanamidy, cyjanomorfolina, a zwłaszcza sole cyjanometylotrialkilo/aryloamoniowe są znanymi aktywatorami bielenia (te ostatnie, tak zwane czwartorzędy nitrylowe, występują w roztworach wodnych jako kationy).
Czwartorzędowe związki nitrylowe są aktywne w wybielaniu nawet w temperaturach około 20°C i działają poprzez peroksoiminokwasy, które powstają pośrednio ze związków nadtlenowych . Rozkładają się one do odpowiednich czwartorzędowych amidów, które pod wpływem nadtlenku wodoru reagują z odpowiednimi, łatwo biodegradowalnymi betainami. Wadą czwartorzędowych nitrylów jest słaba biodegradowalność oryginalnych substancji i często wyraźna higroskopijność, którą jednak można zredukować odpowiednimi przeciwjonami.
Opracowano inne nowe systemy wybielające, zwłaszcza do prania w niższych temperaturach i temperaturze pokojowej oraz do stosowania w płynnych preparatach detergentowych:
- Nowe i bardziej aktywne peroksykwasy, takie jak kwas ftalimidoperoksyheksanowy (PAP)
- Boostery nadkwasów, które tworzą wysoce reaktywne związki pośrednie z nadkwasami (takie jak cykliczne sulfoniminy jako prekursory reaktywnych oksazyrydyn) lub ketony na bazie cukru, które tworzą aktywne wybielająco dioksirany z nadtlenkiem wodoru
- Katalizatory wybielające, które tworzą stabilne kompleksy metali przejściowych (takich jak mangan, żelazo, kobalt itp.) z nadsolami wybielającymi aktywne formy tlenu nawet w temperaturach poniżej 30°C. Prawie 100-krotnie przewyższają aktywność standardowego związku TAED. Takie kompleksy dają ogromne korzyści ekonomiczne (mniejsza objętość detergentu, mniej opakowań, niższe koszty transportu) i środowiskowe (niska temperatura prania, niskie zanieczyszczenie ścieków). Szczególnie interesujące są katalizatory bielenia drugiej generacji, które już z tlenem atmosferycznym tworzą aktywne związki wybielające, czyli mogą naśladować miejsca aktywne naturalnych mono- lub dioksygenaz . Jednak w 1994 r. Wprowadzenie kompleksu manganu pierwszej generacji („persil power flop”) przez firmę Unilever w Wielkiej Brytanii zakończyło się katastrofą. W rezultacie zaufanie konsumentów do katalizatorów bielenia zostało trwale zachwiane. Jedyne jak dotąd (2017 r.) połączenie katalizatora bielenia i soli nadtlenowej stosuje się w detergentach do zmywania naczyń.

![{\displaystyle \left[{\ce {R^{2}-{\overset {\displaystyle R^{1} \atop |}{\underset {| \atop \displaystyle R^{3}}{N+}}}-CH2-CN}}\right]{\ce {X-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5516682f90d1983096e15ff53c921d872dab1184)
