Dioksygenaza
| dioksygenazy | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Acinetobacter sp. adp1 protokatechuat 3,4-dioksygenazy w kompleksie z 3,4-dihydroksybenzoesanem
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Dioksygenaza_C | ||||||||
| Pfam | PF00775 | ||||||||
| Klan Pfam | CL0287 | ||||||||
| InterPro | IPR000627 | ||||||||
| PROZYTA | PDOC00079 | ||||||||
| SCOP2 | 2 szt. / ZAKRES / SUPFAM | ||||||||
| |||||||||
Dioksygenazy to enzymy oksydoreduktazy . Życie tlenowe , od prostych jednokomórkowych gatunków bakterii do złożonych organizmów eukariotycznych , ewoluowało w zależności od mocy utleniającej tlenu ditlenowego w różnych szlakach metabolicznych. Od energetycznego trifosforanu adenozyny (ATP) po degradację ksenobiotyków , stosowanie tlenu ditlenowego jako biologicznego utleniacza jest szeroko rozpowszechnione i zróżnicowane pod względem dokładnego mechanizmu jego wykorzystania. Enzymy wykorzystują wiele różnych schematów wykorzystania tlenu ditlenowego, a to w dużej mierze zależy od substratu i reakcji.
Porównanie z monooksygenazami
W monooksygenazach tylko jeden atom tlenu ditlenowego jest włączany do substratu, a drugi jest redukowany do cząsteczki wody. Dioksygenazy ( EC 1.13.11 ) katalizują utlenianie substratu bez redukcji jednego atomu tlenu z tlenu ditlenowego do cząsteczki wody. Jednak ta definicja jest niejednoznaczna, ponieważ nie bierze pod uwagę, ile substratów bierze udział w reakcji. do osiągnięcia tego celu wykorzystuje się różne schematy kofaktorów . Na przykład w enzymach zależnych od α-ketoglutaranu jeden atom tlenu ditlenowego jest włączany do dwóch substratów, z których jednym zawsze jest α-ketoglutaran, a reakcja ta jest wywoływana przez jednojądrzaste centrum żelaza.
Enzymy zawierające żelazo
Najszerzej obserwowanym kofaktorem zaangażowanym w reakcje dioksygenacji jest żelazo , ale schemat katalityczny stosowany przez te enzymy zawierające żelazo jest bardzo zróżnicowany. Dioksygenazy zawierające żelazo można podzielić na trzy klasy na podstawie sposobu, w jaki żelazo jest włączane do miejsca aktywnego: te wykorzystujące jednojądrzaste centrum żelaza, te zawierające klaster Rieske [2Fe-2S] i te wykorzystujące hemową grupę protetyczną.
Jednojądrowe dioksygenazy żelaza
Jednojądrowe dioksygenazy żelaza lub dioksygenazy niehemowo-zależne od żelaza, jak są one również określane, wszystkie wykorzystują pojedyncze żelazo katalityczne do wbudowania jednego lub obu atomów tlenu ditlenowego w substrat . Pomimo tego powszechnego zdarzenia utleniania, jednojądrzaste dioksygenazy żelaza różnią się sposobem wykorzystywania aktywacji ditlenowej do promowania pewnych reakcji chemicznych. Na przykład rozszczepienie wiązania węgiel-węgiel, hydroperoksydacja kwasów tłuszczowych, rozszczepienie wiązania węgiel-siarka i utlenianie tiolu to wszystkie reakcje katalizowane przez jednojądrowe dioksygenazy żelaza.
Większość jednojądrzastych dioksygenaz żelaza należy do nadrodziny kupinów , w której ogólna struktura domeny jest opisana jako sześcioniciowy fałd beczki β (lub motyw galaretki ). W centrum tej beczkowatej struktury znajduje się jon metalu, najczęściej żelazo, którego środowisko koordynacyjne jest często zapewniane przez reszty w dwóch częściowo zachowanych motywach strukturalnych: G(X) 5 HXH(X) 3 - 4 E ( X ) 6 G i G(X) 5 - 7 PXG(X) 2 H(X) 3 N.
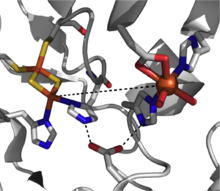
Dwie ważne grupy jednojądrzastych, niehemowych dioksygenaz żelaza to dioksygenazy katecholowe i dioksygenazy zależne od 2-oksoglutaranu (2OG) . Dioksygenazy katecholowe , jedne z najlepiej zbadanych enzymów dioksygenaz, wykorzystują ditlen do rozszczepiania wiązania węgiel-węgiel aromatycznego katecholowego układu pierścieniowego. Dioksygenazy katecholowe są dalej klasyfikowane jako „ekstradiolowe” lub „intradiolowe”, a rozróżnienie to opiera się na mechanistycznych różnicach w reakcjach (ryc. 1 i 2). Enzymy intradiolowe rozszczepiają wiązanie węgiel-węgiel między dwiema grupami hydroksylowymi. Aktywne centrum żelazowe jest koordynowane przez cztery ligandy białkowe - dwie histydynowe i dwie reszty tyrozynianowe - w trygonalny sposób bipiramidalny z cząsteczką wody zajmującą piąte miejsce koordynacyjne. Gdy substrat katecholowy zwiąże się z centrum metalu w dwukleszczowy przez zdeprotonowane grupy hydroksylowe, żelazo żelazowe „aktywuje” substrat za pomocą abstrakcji elektronu w celu wytworzenia rodnika na substracie. Pozwala to następnie na zajście reakcji z tlenem ditlenowym, a następnie rozszczepienie intradiolu przez cykliczny bezwodnik pośredni. Członkowie ekstradiolu wykorzystują żelazo żelazowe jako aktywny stan redoks, a to centrum jest zwykle koordynowane oktaedrycznie przez motyw 2-His-1-Glu z nietrwałymi ligandami wodnymi zajmującymi puste pozycje. Gdy substrat zwiąże się z centrum żelazawym, sprzyja to wiązaniu tlenu ditlenowego i późniejszej aktywacji. Te aktywowane formy tlenu wchodzą następnie w reakcję z substratem, ostatecznie rozszczepiając wiązanie węgiel-węgiel sąsiadujące z grupami hydroksylowymi, poprzez utworzenie pośredniego α-ketolaktonu.
W dioksygenazach zależnych od 2OG żelazo żelazowe ( Fe(II) ) jest również koordynowane przez motyw „triady twarzy” (His)2(Glu/Asp)1. Koordynacja dwukleszczowa 2OG i wody uzupełnia pseudo-oktaedryczną sferę koordynacyjną. Po związaniu substratu ligand wodny jest uwalniany, dając otwarte miejsce koordynacyjne do aktywacji tlenu. Po związaniu tlenu zachodzi słabo poznana transformacja, podczas której 2OG jest utleniająco dekarboksylowany do bursztynianu, a wiązanie OO jest rozszczepiane, tworząc związek pośredni Fe (IV) -okso ( ferryl ). Ten silny utleniacz jest następnie wykorzystywany do przeprowadzania różnych reakcji, w tym hydroksylacji, halogenowania i demetylacji. W najlepiej scharakteryzowanym przypadku, hydroksylazy, związek pośredni ferrylowy odrywa atom wodoru od docelowej pozycji substratu, dając rodnik substratu i Fe (III) -OH. Ten rodnik łączy się następnie z ligandem wodorotlenkowym, wytwarzając produkt hydroksylacji i stan spoczynku Fe (II) enzymu.
Dioksygenazy Rieskego
Dioksygenazy Rieskego katalizują cis-dihydroksylację arenów do produktów cis-dihydrodiolu. Enzymy te występują głównie w bakteriach glebowych, takich jak Pseudomonas , a ich reakcje stanowią pierwszy etap biodegradacji węglowodorów aromatycznych. Dioksygenazy Rieske są strukturalnie bardziej złożone niż inne dioksygenazy ze względu na potrzebę wydajnej ścieżki przenoszenia elektronów (ryc. 2), aby pośredniczyć w dodatkowej, jednoczesnej redukcji dwuelektronowej substratu aromatycznego.
Katalitycznie kompetentna dioksygenaza Rieskego ma trzy składniki: reduktazę FAD zależną od NADH , ferredoksynę z dwoma klastrami [2Fe-2S] Rieskego i oksygenazę α3β3, z każdą podjednostką α zawierającą jednojądrzaste centrum żelaza i [2Fe-2S] Klaster Rieske. W każdej podjednostce α klaster żelazowo-siarkowy i jednojądrowe centrum żelaza są oddzielone odległością około ~ 43 Å, o wiele za daleko, aby nastąpił efektywny transfer elektronów . Zamiast tego proponuje się, że przenoszenie elektronów odbywa się za pośrednictwem tych dwóch centrów w sąsiednich podjednostkach, że klaster żelazowo-siarkowy jednej podjednostki przenosi elektrony do jednojądrowego centrum żelaza sąsiedniej podjednostki, które jest dogodnie oddzielone ~ 12 Å. Chociaż odległość ta wydawałaby się optymalna dla wydajnego transferu elektronów, zastąpienie mostkującej reszty asparaginianu powoduje utratę funkcji enzymu, co sugeruje, że zamiast tego transfer elektronów przebiega przez sieć wiązań wodorowych utrzymywaną na miejscu przez tę resztę asparaginianu.
Mechanistyczny obraz tej klasy dioksygenaz nie jest jeszcze jasny, ale istnieją dowody potwierdzające obecność wodoronadtlenowego związku pośredniego żelaza (III) w ścieżce reakcji. Gatunek ten może reprezentować aktywny utleniacz lub może ulegać hemolitycznemu rozszczepieniu wiązania OO z wytworzeniem pośredniego żelaza (V)-okso jako działającego środka utleniającego. Dioksygenaza Rieskego to potężna klasa enzymów aktywnych redoks, a oprócz dioksygenacji opisano reakcje, takie jak sulfoksydacja, desaturacja i utlenianie benzylu.
Dioksygenazy zawierające hem
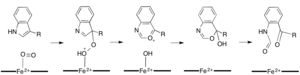
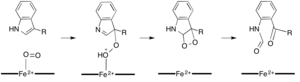
Podczas gdy większość dioksygenaz zależnych od żelaza wykorzystuje kofaktor żelaza niehemowego, utlenianie L-(i D-)tryptofanu do N-formylkinureniny jest katalizowane przez 2,3-dioksygenazę tryptofanu (TDO) lub 2,3-dioksygenazę indoloaminy ( IDO), które są hemowymi dioksygenazami, które wykorzystują żelazo koordynowane przez hemową grupę prostetyczną B. Chociaż te dioksygenazy są częściowo interesujące, ponieważ w wyjątkowy sposób wykorzystują hem do katalizy, są one również interesujące ze względu na ich znaczenie w tryptofanu w komórce, co ma liczne implikacje fizjologiczne. Uważa się, że początkowe połączenie substratu z żelazem dwutlenowym w miejscu aktywnym enzymu zachodzi albo przez dodanie rodników, albo przez dodanie elektrofilowe, co wymaga odpowiednio żelaza lub żelaza. Podczas gdy dokładny mechanizm reakcji dla dioksygenaz zależnych od hemu jest nadal przedmiotem dyskusji, postuluje się, że reakcja przebiega poprzez mechanizm dioksetanu lub mechanizm Criegee (ryc. 4, 5).
Dioksygenazy kambialistyczne
Chociaż żelazo jest zdecydowanie najbardziej rozpowszechnionym kofaktorem używanym do enzymatycznego dioksygenacji, nie jest wymagane przez wszystkie dioksygenazy do katalizy. 2,3-dioksygenaza kwercetyny (kwercetynaza, QueD) katalizuje dioksygenolityczne rozszczepianie kwercetyny na kwas 2-protokatechuoilofloroglucynolokarboksylowy i tlenek węgla . Najbardziej scharakteryzowany enzym, z Aspergillus japonicus, wymaga obecności miedzi , a odkryto kwercetynazy bakteryjne, które są dość rozwiązłe (kambalistyczne) w swoich wymaganiach dotyczących centrum metalicznego, z różnym stopniem aktywności zgłaszanym z zastąpieniem dwuwartościowego manganu , kobaltu , żelazo, nikiel i miedź. (Kwercetyna, rola w metabolizmie). Dioksygenaza acyreduktonu (1,2-dihydroksy-5-(metylotio)pent-1-en-3-onu (ARD) występuje zarówno u prokariotów, jak i eukariontów . Enzymy ARD z większości gatunków wiążą żelazo żelazowe i katalizują utlenianie acyreduktonu do 4-(metylotio)-2-oksobutanianu, α-ketokwasu metioniny i kwasu mrówkowego . Jednak ARD z Klebsiella oxytoca katalizuje dodatkową reakcję, gdy nikiel (II) jest związany: zamiast tego wytwarza 3-(metylotio)propionian, mrówczan i tlenek węgla w reakcji acireduktonu z tlenem. Aktywność Fe-ARD jest ściśle powiązana ze szlakiem ratowania metioniny, w którym metylotioadenozynowy produkt komórkowych S-adenozylometioniny (SAM) jest ostatecznie przekształcany w aciredukton.
Chociaż dokładna rola Ni-ARD nie jest znana, podejrzewa się, że pomaga regulować poziom metioniny, działając jako bocznik na ścieżce ratunkowej. Ten K. oxytoca stanowi wyjątkowy przykład, w którym obecny jon metalu dyktuje, która reakcja jest katalizowana. Wszystkie kwercetynazy i enzymy ARD należą do nadrodziny kupinów , do której należą również jednojądrzaste enzymy żelaza. Schemat koordynacji metali dla enzymów QueD to 3-His lub 3-His-1-Glu, przy czym dokładny układ jest specyficzny dla organizmu. Wszystkie enzymy ARD chelatują metal katalityczny (Ni lub Fe) poprzez motyw 3-His-1-Glu. W tych dioksygenazach koordynujące ligandy są dostarczane przez oba typowe motywy kupinowe. W enzymach ARD metal występuje w układzie oktaedrycznym z trzema resztami histydyny tworzącymi triadę twarzową. Bakteryjne centra metali kwercetynazy zazwyczaj mają trygonalne bipiramidalne lub oktaedryczne środowisko koordynacyjne, gdy występują cztery ligandy białkowe; metalowe centra enzymów QueD zależnych od miedzi mają zniekształconą geometrię czworościenną, w której tylko trzy konserwatywne reszty histydynowe zapewniają ligandy koordynacyjne. Puste miejsca koordynacyjne we wszystkich centrach metalowych są zajęte przez wodne ligandy, dopóki nie zostaną one wyparte przez napływający substrat.
Zdolność tych dioksygenaz do zachowania aktywności w obecności innych kofaktorów metali o szerokim zakresie potencjałów redoks sugeruje, że centrum metalu nie odgrywa aktywnej roli w aktywacji tlenu ditlenowego. Uważa się raczej, że metalowy środek utrzymuje podłoże we właściwej geometrii, aby mogło ono reagować z tlenem ditlenowym. Pod tym względem enzymy te przypominają dioksygenazy katecholowe intradiolu , w których centra metali aktywują substrat do późniejszej reakcji z tlenem ditlenowym.
Dioksygenazy niezależne od kofaktora
Dioksygenazy, które katalizują reakcje bez potrzeby kofaktora, są z natury znacznie rzadsze niż te, które ich wymagają. Wykazano, że dwie dioksygenazy, 2,4-dioksygenaza 1H-3-hydroksy-4-okso-chinoliny (QDO) i 2,4-dioksygenaza 1H-3-hydroksy-4-oksochinaldyny (HDO), nie wymagają ani organicznej ani kofaktor metalowy. Enzymy te katalizują degradację chinolonów w sposób podobny do dioksygenazy kwercetyny , ale uważa się, że pośredniczą w reakcji rodnikowej cząsteczki ditlenku z karbanionem na podłożu (ryc. 5). Zarówno HDO, jak i QDO należą do nadrodziny enzymów hydrolaz α/β, chociaż reszty katalityczne w HDO i QDO nie wydają się spełniać tej samej funkcji, co w pozostałych enzymach z nadrodziny hydrolaz α/β .
Znaczenie kliniczne
Różnorodność w rodzinie dioksygenaz oznacza szeroki zakres ról biologicznych:
- 2,3-dioksygenaza tryptofanu (TDO) pomaga regulować tryptofan w organizmie i ulega ekspresji w wielu ludzkich nowotworach. Inna dioksygenaza zależna od żelaza hemowego, IDO, również ma znaczenie dla zdrowia ludzkiego, ponieważ działa w reakcjach zapalnych w kontekście niektórych chorób. IDO wpływa zarówno na tryptofan, jak i kinureninę i jest powiązany z depresją u ludzi.
- Alkaptonuria jest chorobą genetyczną, która powoduje niedobór 1,2-dioksygenazy homogentyzynianu , która jest odpowiedzialna za katalizowanie powstawania 4-maleiloacetooctanu z homogentyzynianu . Nagromadzenie kwasu homogentyzynowego może spowodować uszkodzenie zastawki serca, kamienie nerkowe i uszkodzenie chrząstki w organizmie.
- Neurodegeneracja związana z kinazą pantotenianową (PKAN) jest autosomalnym zaburzeniem recesywnym , które może prowadzić do rozwoju granulek żelaza i ciał Lewy'ego w neuronach . Badanie wykazało, że pacjenci, u których zdiagnozowano PKAN, mieli podwyższony cysteiny w gałce bladej w wyniku niedoboru dioksygenazy cysteinowej . Pacjenci z PKAN często rozwijają objawy otępienia i często umierają we wczesnym wieku dorosłym.
- W naprawie DNA, dioksygenaza zależna od Fe(II)/2-oksoglutaranu AlkB działa w oksydacyjnym usuwaniu uszkodzeń DNA spowodowanych alkilacją. Nieusunięcie uszkodzeń DNA spowodowanych alkilacją może spowodować cytotoksyczność lub mutagenezę podczas replikacji DNA.
- Cyklooksygenazy (COX), które są odpowiedzialne za tworzenie prostanoidów w organizmie człowieka, są celem wielu leków przeciwbólowych z grupy NLPZ . Hamowanie COX prowadzi do zmniejszenia stanu zapalnego i ma działanie przeciwbólowe dzięki obniżonemu poziomowi syntezy prostaglandyn i tromboksanu.