Dioksygenaza cysteinowa
| Dioksygenaza cysteinowa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Ludzki CDO (zaczerpnięty z PDB 2IC1)
| |||||||||
| Identyfikatory | |||||||||
| nr WE | 1.13.11.20 | ||||||||
| nr CAS | 37256-59-0 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| |||||||||
| dioksygenaza cysteinowa, typ I | |||||||
|---|---|---|---|---|---|---|---|
 Dioksygenaza cysteinowa 1, monomer, ludzkie
| |||||||
| identyfikatory | |||||||
| Symbol | CDO1 | ||||||
| gen NCBI | 1036 | ||||||
| HGNC | 1795 | ||||||
| OMIM | 603943 | ||||||
| RefSeq | NM_001801 | ||||||
| UniProt | Q16878 | ||||||
| Inne dane | |||||||
| numer WE | 1.13.11.20 | ||||||
| Umiejscowienie | Chr. 5 q23.2 | ||||||
| |||||||
Dioksygenaza cysteinowa ( CDO ) jest niehemowym enzymem żelaza , który katalizuje konwersję L- cysteiny do kwasu cysteinosulfinowego (sulfinian cysteiny). CDO odgrywa ważną rolę w katabolizmie cysteiny, regulując wewnątrzkomórkowe poziomy cysteiny i reagując na zmiany w dostępności cysteiny. W związku z tym CDO jest wysoce regulowany i podlega dużym zmianom w koncentracji i wydajności. Utlenia cysteinę do odpowiedniego kwasu sulfinowego poprzez aktywację tlenu ditlenowego , chociaż dokładny mechanizm tej reakcji jest nadal niejasny. Oprócz występowania u ssaków, CDO występuje również w niektórych drożdżach i bakteriach, chociaż dokładna funkcja jest nadal nieznana. CDO jest zamieszany w różne neurodegeneracyjne i nowotwory , co jest prawdopodobnie związane z toksycznością cysteiny.
Funkcjonować
CDO jest odpowiedzialny za pierwszy główny etap metabolizmu cysteiny. CDO utlenia się do cysteino-kwasu sulfinowego (który występuje in vivo głównie w postaci anionowego sulfinianu ). Ogólnie rzecz biorąc, CDO katalizuje dodanie tlenu ditlenowego (O 2 ) do tiolu , z wytworzeniem kwasu sulfinowego . Dokładniej, CDO należy do grupy niehemowych oksygenaz żelaza, które wykorzystują tlen jako akceptor elektronów. Kwas cysteinosulfonowy jest następnie dalej metabolizowany dwoma rozbieżnymi szlakami: dekarboksylowany do hipotauryny przez dekarboksylazę sulfinoalaniny i utleniany do tauryny przez dehydrogenazę hipotauryny ; lub transaminowany do przypuszczalnego związku pośredniego 3-sulfinylopirogronianu, który samorzutnie rozkłada się na pirogronian i siarczyn . Siarczyn można następnie utlenić do siarczanu przez oksydazę siarczynową . Zatem CDO jest niezbędny do produkcji hipotauryny/tauryny i siarczynów/siarczanów. Rola CDO może się różnić w zależności od typu komórek, ponieważ może być wykorzystywana głównie do produkcji tauryny lub siarczanów lub do degradacji cysteiny.
Struktura
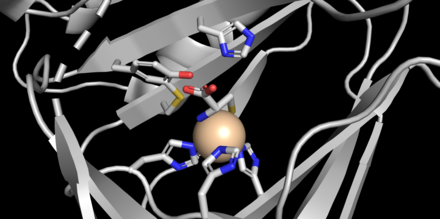
CDO jest białkiem o masie cząsteczkowej 22,5 kDa, które zawiera 200 reszt aminokwasowych i ma punkt izoelektryczny (pI) równy 5,5. Pierwszorzędowa struktura jest wysoce konserwatywna między gatunkami ssaków, przy czym mysi i ludzki CDO różnią się tylko 16 resztami. CDO jest częścią nadrodziny cupinów , której członkowie posiadają 6-niciową beczkę β w topologii „jelly-roll”. Struktury krystaliczne białka uzyskano przy rozdzielczości 1,5 Å (mysz). Miejsce aktywne wykazuje unikalną geometrię, w której zamiast typowej triady twarzy dwóch histydyn i jednego łańcucha bocznego karboksylanu koordynującego z żelazem (II), trzy ligandy histydynowe są związane z żelazem. Ponadto struktury krystaliczne pokazują azot aminowy i siarkę tiolanową cysteiny skoordynowane z żelazem oprócz pojedynczej cząsteczki wody (patrz rysunek).
CDO zawiera unikalny wewnętrzny kofaktor powstały w wyniku wewnątrzcząsteczkowego tworzenia tioeteru pomiędzy Cys93 i Tyr157, który ma uczestniczyć w katalizie. Kiedy białko zostało wyizolowane po raz pierwszy, zaobserwowano dwa prążki na żelu agarozowym , odpowiadające odpowiednio białku zawierającemu kofaktor i niezwiązanemu „niedojrzałemu” białku. Sieciowanie zwiększa wydajność CDO dziesięciokrotnie i jest regulowane przez poziomy cysteiny, niezwykły przykład tworzenia kofaktora białka, w którym pośredniczy substrat (aktywacja wyprzedzająca).
Mechanizm
Mechanizm CDO nadal nie jest dobrze poznany, pomimo aktywnych badań mających na celu wyjaśnienie szczegółów reakcji. Ogólnie rzecz biorąc, reakcja polega na dodaniu O2 do cysteiny, co zachodzi spontanicznie bez katalizy enzymatycznej. Badania wykazały, że mostek cysteinylotyrozynowy obniża potencjał utleniający tyrozyny (powszechnie donora elektronów, jak w fotosystemie II ) o ~0,5 V w stosunku do fenolu i zwiększa jego kwasowość. Ugrupowanie tioeterowe prawdopodobnie odgrywa rolę strukturalną, redoks lub kwasowo-zasadową. Inne badania wykazały, że Tyr157 jest potrzebny do funkcjonowania enzymu (prawdopodobnie jako rodnik tyrozynylowy) i jest wysoce konserwatywny we wszystkich wariantach CDO. Ponadto badania wykazały, że cysteamina , strukturalnie podobna cząsteczka do cysteiny, zwiększa utlenianie cysteiny, ale nie jest substratem.
Jeden z proponowanych mechanizmów, poparty badaniami obliczeniowymi i spektroskopowymi, obejmuje wiązanie O2 cis z tiolanem w celu utworzenia reaktywnych form żelaza (III)-superokso ( A ) , które następnie atakuje związaną siarkę cysteiny, tworząc czteroczłonową strukturę pierścieniową ( B. ). Heterolityczne rozszczepienie wiązania OO daje następnie wysokowartościowy żelazo (IV) okso pośredni ( C ), który przenosi drugi tlen do siarki.
Rozporządzenie
CDO jest ściśle regulowany w komórce, aby utrzymać homeostazę cysteiny. W szczególności CDO reaguje na zmiany w dostępności cysteiny w diecie i spożyciu białka, utrzymując zmniejszoną aktywność przy niskich poziomach cysteiny i zwiększoną aktywność przy wysokich poziomach, aby zapobiec cytotoksyczności. Badania wykazały, że CDO może wykazywać dramatyczny wzrost aktywności wątroby w ciągu kilku godzin. W przeciwieństwie do wielu enzymów, jest regulowany głównie na poziomie obrotu białka, a nie transkrypcji (poziomy mRNA). Wysokie poziomy cysteiny hamują ubikwitynylację , co obniża szybkość degradacji proteasomów . CDO jest również regulowany w tkance tłuszczowej, gdzie wysoki poziom cysteiny powoduje zwiększoną produkcję hipotauryny/tauryny. Uważa się również, że regulacja CDO obejmuje zarówno usieciowane, jak i niedojrzałe formy białka.
Istotność choroby
Ze względu na znaczenie dla metabolizmu cysteiny, zmiany w aktywności CDO mogą powodować choroby u ludzi. Badania wykazały, że podwyższony poziom cysteiny może być cytotoksyczny , neurotoksyczny i ekscytotoksyczny . Nieprawidłowa lub niedostateczna aktywność CDO została powiązana z chorobą Alzheimera , chorobą Parkinsona , reumatoidalnym zapaleniem stawów i chorobami neuronów ruchowych. W tych chorobach pacjenci wykazują obniżony poziom siarczanów, podwyższone stężenie cysteiny w osoczu na czczo i inne objawy zgodne z upośledzonym utlenianiem cysteiny. Niedobór CDO i późniejsza akumulacja cysteiny w gałce bladej została powiązana z neurodegeneracją związaną z kinazą pantotenianową .
Ekspresja CDO jest zmieniona w komórkach rakowych i wykazano, że metylacja genu promotora CDO1 (ludzka dioksygenaza cysteinowa typu I) występuje w raku okrężnicy, piersi, przełyku, płuc, pęcherza moczowego i żołądka. Wyciszanie CDO1 jest krytycznym wydarzeniem epigenetycznym w raku piersi, prowadzącym do obniżenia aktywności CDO1. W szczególności, zmniejszona aktywność CDO1 powoduje wzrost siarkowodoru (H 2 S), który został powiązany z różnymi chorobami. Wyniki te sugerują, że CDO1 (ludzka dioksygenaza cysteinowa typu I) działa jako gen supresorowy guza i może potencjalnie służyć jako biomarker raka.
Linki zewnętrzne
- CDO1 w przeglądarce genomu UCSC .
- Szczegóły ludzkiego genu CDO1 w przeglądarce genomu UCSC .