Białko Rieske
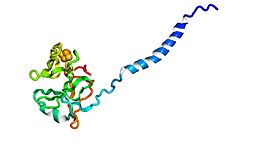 Białko Rieske z kompleksu cytochromu b6f . ()
| |||||||||
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Symbol | Rieske | ||||||||
| Pfam | PF00355 | ||||||||
| InterPro | IPR005806 | ||||||||
| PROZYTA | PDOC00177 | ||||||||
| SCOP2 | 1rie / SCOPe / SUPFAM | ||||||||
| TCDB | 3.E.2 | ||||||||
| Nadrodzina OPM | 92 | ||||||||
| Białko OPM | 1q90 | ||||||||
| CDD | cd03467 | ||||||||
| |||||||||
| Kompleks cytochromu B6-F podjednostka Fe-S, | |||||||||
|---|---|---|---|---|---|---|---|---|---|
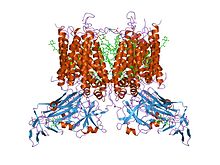 struktura krystaliczna alfa helikalnej domeny transbłonowej kompleksu cytochromu b6f z m.laminosus
| |||||||||
| Identyfikatory | |||||||||
| Symbol | CytB6-F_Fe-S | ||||||||
| Pfam | PF08802 | ||||||||
| InterPro | IPR014909 | ||||||||
| |||||||||
Białka Rieske są składnikami białek żelazowo-siarkowych (ISP) kompleksów cytochromu bc 1 i kompleksów cytochromu b 6 f i są odpowiedzialne za przenoszenie elektronów w niektórych układach biologicznych. John S. Rieske i współpracownicy jako pierwsi odkryli to białko iw 1964 roku wyizolowali acetylowaną postać bydlęcego białka mitochondrialnego . W 1979 roku laboratorium Trumpowera wyizolowało „czynnik utleniania” z bydlęcych mitochondriów
i wykazał, że jest to rekonstytucyjnie aktywna forma białka żelazowo-siarkowego Rieske. Jest to unikalny klaster [2Fe-2S], ponieważ jeden z dwóch atomów Fe jest koordynowany raczej przez dwie reszty histydyny niż dwie reszty cysteiny . Od tego czasu znaleziono je w roślinach, zwierzętach i bakteriach o szerokim zakresie potencjałów redukcji elektronów od -150 do +400 mV.
Funkcja biologiczna
Reduktaza ubichinolu-cytochromu-c (znana również jako kompleks bc1 lub kompleks III) jest kompleksem enzymów bakteryjnych i mitochondrialnych systemów fosforylacji oksydacyjnej . Katalizuje reakcję utleniania-redukcji ruchomych składników ubichinolu i cytochromu c , przyczyniając się do elektrochemicznej różnicy potencjałów w wewnętrznej lub bakteryjnej błonie mitochondrialnej , która jest powiązana z syntezą ATP .
Kompleks składa się z trzech podjednostek w większości bakterii i dziewięciu w mitochondriach: zarówno kompleksy bakteryjne, jak i mitochondrialne zawierają podjednostki cytochromu b i cytochromu c1 oraz podjednostkę żelazowo-siarkową „Rieske”, która zawiera klaster 2Fe-2S o wysokim potencjale. Forma mitochondrialna obejmuje również sześć innych podjednostek, które nie posiadają centrów redoks. Plastochinon – reduktaza plastocyjaninowa (kompleks b6f), obecna w sinicach i chloroplastach roślin, katalizuje oksydoredukcję plastochinol i cytochrom f . Kompleks ten, funkcjonalnie podobny do reduktazy ubichinol-cytochrom c , zawiera podjednostki cytochromu b6, cytochromu f i Rieske.
Podjednostka Rieske działa poprzez wiązanie anionu ubichinolu lub plastochinolu , przenosząc elektron do klastra 2Fe-2S, a następnie uwalniając elektron do cytochromu c lub cytochromu f żelaza hemowego . Redukcja centrum Rieskego zwiększa powinowactwo podjednostki o kilka rzędów wielkości, stabilizując rodnik semichinonowy w miejscu Q(P). Domena Rieske ma centrum [2Fe-2S]. Dwie konserwowane cysteiny koordynują jeden jon Fe, podczas gdy drugi jon Fe jest koordynowany przez dwie konserwatywne histydyny. Klaster 2Fe-2S jest związany w wysoce konserwatywnym regionie C-końcowym podjednostki Rieske.
Rodzina białek Rieske
Homologi białek Rieske obejmują składniki ISP kompleksu cytochromu b6f benzenowe toluenowe , dioksygenazy hydroksylujące pierścienie aromatyczne (dioksygenazy ftalanowe, , naftalenowe i 1,2-dioksygenazy) oraz oksydazę arseninową ( EC 1.20.98.1 ) . Porównanie sekwencji aminokwasowych ujawniło następującą sekwencję konsensusową:
- Cys-Xaa-His-(Xaa) 15–17 -Cys-Xaa-Xaa-His
Struktura 3D
Znane są struktury krystaliczne wielu białek Rieske. Cały fałd, składający się z dwóch subdomen, jest zdominowany przez antyrównoległą strukturę β i zawiera zmienną liczbę α-helis . Mniejsze subdomeny „wiążące klastry” w białkach mitochondrialnych i chloroplastowych są praktycznie identyczne, podczas gdy duże subdomeny są zasadniczo różne pomimo wspólnej topologii fałdowania. [Fe 2 S 2 ] wiążące klastry mają topologię niekompletnej antyrównoległej beczki β. Jeden atom żelaza Rieske [Fe 2 S 2 ] klaster w domenie jest koordynowany przez dwie reszty cysteiny , a drugi jest koordynowany przez dwie reszty histydyny przez atomy N δ . Ligandy koordynujące klaster pochodzą z dwóch pętli; każda pętla wnosi jeden Cys i jeden His.
podrodziny
- Białko żelazowo-siarkowe Rieske, C-końcowy InterPro : IPR005805
- Oksydaza arseninowa, mała podjednostka InterPro : IPR014067
Białka ludzkie zawierające tę domenę
Dalsza lektura
- Iwata S, Saynovits M, Link TA, Michel H (maj 1996). „Struktura rozpuszczalnego w wodzie fragmentu białka żelazowo-siarkowego„ Rieske ” kompleksu mitochondrialnego cytochromu bc1 serca bydlęcego określona przez fazowanie MAD przy rozdzielczości 1,5 A” . Struktura . 4 (5): 567–79. doi : 10.1016/S0969-2126(96)00062-7 . PMID 8736555 .
- Huang JT, Struck F, Matzinger DF, Levings CS (grudzień 1991). „Analiza funkcjonalna w drożdżach cDNA kodującego mitochondrialne białko żelazowo-siarkowe Rieske roślin wyższych” . proc. Natl. Acad. nauka USA . 88 (23): 10716–20. Bibcode : 1991PNAS...8810716H . doi : 10.1073/pnas.88.23.10716 . PMC53001 . _ PMID 1961737 .
- Brandt U, Yu L, Yu CA, Trumpower BL (kwiecień 1993). „Presekwencja kierowania mitochondrialnego białka żelazowo-siarkowego Rieske jest przetwarzana w jednym etapie po wstawieniu do kompleksu cytochromu bc1 u ssaków i zatrzymywana jako podjednostka w kompleksie” . J. Biol. chemia . 268 (12): 8387–90. doi : 10.1016/S0021-9258(18)52883-0 . PMID 8386158 .
-
Ferraro, DJ, Gakhar, L. i Ramaswamy, S. (2005). „Biznes Rieske: struktura-funkcja oksygenaz niehemowych Rieske”. Biochem. Biofiza. Rez. Komuna . 338 (1): 175–190. doi : 10.1016/j.bbrc.2005.08.222 . PMID 16168954 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) - Mason, JR i Cammack, R. (1992). „Białka transportujące elektrony hydroksylujących dioksygenaz bakteryjnych”. rok Wielebny Microbiol . 46 : 277–305. doi : 10.1146/annurev.mi.46.100192.001425 . PMID 1444257 .
- Schmidt, CL (2004). „Rieske białka żelazowo-siarkowe z organizmów ekstremofilnych”. J. Bioenerg. Biomembr . 36 (1): 107–113. doi : 10.1023/B:JOBB.0000019602.96578.78 . PMID 15168614 . S2CID 23790442 .
- Schneider, D. & Schmidt, CL (2005). „Wiele białek Rieske u prokariotów: gdzie i dlaczego?” . Biochim. Biofiza. Akta . 1710 (1): 1–12. doi : 10.1016/j.bbabio.2005.09.003 . PMID 16271700 .
-
Brown, EN i Friemann, R. i Karlsson, A. i Parales, JV i Couture, MM i Eltis, LD i Ramaswamy, S. (2008). „Określanie potencjałów redukcji klastrów Rieske”. J. Biol. Inorg. chemia . 13 (8): 1301–1313. doi : 10.1007/s00775-008-0413-4 . PMID 18719951 . S2CID 3303144 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link )
Linki zewnętrzne
- - Struktura rentgenowska białka Rieske (fragment rozpuszczalny w wodzie) bydlęcego mitochondrialnego kompleksu cytochromu bc 1
- - Struktura rentgenowska białka Rieske (fragment rozpuszczalny w wodzie) szpinakowego kompleksu chloroplastów cytochromu b 6 f
- - Struktura rentgenowska ferredoksyny typu Rieske związanej z dioksygenazą bifenylową z Burkholderia cepacia
- - Rentgenowska struktura podjednostki Rieske oksydazy arseninowej z Alcaligenes faecalis
- - Rentgenowska struktura ferredoksyny Sphingomonas yanoikuyae B1 Rieske
- - Struktura rentgenowska ferredoksyny Pseudomonas naftalenu 1,2-dioksygenazy Rieske
- InterPro : IPR005806 — wpis InterPro dla regionu Rieske [2Fe-2S]
