Dendralen
Dendralen jest dyskretnym acyklicznym krzyżowo sprzężonym polienem . Najprostszym dendralenem jest buta-1,3-dien (1) lub [2] dendralen, po którym następuje [3] dendralen (2), [4] dendralen (3) i [5] dendralen (4) i tak dalej. [2] dendralen (butadien) jako jedyny nie jest sprzężony krzyżowo.
Nazwa dendralen pochodzi od słów dendrymer , liniowy i alken . Wyższe dendraleny są przedmiotem zainteresowania naukowego, ponieważ otwierają szeroki wachlarz nowych związków organicznych ze stosunkowo prostego prekursora, zwłaszcza w chemii Dielsa-Aldera . Ich cykliczne odpowiedniki są trafnie nazywane radialenami .
Synteza
Winylobutadien ([3] dendralen) został po raz pierwszy przygotowany w 1955 roku przez pirolizę trioctanu:
Związek ten reaguje z dwoma równoważnikami bezwodnika maleinowego w tandemowej reakcji DA:
W przypadku benzochinonu produktem reakcji był liniowy polimer.
Opisano kilka syntez podstawionych [3] dendralenów, jedną za pośrednictwem allenu , jedną w reakcji Hornera – Wadswortha – Emmonsa , jedną w reakcji sprzęgania krzyżowego i jedną z węglanu allilu.
Jedna droga syntezy do [4] dendralenu zaczyna się od chloroprenu . Związek ten jest przekształcany w odczynnik Grignarda przez działanie metalicznego magnezu , który następnie poddaje się reakcji z chlorkiem miedzi (I) do półproduktu miedzioorganicznego , który z kolei jest dimeryzowany przy użyciu chlorku miedzi (II) w utleniającej reakcji sprzęgania, dając dimer butadienu zwany [ 4]dendralen.
Opisano strukturę molekularną [4] dendralenu w fazie gazowej
Związek [8]-dendralenowy został zgłoszony w 2009 roku:
w kolejnych sprzężeniach Kumada – Tamao – Corriu i sprzęganiu Negishi .
Seria [9] do [12] -dendralenów została zgłoszona w 2016 roku
Nieruchomości
Parzystoczłonowe dendraleny (np. [6]dendralen, [8]dendralen) mają tendencję do zachowywania się jak łańcuchy oddzielonych i izolowanych jednostek dienowych . Maksima absorpcji w ultrafiolecie są równe maksimom samego butadienu. Dendraleny o nieparzystej liczbie alkenowych są bardziej reaktywne ze względu na obecność korzystnych konformacji s-cis dienowych, a reakcje Dielsa-Aldera zachodzą łatwiej z preferencją dla końców.
Reakcje
Dzięki prostym dienofilom dendraleny mogą zapewniać szybki dostęp do złożonych cząsteczek w reakcjach Dielsa-Aldera . Zgłoszono kilka schematów reakcji
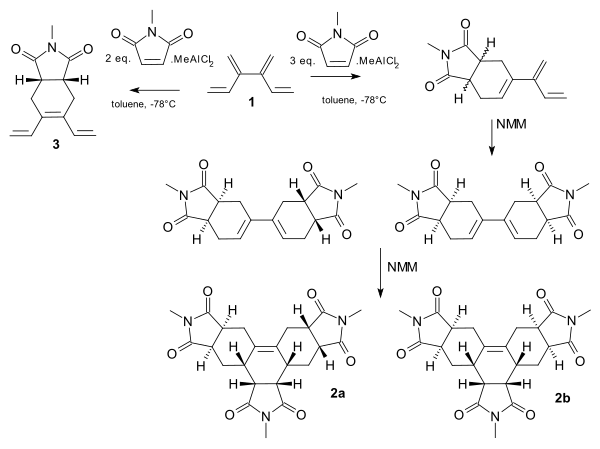
[4] dendralen wykazuje tandemową reakcję Dielsa-Aldera z dienofilowym N-metylo-maleimidem (NMM). Pełna selektywność względem miejsca jest możliwa po dodaniu kwasu Lewisa . Przy jednym zestawie wstępnego mieszania i 2 równoważnikach NMM centralna grupa dienowa jest kierowana do monoadduktu 3 . Przy innym zestawie i większej ilości dienofili grupy końcowe reagują i reakcja przebiega od monoadduktu do trisadduktów 2 i 2b .
Jedną z odmian reakcji jest cyklopropanacja do klasy związków zwanych bluszczami z opisaną syntezą w reakcji Simmonsa-Smitha ( dietylocynk / kwas trifluorooctowy ) pierwszych 6 członków. Te 1,1-oligocyklopropany są stabilne (z wyjątkiem sytuacji, gdy są wystawione na działanie kwasów) i mają duże ciepło spalania z [6] bluszczem przekraczającym kuban . Łańcuchy oligocyklopropanu przyjmują konformację spiralną. W przypadku [3] dendralenu odnotowano fotochemiczną reakcję cyklizacji
Pochodne
Opisano związek bicykliczny [4] dendralenowy.



![[4]dendralene synthetic scheme from chloroprene](http://upload.wikimedia.org/wikipedia/commons/thumb/4/40/4-dendralene.svg/569px-4-dendralene.svg.png)
![[8]-dendralene synthesis](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9d/8-dendralene.svg/411px-8-dendralene.svg.png)