Reakcja kaskadowa

Reakcja kaskadowa , znana również jako reakcja domina lub reakcja tandemowa , jest procesem chemicznym, który obejmuje co najmniej dwie następujące po sobie reakcje, tak że każda następna reakcja zachodzi tylko dzięki chemicznej funkcyjności utworzonej w poprzednim etapie. W reakcjach kaskadowych nie jest wymagana izolacja związków pośrednich, ponieważ każda reakcja tworząca sekwencję zachodzi spontanicznie. W najściślejszej definicji tego terminu warunki reakcji nie zmieniają się pomiędzy kolejnymi etapami kaskady i żadne nowe reagenty nie są dodawane po etapie początkowym. Natomiast procedury jednonaczyniowe podobnie pozwalają na przeprowadzenie co najmniej dwóch reakcji kolejno bez jakiejkolwiek izolacji związków pośrednich, ale nie wykluczają dodania nowych odczynników lub zmiany warunków po pierwszej reakcji. Zatem każda reakcja kaskadowa jest również procedurą jednonaczyniową, podczas gdy sytuacja odwrotna nie jest prawdziwa. Chociaż często składają się wyłącznie z przemian wewnątrzcząsteczkowych, reakcje kaskadowe mogą również zachodzić międzycząsteczkowo, w którym to przypadku również należą do kategorii reakcji wieloskładnikowych .
Główne zalety sekwencji kaskadowych to wysoka ekonomia atomowa i redukcja odpadów generowanych przez kilka procesów chemicznych, a także czasu i pracy wymaganej do ich przeprowadzenia. Wydajność i użyteczność reakcji kaskadowej można mierzyć liczbą wiązań utworzonych w całej sekwencji, stopniem wzrostu złożoności strukturalnej w procesie oraz jej przydatnością do szerszych klas substratów.
Najwcześniejszym przykładem reakcji kaskadowej jest prawdopodobnie synteza tropinonu opisana w 1917 roku przez Robinsona . Od tego czasu wykorzystanie reakcji kaskadowych rozpowszechniło się w obszarze syntezy całkowitej. Podobnie, rozwój metodologii organicznej opartej na kaskadzie również ogromnie się rozwinął. To zwiększone zainteresowanie sekwencjami kaskadowymi znajduje odzwierciedlenie w licznych odpowiednich artykułach przeglądowych opublikowanych w ciągu ostatnich kilku dekad. Coraz większym obszarem zainteresowania jest rozwój katalizy asymetrycznej procesów kaskadowych z wykorzystaniem chiralnych organokatalizatorów lub chiralnych kompleksów metali przejściowych.
Klasyfikacja reakcji kaskadowych jest czasami trudna ze względu na zróżnicowany charakter wielu etapów transformacji. KC Nicolaou określa kaskady jako nukleofilowe/elektrofilowe, rodnikowe, pericykliczne lub katalizowane metalami przejściowymi, w oparciu o mechanizm zachodzących etapów. W przypadkach, w których kaskada obejmuje dwie lub więcej klas reakcji, rozróżnienie staje się raczej arbitralne, a proces jest oznaczany zgodnie z tym, co można prawdopodobnie uznać za „główny temat”. Aby podkreślić niezwykłą użyteczność syntetyczną reakcji kaskadowych, większość poniższych przykładów pochodzi z całkowitych syntez złożonych cząsteczek.
Kaskady nukleofilowe/elektrofilowe
Kaskady nukleofilowe/elektrofilowe definiuje się jako sekwencje kaskadowe, w których kluczowym etapem jest atak nukleofilowy lub elektrofilowy.
Przykładem takiej kaskady jest krótka enancjoselektywna synteza antybiotyku o szerokim spektrum (-)-chloramfenikolu, opisana przez Rao i in. (Schemat 1). Tutaj chiralny alkohol epoksydowy 1 najpierw potraktowano dichloroacetonitrylem w obecności NaH. Powstały związek pośredni 2 następnie przeszedł kaskadową reakcję, w której pośredniczy BF3 · Et2O . Wewnątrzcząsteczkowe otwarcie pierścienia epoksydowego dało związek pośredni 3 , który po hydrolizie in situ ułatwionej nadmiarem BF 3 ·Et 2 O dał (–)-chloramfenikol ( 4 ) z ogólną wydajnością 71%.
Kaskadę nukleofilową wykorzystano również w całkowitej syntezie pentalenu, produktu naturalnego (schemat 2). W tej procedurze kwadratowy ester 5 potraktowano (5-metylocyklopent-1-en-1-ylo)litem i propynylolitem . Dwa ataki nukleofilowe wystąpiły głównie z dodatkiem trans , z wytworzeniem związku pośredniego 6 , który spontanicznie przeszedł elektrocykliczne otwarcie 4π-konrotacyjne pierścienia cyklobutenu. Powstały skoniugowany gatunek 7 zrównoważył się z konformerem 8 , który łatwiej ulegał elektrocyklizacji 8π-konrotacyjnej do silnie naprężonego produktu pośredniego 9 . Selektywnie uzyskano potencjał do uwolnienia ukierunkowanej na szczep protonacji 9 , tak że gatunek 10 . Kaskada została zakończona przez wewnątrzcząsteczkową kondensację aldolową, która dała produkt 11 z całkowitą wydajnością 76%. Dalsze opracowanie dało docelowy (±)-pentalen ( 12 ).
Kaskady organokatalityczne
Podkategorię sekwencji nukleofilowych/elektrofilowych tworzą kaskady organokatalityczne, w których kluczowy atak nukleofilowy jest napędzany przez organokatalizę.
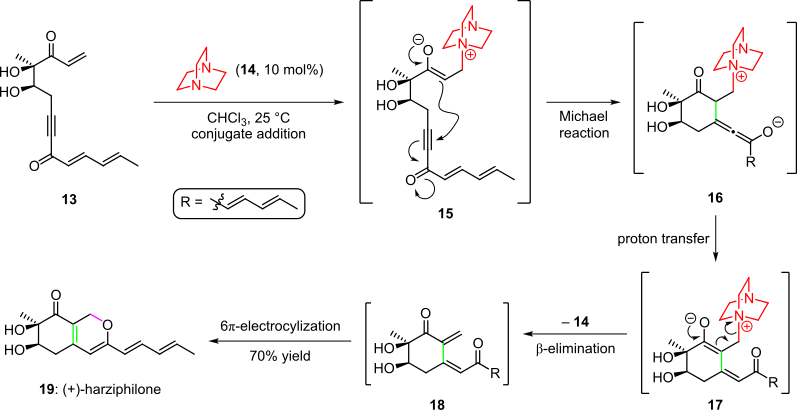
W całkowitej syntezie naturalnego produktu, harzifilonu, zastosowano kaskadę organokatalityczną, opisaną przez Sorensen i in. w 2004 r. (schemat 3). Tutaj traktowanie materiału wyjściowego enonu 13 katalizatorem organicznym 14 dało związek pośredni 15 poprzez dodanie koniugatu. Późniejsza cyklizacja przez wewnątrzcząsteczkowe dodanie enolanu przez Michaela do potrójnego wiązania układu dało związek 16 , który po przeniesieniu protonu i tautomeryzacji dał związek pośredni 17 . Kaskada została zakończona przez eliminację katalizatora organicznego i spontaniczne zamknięcie pierścienia elektrocyklicznego 6π powstałego cis -dienonu 18 do (+)-harzifilonu ( 19 ) z całkowitą wydajnością 70%.
Znakomita potrójna kaskada organokatalityczna została opisana przez Raabe i in. w 2006 r. Liniowe aldehydy ( 20 ), nitroalkeny ( 21 ) i α , β -nienasycone aldehydy ( 22 ) można skondensować razem organokatalitycznie, aby uzyskać tetra -podstawione cykloheksanokarboaldehydy ( 24 ) z diastereoselektywnością od umiarkowanej do doskonałej i całkowitą kontrolą enancjomeryjną (schemat 4) . Transformacja odbywa się za pośrednictwem łatwo dostępnego organokatalizatora pochodzącego z proliny 23 .
Zaproponowano, aby transformacja przebiegała poprzez sekwencję addycja Michaela/addycja Michaela/kondensacja aldolowa (Schemat 5). W pierwszym etapie Michael dodaje aldehyd 20 do nitroalkenu 21 poprzez katalizę enaminową, dając nitroalkan 25 . Kondensacja α , β -nienasyconego aldehydu 22 z katalizatorem organicznym ułatwia następnie dodanie koniugatu 25 z wytworzeniem pośredniej enaminy 26 , która jest podatna na wewnątrzcząsteczkową kondensację aldolową do form iminiowych 27 . Organokatalizator 23 jest regenerowany przez hydrolizę wraz z produktem 24 , zamykając w ten sposób cykl potrójnej kaskady.
Radykalne kaskady
Radykalne kaskady to takie, w których kluczowym krokiem jest radykalna reakcja. Wysoka reaktywność form wolnych rodników sprawia, że podejścia syntetyczne oparte na rodnikach zdecydowanie nadają się do reakcji kaskadowych.
Jednym z najbardziej znanych przykładów syntetycznej użyteczności kaskad rodnikowych jest sekwencja cyklizacji zastosowana w całkowitej syntezie (±)-hirsutenu w 1985 r. (Schemat 6). Tutaj jodek alkilu 28 został przekształcony w pierwszorzędowy rodnik pośredni 29 , który przeszedł cyklizację 5- egzo -trig z wytworzeniem reaktywnych form 30 . Kolejna 5- egzo -dig rodnikowa cyklizacja doprowadziła do związku pośredniego 31 , który po wygaszeniu dał docelowy (±)-hirsuten ( 32 ) z całkowitą wydajnością 80%.
W jednej z całkowitych syntez (–)-morfiny zastosowano również kaskadowy proces rodnikowy (Schemat 7). Bromek arylu 33 przekształcono w odpowiedni rodnik 34 przez traktowanie wodorkiem tri- n -butylocyny. Następnie nastąpiła cyklizacja 5- egzo -trig, dająca związek pośredni 35 stereoselektywnie na mocy stereochemii wiązania eterowego. W następnym etapie kaskady ograniczenia geometryczne 35 zabraniają preferowanej kinetycznie ścieżki cyklizacji 5- egzo -trig; zamiast tego drugorzędowy rodnik benzylowy 36 otrzymano poprzez geometrycznie dozwoloną cyklizację 6- endo -trig. Późniejsza eliminacja rodnika fenylosulfinylowego dała produkt 37 z ogólną wydajnością 30%, który został dalej przetworzony w (-)-morfinę ( 38 ).
Kaskady pericykliczne
Prawdopodobnie najczęściej spotykany rodzaj procesu w przemianach kaskadowych, reakcje pericykliczne obejmują cykloaddycje, reakcje elektrocykliczne i przegrupowania sigmatropowe. Chociaż niektóre z wyżej wymienionych przypadków kaskad nukleofilowych / elektrofilowych i rodnikowych obejmowały procesy pericykliczne, ta sekcja zawiera tylko sekwencje kaskadowe, które składają się wyłącznie z reakcji pericyklicznych lub w których taka reakcja prawdopodobnie stanowi kluczowy etap.
Reprezentatywnym przykładem kaskady pericyklicznej jest kaskada kwasu endiandrowego opisana przez Nicolaou i in. w 1982 r. (schemat 8). Tutaj wysoce nienasycony układ 39 został najpierw uwodorniony do sprzężonych form tetraenowych 40 , które po podgrzaniu uległy 8π-konrotacyjnemu elektrocyklicznemu zamknięciu pierścienia, dając cykliczny związek pośredni 41 . Druga spontaniczna elektrocyklizacja, tym razem 6π-dysrotacyjne zamknięcie pierścienia, przekształciła 41 w formy bicykliczne 42 , których geometria i stereochemia sprzyjały późniejszej wewnątrzcząsteczkowej reakcji Dielsa-Aldera. W ten sposób otrzymano ester metylowy kwasu endiandrowego B ( 43 ) z ogólną wydajnością 23%.
Sekwencję pericykliczną obejmującą wewnątrzcząsteczkowe reakcje heterocykloaddycji zastosowano w całkowitej syntezie naturalnie występującej alkaloidu (-) -windorozyny (Schemat 9). Szybki dostęp do celu uzyskano z roztworu 1,3,4-oksadiazolu 44 w triizopropylobenzenie poddanego działaniu wysokich temperatur i obniżonego ciśnienia. Najpierw zaszła reakcja hetero-Dielsa-Aldera z odwrotnym zapotrzebowaniem na elektrony, dając związek pośredni 45 . Termodynamicznie korzystna utrata azotu generowała związki zawierające 1,3-dipol 46 . Spontaniczna wewnątrzcząsteczkowa cykloaddycja [3+2] 1,3-dipolu i układu indolowego utworzyła następnie endo -produkt 47 z całkowitą wydajnością 78%. Dalsza obróbka dała docelowy produkt naturalny 48 .
Całkowita synteza (-)-kolombiazyny A opisana w 2005 roku przez grupę Harrowvena obejmowała kaskadę elektrocykliczną (schemat 10). Po poddaniu działaniu ciepła za pomocą promieniowania mikrofalowego kwadratowa pochodna 49 przeszła elektrocykliczne otwarcie pierścienia cyklobutenu, po którym nastąpiło 6π-elektrocykliczne zamknięcie pierścienia, które dało bicykliczny związek pośredni 51 . Ich tautomeryzacja dała związki aromatyczne 52 , które po wystawieniu na działanie powietrza zostały utlenione do produktu 53 z całkowitą wydajnością 80%. Docelową (-)-kolombiazynę A ( 54 ) otrzymano następnie z 53 poprzez wspomaganą termicznie reakcję Dielsa-Aldera, po której nastąpiło rozszczepienie tert -butylowej grupy zabezpieczającej.
Niektóre [2,2]paracyklofany można również otrzymać za pomocą kaskad pericyklicznych, jak podała grupa Hopf w 1981 r. (Schemat 11). W tej sekwencji reakcja Dielsa-Aldera między 1,2,4,5-heksatetraenem 55 i dienofilem 56 najpierw utworzyła wysoce reaktywny związek pośredni 57 , który następnie dimeryzował dając [2,2]paracyklofan 58 .
Kaskady katalizowane metalami przejściowymi
Sekwencje kaskadowe katalizowane metalami przejściowymi łączą nowość i moc chemii metaloorganicznej z syntetyczną użytecznością i ekonomicznością reakcji kaskadowych, zapewniając jeszcze bardziej pożądane ekologicznie i ekonomicznie podejście do syntezy organicznej.
Na przykład katalizę rodową zastosowano do przekształcenia acyklicznych monoterpenów typu 59 w produkty 4H -chromenowe w kaskadzie hydroformylowania (schemat 12). Po pierwsze, selektywne hydroformylowanie katalizowane rodem wiązania olefinowego z mniejszą zawadą przestrzenną w 59 dało nienasycony aldehyd 60 , który w tych samych warunkach został następnie przekształcony w związek pośredni 61 w reakcji karbonylenu. Po drugim katalizowanym rodem hydroformylowaniu do związków 62 następowała kondensacja z wytworzeniem 4H -chromenowych produktów typu 63 z ogólną wydajnością 40%.
Katalizę rodową zastosowano również do zainicjowania kaskady cyklizacji/cykloaddycji w syntezie tiglianu opisanej przez grupę Daubena (schemat 13). Traktowanie diazoimidu 64 dimerem octanu rodu (II) wygenerowało karbenoid, który dał reaktywny ylid 65 po wewnątrzcząsteczkowej cyklizacji z sąsiednią grupą karbonylową. Następnie spontanicznie wystąpiła wewnątrzcząsteczkowa cykloaddycja [3+2], dając docelowy tiglian 66 .
Formalna wewnątrzcząsteczkowa [4+2] cykloaddycja 1,6-enynów typu 67 , w której pośredniczy kataliza złotem, jest kolejnym przykładem kaskady katalizowanej metalami przejściowymi (schemat 14). Różne 1,6-enyny reagowały w łagodnych warunkach w obecności kompleksów Au(I) 68a – b , dając tricykliczne produkty 69 z wydajnością od umiarkowanej do doskonałej.
Zaproponowano, aby ta formalna cykloaddycja przebiegała w procesie kaskadowym pokazanym na Schemacie 15. Kompleksowanie 1,6-enynu 67 z kationową postacią katalizatora daje związek pośredni 70 , w którym aktywowane wiązanie potrójne jest atakowane przez grupę funkcyjną olefiny, dając podstawiony cyklopropan 71 . Elektrofilowe otwarcie trójczłonowego pierścienia tworzy związki kationowe 72 , które ulegają reakcji typu Friedela-Craftsa, a następnie reromatyzują dając produkt tricykliczny 69 . Ze względu na charakter oddziaływania kompleksów złota z układami nienasyconymi proces ten można również uznać za kaskadę elektrofilową.
Przykład kaskady katalizowanej palladem jest reprezentowany przez asymetryczną cyklizację Hecka polienu stosowaną do wytwarzania (+)-ksestochinonu z triflatu substratu 75 (Schemat 16). Utleniająca addycja wiązania arylotriflatowego do kompleksu palladu(0) w obecności chiralnego ligandu difosfinowego ( S )-binapu daje chiralny kompleks palladu(II) 77 . Po tym etapie następuje dysocjacja anionu triflatowego, asocjacja sąsiedniej olefiny i insercja 1,2 grupy naftylowej do olefiny z wytworzeniem związku pośredniego 79 . Następnie następuje druga insercja migracyjna do pozostałej grupy olefinowej, po której β -eliminacja, dając produkt 81 z całkowitą wydajnością 82% iz umiarkowaną enancjoselektywnością. Katalizator palladowy (0) jest również regenerowany na tym etapie, umożliwiając w ten sposób ponowne zainicjowanie kaskady.
Wieloetapowe reakcje tandemowe
Wieloetapowe reakcje tandemowe (lub reakcje kaskadowe) to sekwencja przemian chemicznych (zwykle więcej niż dwa etapy), które zachodzą kolejno w celu przekształcenia materiału wyjściowego w złożony produkt. Tego rodzaju reakcje organiczne mają na celu konstruowanie trudnych struktur spotykanych w całkowitej syntezie produktów naturalnych .
W całkowitej syntezie spiroketalnego antybiotyku jonoforowego routiennocyny 1 (ryc. 1), centralny szkielet krętka został skonstruowany w wieloetapowej reakcji tandemowej (ryc. 2). Fragment A i fragment B połączono w jednym etapie, tworząc kluczowy związek pośredni G, który można było dalej opracować, aby uzyskać produkt końcowy rutyniennocynę.
W tej reakcji tandemowej zaszły cztery przemiany chemiczne. Po pierwsze, potraktowanie fragmentu A anionem węgla utworzonym przez n-butylolit , który zaatakował część jodku alkilu fragmentu B, aby wytworzyć związek pośredni C (etap 1). Następnie utworzono pochodną 3,4-dihydropiranu D w reakcji eliminacji za pośrednictwem zasady na produkcie pośrednim C (etap 2). Grupę zabezpieczającą na ugrupowaniu 1,3- diolu w produkcie pośrednim D usunięto przez potraktowanie kwasem, otrzymując diolowy produkt E (etap 3). Produkt spiroketalowy G został wygenerowany w reakcji tworzenia wewnątrzcząsteczkowego ketalu . Ta wieloetapowa reakcja tandemowa znacznie uprościła konstrukcję tej złożonej struktury krętkowej i ułatwiła drogę do całkowitej syntezy rutyniennocyny.
Linki zewnętrzne
- Węzły chemiczne w układzie okresowym filmów (University of Nottingham)









![Scheme 11. Pericyclic sequence for the synthesis of [2,2]paracyclophanes](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Scheme_11_-_peri_-_pcyclophane.svg/681px-Scheme_11_-_peri_-_pcyclophane.svg.png)


![Scheme 14. Gold-catalyzed formal intramolecular [4+2] cycloaddition of 1,6-enynes](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2b/Scheme_14_-_metal_-_gold_enyne.svg/481px-Scheme_14_-_metal_-_gold_enyne.svg.png)
![Scheme 15. Proposed cascade process in the formal intramolecular [4+2] cycloaddition of 1,6-enynes](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Scheme_15_-_metal_-_gold_enyne_mech.svg/751px-Scheme_15_-_metal_-_gold_enyne_mech.svg.png)


