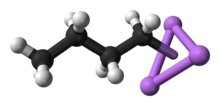
n -Butylolit
|
|||
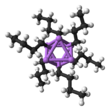
 Zbliżenie zdelokalizowanych wiązań między
|
|||
| nazwami butylu i litu | |||
|---|---|---|---|
|
nazwa IUPAC
butylolit, tetra- μ 3 -butylo-tetralit
|
|||
| Inne nazwy NBL, BuLi, 1-litiobutan |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CHEBI | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.003.363 | ||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C4H9Li _ _ _ _ | |||
| Masa cząsteczkowa | 64,06 g·mol -1 | ||
| Wygląd |
bezbarwna ciecz nietrwała zwykle otrzymywana jako roztwór |
||
| Gęstość | 0,68 g/cm3 , określony rozpuszczalnikiem | ||
| Temperatura topnienia | -76 ° C (-105 ° F; 197 K) (<273 K) | ||
| Temperatura wrzenia | rozkłada się | ||
| Rozkład egzotermiczny | |||
| Rozpuszczalność | Etery, węglowodory, THF | ||
| Kwasowość ( p Ka ) | 50 | ||
| Struktura | |||
| tetrameryczny w roztworze | |||
| 0 D | |||
| Zagrożenia | |||
| Bezpieczeństwo i higiena pracy (BHP): | |||
|
Główne zagrożenia
|
Piroforyczny (spontanicznie spala się w powietrzu), rozkłada się do żrącego LiOH |
||
| NFPA 704 (ognisty diament) | |||
| Związki pokrewne | |||
|
Powiązane odczynniki litoorganiczne
|
sec -butylolit tert -butylolit heksylolit metylolit |
||
|
Związki pokrewne
|
wodorotlenek litu | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
n -Butylolit C 4 H 9 Li (w skrócie n -BuLi ) jest odczynnikiem litoorganicznym . Jest szeroko stosowany jako polimeryzacji w produkcji elastomerów takich jak polibutadien czy styren-butadien-styren (SBS) . Jest również szeroko stosowany jako mocna zasada ( superzasada ) w syntezie związków organicznych, jak w przemyśle farmaceutycznym.
Butylolit jest dostępny w handlu w postaci roztworów (15%, 25%, 1,5 M , 2 M, 2,5 M, 10 M itd.) W alkanach, takich jak pentan , heksany i heptany . Można przygotować roztwory w eterze dietylowym i THF , ale nie są one wystarczająco stabilne do przechowywania. Roczną światową produkcję i zużycie butylolitu i innych związków litoorganicznych szacuje się na 2000 do 3000 ton.
Chociaż butylolit jest bezbarwny, n -butylolit zwykle występuje w postaci bladożółtego roztworu w alkanach. Takie roztwory są stabilne w nieskończoność, jeśli są odpowiednio przechowywane, ale w praktyce ulegają degradacji podczas starzenia. drobny biały osad ( wodorotlenek litu ), a kolor zmienia się na pomarańczowy.
Struktura i wiązanie
n -BuLi istnieje jako klaster zarówno w stanie stałym, jak iw roztworze. Tendencja do agregacji jest powszechna dla związków litoorganicznych. Agregaty są utrzymywane razem przez zdelokalizowane wiązania kowalencyjne między litem a końcowym węglem łańcucha butylowego. W przypadku n -BuLi klastry są tetrameryczne (w eterze) lub heksameryczne (w cykloheksanie ). Klaster jest zniekształconym klastrem typu kubanowego z grupami Li i CH2R w naprzemiennych wierzchołkach. Równoważny opis opisuje tetramer jako czworościan Li4 przeplatane czworościanem [ CH 2 R ] 4 . Wiązanie w klastrze jest podobne do tego używanego do opisania diboranu, ale jest bardziej złożone, ponieważ zaangażowanych jest osiem atomów. Odzwierciedlając swój bogaty w elektrony charakter, n -butylolit jest wysoce reaktywny w stosunku do kwasów Lewisa .
Ze względu na dużą różnicę między elektroujemnościami węgla (2,55) i litu (0,98) wiązanie C-Li jest silnie spolaryzowane . Oszacowano, że separacja ładunków wynosi 55–95%. Ze względów praktycznych można często uznać, że n -BuLi reaguje jako anion butylowy n -Bu- i kation litu Li + .
Przygotowanie
Standardowym przygotowaniem n -BuLi jest reakcja 1-bromobutanu lub 1-chlorobutanu z metalem Li:
- 2 Li + C 4 H 9 X → C 4 H 9 Li + LiX (X = Cl, Br)
Jeśli lit użyty do tej reakcji zawiera 1–3% sodu , reakcja przebiega szybciej niż w przypadku użycia czystego litu. Rozpuszczalniki stosowane do tego przygotowania obejmują benzen , cykloheksan i eter dietylowy. Gdy BuBr jest prekursorem, produkt jest jednorodnym roztworem, składającym się z mieszanego klastra zawierającego zarówno LiBr, jak i BuLi, wraz z niewielką ilością oktanu . BuLi tworzy słabszy kompleks z LiCl, tak że w reakcji BuCl z Li powstaje osad LiCl .
Roztwory butylolitu, które są podatne na degradację w powietrzu, są standaryzowane przez miareczkowanie . Popularnym słabym kwasem jest bifenylo -4-metanol, który w punkcie końcowym daje głęboko zabarwioną pochodną dilitio.
Aplikacje
Butylolit jest głównie ceniony jako inicjator anionowej polimeryzacji dienów , takich jak butadien . Reakcja nazywa się „karbolitowaniem”:
- do 4 H 9 Li + CH 2 =CH-CH=CH 2 → do 4 H 9 -CH 2 -CH =CH-CH 2 Li
izopren można polimeryzować stereospecyficznie. Znaczenie handlowe ma również zastosowanie butylolitu do produkcji styrenowo-butadienowych . Nawet etylen wstawi się do BuLi.
Reakcje
Butylolit jest mocną zasadą (p K a ≈ 50), ale jest także silnym nukleofilem i reduktorem , w zależności od innych reagentów. Ponadto, oprócz tego, że jest silnym nukleofilem, n -BuLi wiąże się z aprotycznymi zasadami Lewisa, takimi jak etery i trzeciorzędowe aminy , które częściowo rozbijają klastry, wiążąc się z centrami litu. Jego użycie jako mocnej zasady jest określane jako metalowanie . Reakcje zazwyczaj prowadzi się w tetrahydrofuranie i eterze dietylowym , które są dobrymi rozpuszczalnikami dla powstałych pochodnych litoorganicznych (patrz poniżej).
Metalacja
Jedną z najbardziej użytecznych właściwości chemicznych n -BuLi jest jego zdolność do deprotonowania szerokiej gamy słabych kwasów Brønsteda . t -Butylolit i s -butylolit są bardziej zasadowe. n -BuLi może deprotonować (czyli metalować) wiele rodzajów wiązań C-H, zwłaszcza tam, gdzie sprzężona zasada jest stabilizowana przez delokalizację elektronów lub jeden lub więcej heteroatomów (atomów innych niż węgiel). Przykłady obejmują acetyleny ( H- CC-R), siarczki metylu ( H -CH 2 SR), tioacetale ( H -CH(SR) 2 , np. ditian ) , metylofosfiny ( H - CH2PR2 ) , furany , tiofeny i ferroceny (Fe( H - C5H4 )( C5H5 ) ) . Oprócz tego będzie również deprotonować wszystkie bardziej kwaśne związki, takie jak alkohole, aminy, enolizowalne związki karbonylowe i wszelkie jawnie kwaśne związki, w celu wytworzenia odpowiednio alkoholanów, amidów, enolanów i innych soli litu. Stabilność i lotność butanu wynikające z takich reakcji deprotonowania jest wygodna, ale może również stanowić problem w przypadku reakcji na dużą skalę ze względu na objętość wytwarzanego gazu palnego .
- LiC4H9 + RH → C4H10 + RLi _ _
Na zasadowość kinetyczną n -BuLi ma wpływ rozpuszczalnik lub współrozpuszczalnik. Ligandy kompleksujące Li + , takie jak tetrahydrofuran (THF), tetrametyloetylenodiamina (TMEDA), heksametylofosforamid (HMPA) i 1,4-diazabicyklo[2.2.2]oktan ( DABCO ) dodatkowo polaryzują wiązanie Li-C i przyspieszają metalację. Takie dodatki mogą również pomóc w wyodrębnieniu litowanego produktu, którego słynnym przykładem jest dilitioferrocen.
- Fe(C 5H 5 ) 2 + 2 LiC 4 H 9 + 2 TMEDA → 2 C 4 H 10 + Fe(C 5 H 4 Li) 2 (TMEDA) 2
Zasada Schlossera to superzasada wytwarzana przez traktowanie butylolitu t -butanolanem potasu . Jest kinetycznie bardziej reaktywny niż butylolit i jest często używany do wykonywania trudnych metalizacji . Chociaż obecna jest pewna ilość n -butylopotasu, który jest mocniejszą zasadą niż n -BuLi, reaktywność mieszaniny nie jest dokładnie taka sama jak wyizolowanego n -butylopotasu.
Przykładem zastosowania n -butylolitu jako zasady jest dodanie aminy do węglanu metylu w celu utworzenia karbaminianu metylu , gdzie n -butylolit służy do deprotonowania aminy:
- n -BuLi + R 2 NH + (MeO) 2 CO → R 2 NCO 2 Me + LiOMe + BuH
Wymiana halogen-lit
Butylolit reaguje z niektórymi organicznymi bromkami i jodkami w reakcji wymiany, tworząc odpowiednią pochodną litoorganiczną. Reakcja zwykle kończy się niepowodzeniem z organicznymi chlorkami i fluorkami:
- C 4 H 9 Li + RX → C 4 H 9 X + RLi (X = Br, I)
Ta reakcja wymiany litowo-halogenowej jest przydatna do przygotowania kilku rodzajów związków RLi, zwłaszcza arylolitu i niektórych odczynników winylolitowych . Użyteczność tej metody jest jednak znacznie ograniczona przez obecność w mieszaninie reakcyjnej n -BuBr lub n -BuI, które mogą reagować z powstającym reagentem RLi oraz konkurencyjne reakcje dehydrohalogenacji , w których n -BuLi służy jako baza:
- 2 C 4 H 9 Br + RLi → 2 C 4 H 9 R + LiBr
- 2 C 4 H 9 Li + R′CH=CHBr → 2 C 4 H 10 + R′C≡CLi + LiBr
Te reakcje uboczne są znacznie mniej ważne dla RI niż dla RBr, ponieważ wymiana jod-lit jest o kilka rzędów wielkości szybsza niż wymiana brom-lit. Z tych powodów preferowanymi substratami są jodki arylowe, winylowe i pierwszorzędowe alkilowe i t -BuLi zamiast n -BuLi, ponieważ utworzony t -BuI jest natychmiast niszczony przez t -BuLi w reakcji dehydrohalogenacji (wymaga to zatem dwa odpowiedniki t -BuLi). Alternatywnie, odczynniki winylolitowe można wytworzyć w bezpośredniej reakcji halogenku winylu (np. chlorku cykloheksenylu) z litem lub w drodze wymiany cynowo-litowej (patrz następna sekcja).
transmetalacje
Pokrewną rodziną reakcji są transmetalacje , w których dwa związki metaloorganiczne wymieniają swoje metale. Wiele przykładów takich reakcji obejmuje wymianę litu z cyną :
- C 4 H 9 Li + Me 3 SnAr → C 4 H 9 SnMe 3 + LiAr (gdzie Ar oznacza aryl, a Me oznacza metyl)
Reakcje wymiany cynowo-litowej mają jedną główną zaletę w porównaniu z wymianą halogenowo-litową stosowaną do wytwarzania odczynników litoorganicznych, ponieważ powstające związki cyny (C 4 H 9 SnMe 3 w powyższym przykładzie) są znacznie mniej reaktywne w stosunku do odczynników litowych niż produkty halogenkowe odpowiednich wymian halogen-lit (C 4 H 9 Br lub C 4 H 9 Cl). Inne metale i metaloidy , które ulegają takim reakcjom wymiany, to organiczne związki rtęci , selen i tellur .
Dodatki karbonylowe
Odczynniki litoorganiczne, w tym n -BuLi, są wykorzystywane w syntezie określonych aldehydów i ketonów . Jednym z takich szlaków syntezy jest reakcja odczynnika litoorganicznego z dipodstawionymi amidami :
- R 1 Li + R 2 CONMe 2 → LiNMe 2 + R 2 C(O)R 1
Degradacja THF
THF jest deprotonowany przez butylolit, zwłaszcza w obecności TMEDA , przez utratę jednego z czterech protonów sąsiadujących z tlenem. Ten proces, który zużywa butylolit do wytworzenia butanu, indukuje otwarcie pierścienia, dając enolan aldehydu octowego i etylenu . Dlatego reakcje BuLi w THF są zwykle przeprowadzane w niskich temperaturach, takich jak –78 ° C, co jest dogodnie wytwarzane przez kąpiel zamrażającą z suchego lodu i acetonu. Stosowane są również wyższe temperatury (-25 ° C lub nawet -15 ° C).
Rozkład termiczny
Po podgrzaniu n -BuLi, analogicznie do innych odczynników alkilolitowych z „β-wodorami”, ulega eliminacji β-wodorków z wytworzeniem 1-butenu i wodorku litu (LiH):
- C4H9Li → LiH + CH3CH2CH = CH2 _ _ _
Bezpieczeństwo
Związki alkilolitu są przechowywane w atmosferze gazu obojętnego, aby zapobiec utracie aktywności i ze względów bezpieczeństwa. n -BuLi reaguje gwałtownie z wodą:
- C4H9Li + H2O → C4H10 + LiOH _ _ _ _ _
Jest to reakcja egzergoniczna i wysoce egzotermiczna. Jeśli obecny jest tlen, wytworzony butan może się zapalić.
BuLi reaguje również z CO2 dając pentanian litu:
- C 4 H 9 Li + CO 2 → C 4 H 9 CO 2 Li
Zobacz też
- Propynylolit , związek metaloorganiczny.
Dalsza lektura
- Karty produktów producenta FMC Lithium
- Katalog chemii środowiska
- Weissenbacher, Anderson, Ishikawa, Organometallics , lipiec 1998, s. 681.7002, Chemicals Economics Handbook SRI International
- Plan testów HPV przedłożony przez FMC Lithium do EPA
- Ovaska, TV e-EROS Encyklopedia odczynników do syntezy organicznej „ n -butylolit”. Wiley i synowie. 2006. doi : 10.1002/047084289X.rb395
- Greenwood, NN; Earnshaw, A. Chemia pierwiastków , wyd. 1997: Butterworth-Heinemann, Boston.