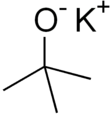Tert -butanolan potasu
|
|
|||
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
Tert -butanolan potasu |
|||
| Inne nazwy KOt-Bu, t- butanolan potasu.
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.011.583 | ||
|
PubChem CID
|
|||
| UNII | |||
|
Panel kontrolny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C4H9KO _ _ _ _ | |||
| Masa cząsteczkowa | 112,21 g mol -1 | ||
| Wygląd | solidny | ||
| Temperatura topnienia | 256 ° C (493 ° F; 529 K) | ||
| Temperatura wrzenia | sublimuje w temperaturze 220 ° C (1 mmHg) lub w temperaturze 140 ° C (0,01 hPa) | ||
| Reaguje z wodą | |||
| Rozpuszczalność w eterze dietylowym | 4,34 g/100 g (25-26°C) | ||
| Rozpuszczalność w heksanie | 0,27 g/100 g (25-26°C) | ||
| Rozpuszczalność w toluenie | 2,27 g/100 g (25-26°C) | ||
| Rozpuszczalność w THF | 25,00 g/100 g (25-26°C) | ||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
 
|
|||
| Niebezpieczeństwo | |||
| H228 , H252 , H314 | |||
| P405 | |||
| Karta charakterystyki (SDS) | MSDS z Oksfordu | ||
|
O ile nie zaznaczono inaczej, dane dotyczą materiałów w ich stanie normalnym (w temperaturze 25 °C [77 °F], 100 kPa).
|
|||
Tert -butanolan potasu to związek chemiczny o wzorze [(CH 3 ) 3 COK] n . To bezbarwne ciało stałe jest mocną zasadą (pKa sprzężonego kwasu około 17), która jest przydatna w syntezie organicznej . Związek jest często przedstawiany jako sól i często tak się zachowuje, ale jego jonizacja zależy od rozpuszczalnika.
Przygotowanie
T -butanolan potasu jest dostępny na rynku w postaci roztworu i ciała stałego, ale często wytwarza się go na miejscu do użytku laboratoryjnego, ponieważ próbki są bardzo wrażliwe , a starsze próbki są często złej jakości. Otrzymuje się go w reakcji suchego alkoholu tert -butylowego z metalicznym potasem . Ciało stałe otrzymuje się przez odparowanie tych roztworów, a następnie ogrzewanie ciała stałego. Substancję stałą można oczyścić metodą sublimacji.
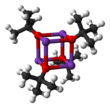
Struktura
Krystalizuje jako tetrameryczny klaster typu kubańskiego . Krystalizuje z tetrahydrofuranu / pentanu w temperaturze -20 °C jako [tBuOK·tBuOH] ∞ , który składa się z prostych łańcuchów połączonych wiązaniami wodorowymi . Sublimacja [tBuOK·tBuOH] ∞ daje tetramer [tBuOK] 4 , który przyjmuje strukturę kubańską. Łagodne zasadowe rozpuszczalniki Lewisa, takie jak THF i eter dietylowy, nie rozbijają struktury tetramerycznej, która utrzymuje się w substancji stałej, w roztworze, a nawet w fazie gazowej.
Reakcje
Jako baza
Donoszono o wielu modyfikacjach wpływających na reaktywność tego odczynnika. Związek przyjmuje złożoną strukturę skupień (obrazek obok to uproszczony rysunek), a dodatki modyfikujące skupienie wpływają na reaktywność odczynnika. Na przykład DMF , DMSO , heksametylofosforamid (HMPA) i 18-korona-6 oddziałują z centrum potasu, dając pary jonów rozdzielone rozpuszczalnikiem, takie jak K(DMSO) x + i tert -BuO - . Natomiast w benzenie związek pozostaje w postaci struktury klastrowej, która jest mniej zasadowa. Nawet w rozpuszczalnikach polarnych nie jest tak mocny jak zasady amidowe, np. diizopropyloamidek litu , ale silniejszy niż wodorotlenek potasu. . Jego reakcje masa przestrzenna powstrzymuje grupę od udziału w addycji nukleofilowej, takiej jak synteza eteru Williamsona lub powiązane SN2
Do substratów deprotonowanych za pomocą t -butanolanu potasu należą końcowe acetyleny i aktywne związki metylenu . Jest przydatny w dehydrohalogenacji . Ilustrując to drugie zachowanie, tert -butanolan potasu reaguje z chloroformem, dając dichlorokarben , który jest przydatny w dichlorocyklopropanacjach . Tert -butanolan potasu może oddzielić beta-proton od kationów alkiloamoniowych, prowadząc do produktu Hofmanna w reakcji eliminacji .
Inne reakcje
Tert -butanolan potasu katalizuje reakcję wodorosilanów i związków heterocyklicznych, w wyniku której powstają pochodne sililowe z uwolnieniem H2 .
Bezpieczeństwo
Tert -butanolan potasu jest bardzo silną zasadą, która szybko atakuje żywą tkankę.
Tert -butanolan potasu tworzy mieszaniny wybuchowe po potraktowaniu dichlorometanem.