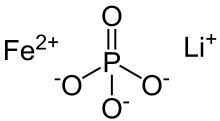
Fosforan litowo-żelazowy

|
|
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
żelazo(2+) fosforan litu (1:1:1)
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.124.705 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
|
FeLiO 4 P |
|
| Masa cząsteczkowa | 157.757 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Fosforan litowo-żelazowy lub żelazofosforan litu ( LFP ) jest związkiem nieorganicznym o wzorze LiFePO
4 . Jest to szare, czerwono-szare, brązowe lub czarne ciało stałe, które jest nierozpuszczalne w wodzie. Materiał zwrócił na siebie uwagę jako składnik akumulatorów litowo-żelazowo-fosforanowych , rodzaj akumulatorów litowo-jonowych . Ten skład chemiczny akumulatorów jest przeznaczony do stosowania w elektronarzędziach , pojazdach elektrycznych , instalacjach energii słonecznej, a ostatnio do magazynowania energii na dużą skalę w sieci .
Większość baterii litowych (Li-ion) używanych w produktach elektroniki użytkowej wykorzystuje katody wykonane z innych związków litu, takich jak tlenek litu-kobaltu ( LiCoO
2 ), tlenek litu-manganu ( LiMn
2 O
4 ) i tlenek litu-niklu ( LiNiO
2 ). Anody zazwyczaj wykonane z grafitu .
Fosforan litowo-żelazowy występuje naturalnie w postaci mineralnego trifylitu , ale materiał ten ma niewystarczającą czystość do stosowania w bateriach.
LiMPO
4
Przy ogólnym wzorze chemicznym LiMPO
4 związki z rodziny LiFePO
4 przyjmują strukturę oliwinu . M obejmuje nie tylko Fe, ale także Co, Mn i Ti. Ponieważ pierwszym komercyjnym LiMPO
4 był C/ LiFePO
4 , cała grupa LiMPO
4 jest nieformalnie nazywana „fosforanem litowo-żelazowym” lub „ LiFePO
4 ”. Jednak więcej niż jedna faza typu oliwinu może być używana jako materiał katodowy baterii. takie jak
, Ay MPO
4 , Li
1− x MFePO
4 i LiFePO
4− z M mają takie same struktury krystaliczne jak LiMPO
4 i mogą zastąpić je w katodzie. Wszystkie mogą być określane jako „LFP”.
Mangan, fosforany, żelazo i lit również tworzą strukturę oliwinu . Ta struktura jest użytecznym elementem katody akumulatorów litowych. Wynika to z oliwinowej struktury powstałej, gdy lit łączy się z manganem, żelazem i fosforanem (jak opisano powyżej). Oliwinowe struktury akumulatorów litowych są znaczące, ponieważ są niedrogie, stabilne i mogą być bezpiecznie wykorzystywane do magazynowania energii.
Historia i produkcja
Arumugam Manthiram i John B. Goodenough jako pierwsi zidentyfikowali klasę polianionów materiałów katodowych do akumulatorów litowo-jonowych . LiFePO
4 został następnie zidentyfikowany jako materiał katodowy należący do klasy polianionów do stosowania w bateriach w 1996 roku przez Padhi i in. Wykazano odwracalną ekstrakcję litu z LiFePO
4 i insercję litu do FePO
4 . Dyfrakcja neutronów potwierdziły, że LFP był w stanie zapewnić bezpieczeństwo dużego prądu wejściowego/wyjściowego baterii litowych.
Materiał można wytworzyć przez ogrzewanie różnych soli żelaza i litu z fosforanami lub kwasem fosforowym . Opisano wiele powiązanych dróg, w tym te, które wykorzystują syntezę hydrotermalną .
Fizyczne i chemiczne właściwości
W LiFePO
4 lit ma ładunek +1, żelazo +2, równoważąc ładunek −3 dla fosforanów. Po usunięciu Li materiał przekształca się w postać
żelazową FePO4 .
Atom żelaza i 6 atomów tlenu tworzą oktaedryczną sferę koordynacyjną , opisaną jako FeO
6 , z jonem Fe w środku. Grupy fosforanowe, PO
4 , są czworościenne. Trójwymiarowa rama jest utworzona przez FeO
6 , które dzielą O rogi. Jony litu znajdują się w oktaedrycznych kanałach w sposób zygzakowaty. W krystalografii uważa się, że ta struktura należy do grupy przestrzennej Pmnb rombowego układu kryształów. Stałe sieciowe wynoszą: a = 6,008 Å, b = 10,334 Å, oraz c = 4,693 Å. Objętość komórki elementarnej wynosi 291,4 Å 3 .
W przeciwieństwie do dwóch tradycyjnych materiałów katodowych, LiMnO
4 i LiCoO
2 , jony litu LiMPO
4 migrują w jednowymiarowej swobodnej objętości sieci. Podczas ładowania/rozładowania jony litu są usuwane jednocześnie z utlenianiem Fe:
Ekstrakcja litu z LiFePO
4 daje FePO
4 o podobnej strukturze. FePO
4 przyjmuje grupę przestrzenną P mnb o objętości komórki elementarnej 272,4 Å 3 , tylko nieznacznie mniejszej niż jego litowany prekursor. Ekstrakcja jonów litu zmniejsza objętość sieci, podobnie jak w przypadku tlenków litu. FeO
6 z dzielonymi narożnikami LiMPO
4 są oddzielone atomami tlenu PO
3− 4 czworościanów i nie może tworzyć ciągłej sieci FeO
6 , zmniejszając przewodnictwo.
Prawie ciasno upakowane heksagonalne układy centrów tlenków zapewniają stosunkowo niewielką wolną przestrzeń dla jonów Li + , w których mogą migrować.
Z tego powodu przewodnictwo jonowe Li . +
jest stosunkowo niskie w temperaturze otoczenia Zbadano szczegóły litowania FePO
4 i delitowania LiFePO
4 . W grę wchodzą dwie fazy litowanego materiału.
Aplikacje
Ogniwa LFP charakteryzują się napięciem roboczym 3,3 V, gęstością ładunku 170 mAh/g, dużą gęstością mocy , długą żywotnością cykliczną oraz stabilnością w wysokich temperaturach.
Głównymi zaletami komercyjnymi LFP jest to, że stwarza niewiele problemów związanych z bezpieczeństwem, takich jak przegrzanie i eksplozja, a także długie cykle życia, wysoką gęstość mocy i szerszy zakres temperatur roboczych. Elektrownie i samochody używają LFP.
BAE ogłosiło, że ich autobus hybrydowy HybriDrive Orion 7 wykorzystuje ogniwa akumulatorowe LFP o mocy około 180 kW. Firma AES opracowała systemy akumulatorów o mocy wielu bilionów watów, które są w stanie świadczyć dodatkowe usługi sieci energetycznej, w tym rezerwową pojemność i regulację częstotliwości. W Chinach na tym obszarze działają BAK i Tianjin Lishen.
Porównanie
właściwy (Ah/g) niż akumulatory litowe z materiałami katodowymi z tlenków (np. 70% więcej niż akumulatory niklowo-wodorowe .
Główne różnice między akumulatorami LFP a innymi typami akumulatorów litowo-jonowych polegają na tym, że akumulatory LFP nie zawierają kobaltu (co eliminuje kwestie etyczne i ekonomiczne dotyczące dostępności kobaltu) i mają płaską krzywą rozładowania.
Akumulatory LFP mają wady, wynikające z dużej rezystywności elektronicznej LFP, a także niższego maksymalnego napięcia ładowania/rozładowania. Gęstość energii jest znacznie niższa niż LiCoO
2 (chociaż wyższa niż w akumulatorze niklowo-wodorkowym ).
Chemia akumulatorów na bazie tlenku kobaltu litu jest bardziej podatna na niekontrolowany wzrost temperatury w przypadku przeładowania, a kobalt jest zarówno drogi, jak i niedostępny geograficznie. Inne chemikalia, takie jak nikiel-mangan-kobalt (NMC), wyparły ogniwa chemiczne LiCo w większości zastosowań. Pierwotny stosunek Ni do Mn do Co wynosił 3:3:3, podczas gdy obecnie produkowane są ogniwa w proporcjach 8:1:1 lub 6:2:2, przy czym zawartość Co została drastycznie zmniejszona.
LiFePO 4 są porównywalne z uszczelnionymi akumulatorami kwasowo-ołowiowymi i często są reklamowane jako zastępczy zamiennik dla zastosowań kwasowo-ołowiowych. Najbardziej zauważalną różnicą między fosforanem litowo-żelazowym a kwasem ołowiowym jest fakt, że pojemność baterii litowej wykazuje tylko niewielką zależność od szybkości rozładowania. Przy bardzo wysokich szybkościach rozładowania, np. 0,8C, pojemność akumulatora kwasowo-ołowiowego wynosi tylko 60% pojemności znamionowej. Dlatego w zastosowaniach cyklicznych, w których szybkość rozładowania jest często większa niż 0,1 C, akumulator litowy o niższej wartości znamionowej często będzie miał wyższą rzeczywistą pojemność niż porównywalny akumulator kwasowo-ołowiowy. Oznacza to, że przy tej samej pojemności lit będzie kosztować więcej, ale bateria litowa o mniejszej pojemności może być używana do tego samego zastosowania po niższej cenie. Koszt posiadania, biorąc pod uwagę cykl życia, dodatkowo zwiększa wartość baterii litowej w porównaniu z akumulatorem kwasowo-ołowiowym.
Własność intelektualna
Główne patenty związków LFP są w posiadaniu czterech organizacji. University of Texas-Austin za odkrycie materiału. Hydro-Québec , Université de Montréal i Francuskie Narodowe Centrum Badań Naukowych (CNRS) za powłokę węglową, która poprawia przewodność i faktycznie sprawia, że LFP nadaje się do rozwoju przemysłowego. Te patenty leżą u podstaw dojrzałych technologii produkcji masowej. Największe zdolności produkcyjne to do 250 ton miesięcznie. Kluczowa cecha Li
1− x MFePO
4 z A123 jest nano-LFP, który modyfikuje jego właściwości fizyczne i dodaje metale szlachetne w anodzie, a także zastosowanie specjalnego grafitu jako katody.
Główną cechą LiMPO
4 firmy Phostech jest zwiększona pojemność i przewodność dzięki odpowiedniej powłoce węglowej. Cechą szczególną LiFePO
4 • zM firmy Aleees jest wysoka pojemność i niska impedancja uzyskana dzięki stabilnej kontroli ferrytów i wzrostu kryształów. Ta ulepszona kontrola jest realizowana przez przyłożenie silnych mechanicznych sił mieszania do prekursorów w stanach wysokiego przesycenia, co indukuje krystalizację tlenków metali i LFP.
W pozwach patentowych w Stanach Zjednoczonych w 2005 i 2006 roku University of Texas w Austin | University of Texas-Austin i Hydro-Québec twierdziły, że LiFePO
4 jako katoda narusza ich patenty, US 5910382 i US 6514640 . Zastrzeżenia patentowe dotyczyły unikalnej struktury krystalicznej i wzoru chemicznego materiału katody baterii.
W dniu 7 kwietnia 2006 roku A123 złożył pozew o stwierdzenie nienaruszania i unieważnienia patentów UT. Firma A123 złożyła oddzielnie dwa ex parte przed Urzędem Patentów i Znaków Towarowych Stanów Zjednoczonych (USPTO), w których dążyła do unieważnienia patentów opartych na stanie techniki.
W równoległym postępowaniu sądowym UT pozwał Valence Technology, Inc. („Valence”) – firmę zajmującą się komercjalizacją produktów LFP, której zarzucano naruszenie.
USPTO wydało świadectwo ponownego rozpatrzenia patentu '382 w dniu 15 kwietnia 2008 r., a patentu '640 w dniu 12 maja 2009 r., na mocy którego zmieniono zastrzeżenia tych patentów. Pozwoliło to na kontynuację obecnych pozwów o naruszenie patentu wniesionych przez Hydro-Quebec przeciwko Valence i A123. Po rozprawie w sprawie Markmana, w dniu 27 kwietnia 2011 r., Western District Court of Texas orzekł, że roszczenia ponownie zbadanych patentów miały węższy zakres niż pierwotnie przyznany. Kluczowym pytaniem było, czy wcześniejsze Goodenough z University of Texas (na licencji Hydro-Quebec ) zostały naruszone przez firmę A123, która miała własne ulepszone wersje patentów LiFePO4, które zawierały domieszkę kobaltu . Końcowym rezultatem było licencjonowanie patentów Googenough przez A123 na nieujawnionych warunkach.
W dniu 9 grudnia 2008 r. Europejski Urząd Patentowy unieważnił patent dr Goodenougha o numerze 0904607. Decyzja ta zasadniczo zmniejszyła ryzyko patentowe związane z wykorzystaniem LFP w europejskich zastosowaniach samochodowych. Uważa się, że decyzja opiera się na braku nowości.
Pierwszą dużą ugodą był pozew między NTT a University of Texas-Austin (UT). W październiku 2008 roku NTT ogłosiło, że rozstrzygnie sprawę w Japońskim Najwyższym Sądzie Cywilnym za 30 milionów dolarów. W ramach umowy UT zgodziło się, że NTT nie kradnie informacji i że NTT udostępni UT swoje patenty LFP. Patent NTT dotyczy również oliwinu LFP o ogólnym wzorze chemicznym A
y MPO
4 (A oznacza metal alkaliczny, a M połączenie Co i Fe), obecnie używanego przez firmę BYD . Chociaż chemicznie materiały są prawie takie same, z punktu widzenia patentów Ay MPO
4
NTT różni się od materiałów objętych UT. Y
MPO 4
. ma większą pojemność niż LiMPO
4 Istotą sprawy było to, że inżynier NTT Okada Shigeto, który pracował w laboratoriach UT opracowując materiał, został oskarżony o kradzież własności intelektualnej UT .
Od 2020 roku organizacja o nazwie LifePO + C twierdzi, że jest właścicielem kluczowego adresu IP i oferuje licencje. Jest to konsorcjum pomiędzy Johnson Matthey, CNRS, University of Montreal i Hydro Quebec.
Badania
Gęstość mocy
LFP ma dwie wady: niską przewodność (wysoki nadpotencjał) i niską stałą dyfuzji litu, które ograniczają szybkość ładowania/rozładowania. Dodanie cząstek przewodzących do delitowanego FePO
4 zwiększa jego przewodnictwo elektronowe. Na przykład dodanie cząstek przewodzących o dobrych zdolnościach dyfuzyjnych, takich jak grafit i węgiel, do LiMPO
4 znacznie poprawia przewodnictwo między cząstkami, zwiększa wydajność LiMPO
4 i podnosi jego odwracalną pojemność do 95% wartości teoretycznych. Jednak dodatek przewodzących dodatków zwiększa również „masę martwą” obecną w ogniwie, która nie przyczynia się do magazynowania energii. LiMPO
4 wykazuje dobrą wydajność cykliczną nawet przy prądzie ładowania/rozładowania tak dużym jak 5C.
Stabilność
Powlekanie LFP tlenkami nieorganicznymi może uczynić strukturę LFP bardziej stabilną i zwiększyć przewodnictwo. Tradycyjny LiCoO
2 z powłoką tlenkową wykazuje lepszą wydajność cykliczną. Powłoka ta hamuje również rozpuszczanie Co i spowalnia zanik pojemności LiCoO
2 . Podobnie LiMPO
4 z powłoką nieorganiczną, taką jak ZnO i ZrO
2 , ma lepszą żywotność cykliczną, większą pojemność i lepsze właściwości przy szybkim rozładowaniu. Dodatek przewodzącego węgla zwiększa wydajność. Mitsui Zosen i Aleees poinformowali, że dodanie przewodzących cząstek metali, takich jak miedź i srebro, zwiększyło wydajność. LiMPO
4 z 1% wag. dodatków metalicznych ma odwracalną pojemność do 140 mAh/g i lepszą wydajność przy wysokim prądzie rozładowania.
Zastąpienie metalu
Zastąpienie żelaza lub litu innymi metalami w LiMPO
4 również może podnieść wydajność. Zastąpienie cynku żelazem zwiększa krystaliczność LiMPO
4 , ponieważ cynk i żelazo mają podobne promienie jonowe. Woltamperometria cykliczna potwierdza, że LiFe
1− x M
x PO
4 , po podstawieniu metalem, ma większą odwracalność insercji i ekstrakcji jonów litu. Podczas ekstrakcji litu Fe (II) utlenia się do Fe (III) i zmniejsza się objętość sieci. Zmniejszająca się objętość zmienia ścieżki powrotu litu.
Procesy syntezy
Produkcja masowa o stabilności i wysokiej jakości wciąż napotyka wiele wyzwań.
Podobnie jak tlenki litu, LiMPO
4 można syntetyzować różnymi metodami, w tym: syntezą w fazie stałej , suszeniem emulsji, procesem zol-żel , współstrącaniem roztworu, osadzaniem w fazie gazowej , syntezą elektrochemiczną, napromienianiem wiązką elektronów , procesem mikrofalowym [ niejasne ] , synteza hydrotermalna, piroliza ultradźwiękowa i piroliza natryskowa .
W procesie suszenia emulsji emulgator najpierw miesza się z naftą. Następnie do tej mieszaniny dodaje się roztwory soli litu i soli żelaza. W procesie tym powstają cząsteczki nanowęgla. Synteza hydrotermalna daje LiMPO
4 o dobrej krystaliczności. Węgiel przewodzący otrzymuje się przez dodanie do roztworu glikolu polietylenowego, a następnie obróbkę termiczną. Osadzanie w fazie gazowej wytwarza cienką warstwę LiMPO
4 . Podczas pirolizy z natryskiem płomieniowym FePO 4 miesza się z węglanem litu i glukozą i ładuje elektrolity . Następnie mieszaninę wstrzykuje się do płomienia i filtruje w celu zebrania
zsyntetyzowanego LiFePO4 .
Wpływ temperatury
Wpływ temperatury na akumulatory litowo-żelazowo-fosforanowe można podzielić na wpływ wysokiej i niskiej temperatury.
Zasadniczo akumulatory chemiczne LFP są mniej podatne na niekontrolowane reakcje termiczne, takie jak te, które występują w akumulatorach litowo-kobaltowych; Akumulatory LFP wykazują lepszą wydajność w podwyższonej temperaturze. Badania wykazały, że w temperaturze pokojowej (23°C) początkowa utrata pojemności wynosi około 40-50 mAh/g. Jednak w temperaturze 40°C i 60°C straty pojemności wynoszą odpowiednio około 25 i 15 mAh/g, ale te straty pojemności były rozłożone na 20 cykli zamiast masowej utraty takiej jak w przypadku utraty pojemności w temperaturze pokojowej.
Dotyczy to jednak tylko krótkich okresów rowerowych. Późniejsze całoroczne badanie wykazało, że pomimo tego, że akumulatory LFP mają dwukrotnie równoważny pełny cykl, wskaźnik losu pojemności wzrastał wraz ze wzrostem temperatury dla ogniw LFP, ale rosnąca temperatura nie wpływa na ogniwa NCA lub ma znikomy wpływ na starzenie się ogniw NMC. Ten spadek pojemności wynika przede wszystkim z przyspieszenia reakcji tworzenia interfejsu stałego elektrolitu (SEI) przez wzrost temperatury.
Akumulatory LFP są szczególnie narażone na spadającą temperaturę, co może utrudniać ich stosowanie na obszarach położonych na dużych szerokościach geograficznych. Początkowe pojemności wyładowań dla próbek LFP/C w temperaturach 23, 0, -10 i -20°C wynoszą 141,8, 92,7, 57,9 i 46,7 mAh/g przy sprawności kulombowskiej 91,2%, 74,5%, 63,6% i 61,3%. Straty te są spowodowane powolną dyfuzją jonów litu w elektrodach i tworzeniem się SEI, które pojawiają się w niższych temperaturach, co następnie zwiększa opór przenoszenia ładunku na powierzchniach międzyfazowych elektrolit-elektroda. Inną możliwą przyczyną tworzenia się obniżonej pojemności jest powlekanie litem. Jak wspomniano powyżej, niska temperatura obniża szybkość dyfuzji jonów litu w elektrodach, umożliwiając konkurowanie szybkości powlekania litem z szybkością interkalacji. Chłodniejsze warunki prowadzą do szybszego wzrostu i przesuwania punktu początkowego do niższego stanu naładowania, co oznacza, że proces powlekania rozpoczyna się wcześniej. Platerowanie litem zużywa lit, który następnie konkuruje z interkalacją litu w grafit, zmniejszając pojemność akumulatorów. Zagregowane jony litu osadzają się na powierzchni elektrod w postaci „płytek” lub nawet dendrytów, które mogą przeniknąć przez separatory powodując całkowite zwarcie akumulatora.
