Bis(trimetylosililo)amidek litu
|
|
 Monomer (nie istnieje)
|
|
 Cykliczny trimer
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
1,1,1-trimetylo - N- (trimetylosililo)silanaamid litu |
|
| Inne nazwy Heksametylodisilazydek litu Heksametylodisilazan, sól litowa |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.021.569 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| LiN(Si(CH 3 ) 3 ) 2 | |
| Masa cząsteczkowa | 167,33 g·mol -1 |
| Wygląd | Białe ciało stałe |
| Gęstość | 0,86 g/cm3 w temperaturze 25°C |
| Temperatura topnienia | 71 do 72 ° C (160 do 162 ° F; 344 do 345 K) |
| Temperatura wrzenia | 80 do 84 ° C (176 do 183 ° F; 353 do 357 K) (0,001 mm Hg) |
| rozkłada się | |
| Rozpuszczalność |
Większość rozpuszczalników aprotonowych THF , heksan , toluen |
| Kwasowość ( p Ka ) | 26 |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
łatwopalny, żrący |
| Związki pokrewne | |
|
Związki pokrewne
|
Bis(trimetylosililo)amidek sodu Bis(trimetylosililo)amidek potasu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
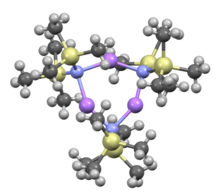
Bis(trimetylosililo)amidek litu jest litowanym związkiem krzemoorganicznym o wzorze LiN(Si(CH 3 ) 3 ) 2 . Jest powszechnie określany skrótem LiHMDS lub Li (HMDS) ( heksametylodisilazydek litu - odniesienie do jego sprzężonego kwasu HMDS ) i jest używany głównie jako silna nienukleofilowa zasada i jako ligand . Podobnie jak wiele odczynników litowych, ma tendencję do agregacji i tworzy cykliczny trimer w przypadku braku elementów koordynujących.
Przygotowanie
LiHMDS jest dostępny w handlu, ale można go również wytworzyć przez deprotonowanie bis (trimetylosililo) aminy za pomocą n -butylolitu . Tę reakcję można przeprowadzić in situ .
- HN(Si(CH 3 ) 3 ) 2 + C 4 H 9 Li → LiN(Si(CH 3 ) 3 ) 2 + C 4 H 10
Po utworzeniu związek można oczyścić przez sublimację lub destylację .
Reakcje i aplikacje
Jako baza
LiHMDS jest często używany w chemii organicznej jako silna zasada nienukleofilowa . Jego sprzężony kwas ma p Ka ~ ~ 26, co czyni go mniej zasadowym niż inne zasady litowe, takie jak LDA (p Ka sprzężonego kwasu 36), ale jest bardziej zawadą przestrzenną , a zatem mniej nukleofilowy . Można go stosować do tworzenia różnych litoorganicznych , w tym acetylenków lub enolanów litu .
gdzie Ja = CH 3 . Jako taki znajduje zastosowanie w szeregu reakcji sprzęgania, zwłaszcza w reakcjach tworzenia wiązań węgiel-węgiel, takich jak alkilowanie Frátera-Seebacha i mieszane kondensacje Claisena .
Alternatywna synteza tetraazotku tetrasiarki polega na wykorzystaniu jako prekursora S(N(Si(CH 3 ) ) 2 ) 2 z wcześniej utworzonymi wiązaniami S – N. S(N(Si(CH 3 ) 3 ) 2 ) 2 otrzymuje się w reakcji bis(trimetylosililo)amidku litu i dichlorku siarki ( SCl 2 ).
- 2 LiN(Si(CH 3 ) 3 ) 2 + SCl 2 → S(N(Si(CH 3 ) 3 ) 2 ) 2 + 2 LiCl
S S (N(Si(CH 3 ) ) 2 ) 2 reaguje 4 N 4 z połączeniem SCl 2 i chlorku sulfurylu ( SO 2 Cl 2 ) tworząc , chlorek trimetylosililu i dwutlenek siarki :
- 2 S(N(Si(CH 3 ) 3 ) 2 ) 2 + 2 SCl 2 + 2 SO 2 Cl 2 → S 4 N 4 + 8 (CH 3 ) 3 SiCl + 2 SO 2
Jako ligand
Li (HMDS) może reagować z szeroką gamą halogenków metali w reakcji metatezy soli , dając bis (trimetylosililo) amidy metali .
- MX n + n Li(HMDS) → M(HMDS) n + n LiX
gdzie X = Cl, Br, I i czasami F
Kompleksy bis(trimetylosililo)amidu metalu są lipofilowe ze względu na ligand, a zatem są rozpuszczalne w szeregu niepolarnych rozpuszczalników organicznych , co często czyni je bardziej reaktywnymi niż odpowiadające im halogenki metali, które mogą być trudne do rozpuszczenia. Przestrzenna masa ligandów powoduje, że ich kompleksy są dyskretne i monomeryczne ; dodatkowo zwiększając ich reaktywność. Mając wbudowaną zasadę, związki te dogodnie reagują z prekursorami ligandów protonowych, dając inne kompleksy metali, a zatem są ważnymi prekursorami bardziej złożonych związków koordynacyjnych .
Zastosowania niszowe
LiHMDS jest lotny i został omówiony do stosowania do osadzania warstw atomowych związków litu.
Struktura
Podobnie jak wiele odczynników litoorganicznych , bis(trimetylosililo)amidek litu może tworzyć agregaty w roztworze. Stopień agregacji zależy od rozpuszczalnika. W rozpuszczalnikach koordynujących, takich jak etery i aminy , dominuje monomer i dimer . W stanie monomerycznym i dimerycznym jedna lub dwie cząsteczki rozpuszczalnika wiążą się z centrami litu. Z amoniakiem jako zasadą donorową bis(trimetylosililo)amidek litu tworzy trisolwatowany monomer, który jest stabilizowany międzycząsteczkowymi wiązaniami wodorowymi. W rozpuszczalnikach niekoordynujących, takich jak związki aromatyczne lub pentan , przeważają złożone oligomery , w tym trimer. W stanie stałym struktura jest trimeryczna.

|
||||
 Addukt LiHMDS z TMEDA |
 Dimer solwatowany THF : [(LiHMDS) 2 (THF) 2 ] |
 Trimer, bez rozpuszczalnika: [(LiHMDS) 3 ] |
||
Zobacz też
- ^ Amonoo-Neizer, EH; Shaw, RA; Skovlin, DO; Smith, BC (1966). Bis(trimetylosililo)amidek litu i tris(trimetylosililo)amina . Inorg. Syntezator. Syntezy nieorganiczne. Tom. 8. s. 19–22. doi : 10.1002/9780470132395.ch6 . ISBN 978-0-470-13239-5 .
- ^ a b Danheiser, RL; Miller, RF; Brisbois, RG (1990). „Detrifluoroacetylative Diazo Group Transfer: ( E ) -1-Diazo-4-fenylo-3-buten-2-on” . Syntezy organiczne . 73 : 134 .; Tom zbiorowy , obj. 9, s. 197
- ^ a b Wu, George; Huang, Mingsheng (lipiec 2006). „Odczynniki litoorganiczne w asymetrycznych procesach farmaceutycznych”. Recenzje chemiczne . 106 (7): 2596–2616. doi : 10.1021/cr040694k . PMID 16836294 .
- ^ Fraser, Robert R.; Mansour, Tarek S.; Savard, Sylvain (sierpień 1985). „Pomiary kwasowości pirydyn w tetrahydrofuranie przy użyciu litowanych silyloamin”. Journal of Chemii Organicznej . 50 (17): 3232–3234. doi : 10.1021/jo00217a050 .
- Bibliografia _ Shvari, J.; Laitinen, RS; Szczypiorek, T (2002). „Związki o znaczeniu ogólnym”. W Coucouvanis, Dimitri (red.). Syntezy nieorganiczne . Syntezy nieorganiczne. Tom. 33. Nowy Jork: John Wiley & Sons, Inc., s. 196–199. doi : 10.1002/0471224502.ch4 . ISBN 9780471208259 .
-
^
Michael Lappert , Andrey Protchenko, Philip Power , Alexandra Seeber (2009). Chemia metaloamidów . Weinheim: Wiley-VCH. doi : 10.1002/9780470740385 . ISBN 978-0-470-72184-1 .
{{ cite book }}: CS1 maint: wiele nazwisk: lista autorów ( link ) - ^ Hämäläinen, Jani; Holopainen, Jani; Munnik, Frans; Hatanpää, Timo; Heikkilä, Mikko; Ritala, Mikko; Leskelä, Markku (2012). „Cienkie warstwy fosforanu litu hodowane przez osadzanie warstwy atomowej”. Dziennik Towarzystwa Elektrochemicznego . 159 (3): A259-A263. doi : 10.1149/2.052203jes .
- ^ Lucht, Brett L.; Collum, David B. (1995). „Eteryczna solwatacja heksametylodisilazydku litu: nieoczekiwane zależności liczby solwatacji, energii solwatacji i stanu agregacji”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 117 (39): 9863–9874. doi : 10.1021/ja00144a012 .
- ^ a b Lucht, Brett L.; Collum, David B. (1996). „Solwatacja litowo-jonowa: solwaty amin i nienasyconych węglowodorów heksametylodisilazydku litu (LiHMDS)”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 118 (9): 2217–2225. doi : 10.1021/ja953029p .
- Bibliografia _ Michel, R.; Herbst-Irmer, R.; Schöne, R.; Stalke, D. (2016). „Wprowadzenie donora wiązań wodorowych do słabo nukleofilowej zasady Brønsteda: heksametylodisilazydki metali alkalicznych (MHMDS, M = Li, Na, K, Rb i Cs) z amoniakiem”. chemia Eur. J. 22 (35): 12340–12346. doi : 10.1002/chem.201600833 . PMID 27457218 .
- ^ Neufeld, R .: DOSY External Calibration Curve Oznaczanie masy cząsteczkowej jako cenna metodologia charakteryzowania reaktywnych związków pośrednich w roztworze. W: eDiss, Georg-August-Universität Göttingen. 2016.
- ^ Rogers, Robin D.; Atwood, Jerry L.; Gruning, Rainer (1978). „Struktura krystaliczna N -litioheksametylodisilazanu, [LiN(SiMe 3 ) 2 ] 3 ”. J. Organomet. chemia 157 (2): 229–237. doi : 10.1016/S0022-328X(00)92291-5 .
