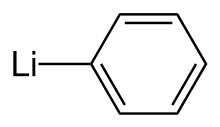
fenylolit
|
|
| Nazwy | |
|---|---|
|
Systematyczna nazwa IUPAC
fenylolit |
|
| Inne nazwy Litiobenzen [ potrzebne źródło ]
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| Skróty | LiPh, PhLi |
| 506502 | |
| CHEBI | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.008.838 |
| Numer WE |
|
| 2849 | |
| Siatka | fenylolit |
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
|
LiC 6 H 5 |
|
| Masa cząsteczkowa | 84,045 g mol -1 |
| Wygląd | Bezbarwne kryształy |
| Gęstość | 828 mg cm -3 |
| Temperatura wrzenia | 140 do 143 ° C (284 do 289 ° F; 413 do 416 K) |
| Reaguje | |
| Termochemia | |
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
48,3-52,5 kJ mol -1 |
| Zagrożenia | |
| Oznakowanie GHS : | |
  
|
|
| Niebezpieczeństwo | |
| H226 , H250 , H261 , H302 , H312 , H314 , H332 | |
| P210 , P222 , P231+P232 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P280 , P301 + P312 , P301 + P330+P331 , P302+P 334 , P302 + P352 , P303 + P361 +P353 , P304 +P312 , P304 +P340 , P305+P351+P338 , P310 , P312 , P321 , P322 , P330 , P363 , P370 +P378 , P402+P404 , P403+P235 , P405 , P422 , P501 | |
| Karta charakterystyki (SDS) | Zewnętrzna karta charakterystyki |
| Związki pokrewne | |
|
Związki pokrewne
|
fenylomiedź , fenylosód , fenylokobalt |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Fenylolit lub litobenzen jest środkiem metaloorganicznym o wzorze empirycznym C 6 H 5 Li. Stosowany jest najczęściej jako czynnik metalujący w syntezach organicznych oraz zamiennik odczynników Grignarda do wprowadzania grup fenylowych w syntezach organicznych. Krystaliczny fenylolit jest bezbarwny; jednakże roztwory fenylolitu mają różne odcienie brązu lub czerwieni, w zależności od użytego rozpuszczalnika i zanieczyszczeń obecnych w substancji rozpuszczonej.
Przygotowanie
Fenylolit został po raz pierwszy wyprodukowany w reakcji metalicznego litu z difenylortęcią :
- (C 6 Η 5 ) 2 Ηg + 2Li → 2C 6 Η 5 Li + Ηg
Reakcja halogenku fenylu z litem metalicznym daje fenylolit:
- X-Ph + 2Li → Ph-Li + LiX
Fenylolit można również zsyntetyzować w reakcji wymiany metal-halogen:
- n-BuLi + X-Ph → n-BuX + Ph-Li
Obecnie dominującą metodą produkcji fenylolitu są dwie ostatnie syntezy.
Reakcje
Podstawowym zastosowaniem PhLi jest ułatwienie tworzenia wiązań węgiel-węgiel w reakcjach addycji i podstawienia nukleofilowego:
- PhLi + R2C = O → PhR2COLi
2-fenylopirydynę otrzymuje się w reakcji fenylolitu z pirydyną, w procesie obejmującym szlak addycji-eliminacji:
- C 6 H 5 Li + C 5 H 5 N → C 6 H 5 -C 5 H 4 N + LiH
Struktura i właściwości
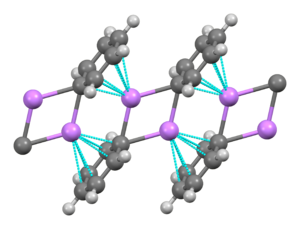
Fenylolit jest związkiem litoorganicznym , który tworzy jednoskośne kryształy. Stały fenylolit można opisać jako składający się z dimerycznych podjednostek Li 2 Ph 2 . Atomy Li i ipso pierścieni fenylowych tworzą płaski czteroczłonowy pierścień. Płaszczyzna grup fenylowych jest prostopadła do płaszczyzny tego pierścienia Li2C2 . Dodatkowe silne wiązanie międzycząsteczkowe występuje między tymi dimerami fenylolitu a elektronami π grup fenylowych w sąsiednich dimerach, co skutkuje nieskończoną polimerową strukturą drabinkową.
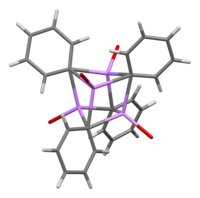
W roztworze wymaga różnych struktur zależnych od rozpuszczalnika organicznego. W tetrahydrofuranie równoważy stany monomeru i dimeru. W eterze, jak jest powszechnie sprzedawany, fenylolit występuje jako tetramer. Cztery atomy Li i cztery centra węglowe ipso zajmują naprzemienne wierzchołki zniekształconego sześcianu. Ph
Długości wiązań C – Li wynoszą średnio 2,33 Å. Cząsteczka eteru wiąże się z każdym z miejsc Li poprzez swój atom tlenu. W obecności LiBr, produktu ubocznego bezpośredniej reakcji litu z halogenkiem fenylu, kompleks [(PhLi•Et 2 O) 4 ] zamiast tego staje się [(PhLi•Et 2 O) 3 •LiBr). Atom Li LiBr zajmuje jedno z miejsc litu w klastrze typu kubanowego , a atom Br znajduje się w sąsiednim miejscu węglowym.